Билет № 1
1) Физико-химические методы анализа. Классификация методов. Основаны на использовании зависимости физических свойств веществ (например, светопоглощения, электрической проводимости и т.д.) от их химического состава. По сравнению с классическими химическими методами ФХМА отличаются меньшим пределом обнаружения, временем и трудоёмкостью. ФХМА позволяют проводить анализ на расстоянии, автоматизировать процесс анализа и выполнять его без разрушения образца (недеструктивный анализ).
Ф-Х методы делятся на:
1. Оптические (молекулярная спектроскопия): колориметрия,фотоколориметрия, спектрофотометрия, турбидиметрия, нефелометрия, хемилюминесцентный метод. К оптическим методам анализа относится совокупность методов качественного и количественного анализов по
интенсивности инфракрасного (ИК), видимого и ультрафиолетового (УФ) излучения.
2. Элекрохимические: фтамперометрия (полярография, в/а на твёрдых электродах, дифференциальная в/а, инверсионная в/а), амперометрия, потенциометрия, кулонометрия, кондуктометрия. Электрохимические методы анализа (ЭХМА) основаны на изучении зависимости электрических параметров химической системы от концентрации, природы и структуры ее компонентов.
3. Кинетические (каталитические методы). Предел обнаружения до 10-11 мг/л. Это методы определения концентраций веществ, основанные на измерении скорости реакции. В кинетических методах анализа измеряемым свойством системы, на основании которого судят о концентрации вещества, является скорость химической реакции.
Билет № 2
Потенциометрический метод анализа. Сущность метода. Область его применения.
Основан на измерении потенциалов электродов, погруженных в титруемый раствор.
В потенциометрическом методе для обнаружения конца титрования эквивалентную точку определяют при помощи "скачка потенциала" индикаторного электрода.
Потенциал индикаторного электрода определяется известным уравнением Нернста и находится в прямой зависимости от логарифма концентрации определяемого иона.
В потенциометрическом методе анализа титрование производится с двумя электродами. Электрод, который реагирует на изменение концентрации определяемого иона в растворе, называется индикаторным. Другой электрод является индиферентным по отношению к титруемым ионам. Он служит только для определения потенциала индикаторного электрода и называется электродом сравнения.
В потенциометрическом титровании используютсяО-В реакции, реакции осаждения и комплексообразования, а также изменение в результате реакции рН раствора. Индикаторный электрод выбирают в каждом отдельном случае в соответствии с типом реакции, лежащей в основе потенциометрического титрования.
Потенциометрический метод может быть применен ко многим реакциям осаждения и комплексообразования с использованием подходящей электродной пары. В качестве электродов применяют, например, серебро и ртуть. Так, определение никеля титрованием цианистым калием производят, с серебряным электродом. Применяются также электроды, покрытые труднорастворимой солью того же металла. Например, хлористосеребряные, бромистосеребряные, йодистосеребряные и сернистосеребряные электроды. Очень часто при реакциях осаждения и комплексообразования применяют платиновый электрод. В этом случае вводят дополнительно окислительно-восстановительную систему.
Области применения
Наиболее часто используется в кислотно-основном титровании. В титруемый раствор опускают стеклянный электрод и электрод сравнения и измеряют значения ЭДС цепи при добавлении кислоты или щелочи.
Результаты титрования позволяют определять константы диссоциации слабых кислот и оснований, в том числе полифункциональных. По этой причине потенциометрический метод является одним из важнейших методов изучения полиэлектролитов, в том числе и биополимеров, таких как белки, полипептиды, нуклеиновые кислоты.
2) Устройство ФЭК-56 М. Применение фотометрического анализа.
Устройство ФЭК-56 М- это фотоэлектроколориметр-нефелометр. Это двухлучевой универсальный прибор, служащий для определения концентрации вещества в окрашенных и коллоидных растворах путем сравнения их оптической плотности с оптической плотностью стандартных растворов в диапазоне 315-670 нм.
Фотометрический анализ – один из видов молекулярного абсорбционного анализа (анализа поглощения электромагнитного излучения молекулами и сложными ионами анализируемого вещества в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра).
Положительные стороны использования фотометрии:
1)Наличие разнообразных фотометрических методик анализа практически на все элементы периодической системы и многочисленные органические вещества;
2)Возможность использования относительно недорогой и доступной аппаратуры;
3)Возможность фотометрических определений соединений в интервале от 100 до 0,000001%, включая анализ веществ высокой степени очистки;4)Специфичность, относительная простота измерений
Фотометрия делится на Спектрофотометрия-Метод основан на поглощении монохроматического излучения, т. е. излучения с одной длиной волны в видимой и УФ областях спектра и Фотоколориметрия-Метод основан на поглощении полихроматического излучения, т. е. пучка лучей с близкими длинами волны в видимой области спектра.
Оба метода основаны на общем принципе — пропорциональной зависимости между светопоглощением и концентрацией определяемых веществ. Применяя фотометрический анализ, можно определять малые количества вещества, например, содержание примесей:не ниже 5 × 10–5 % (спектрофометрически) и 1 × 10–4 % (фотоколориметрически) при погрешности определения 1—3 %
Билет №3
Билет №4
Билет № 5
Билет № 6
Билет № 7
Ионообменная хроматография.
В основе ионообменной хроматографии лежит обратимый стехиометрический обмен ионов, содержащихся в хроматографируемом растворе, на ионы веществ, называемых ионитами (ионобменниками).
Иониты могут быть органические и неорганические, природные и синтетические.
К природным ионитам относятся алюмосиликаты, некоторые сорта каменных углей, мягкие и твердые угли даже без предварительной обработки.
В аналитической практике широко используют синтетические иониты.
Разделение происходит благодаря разному сродству компонентов определяемой смеси к неподвижной фазе и разным скоростям перемещения по колонке. Неподвижной фазой в ионообменной хроматографии являются иониты.
По знаку обменивающихся ионов различают катиониты (для обмена катионов) и аниониты (для обмена анионов).
Органические катиониты содержат кислотные функциональные группы: SO3Н, PO3Н2, COOН, OH.
Органические аниониты содержат группы основного характера: NH2+, = NH+, ≡N+, N(CH3)3+.
Основные хроматографические разделения с применением ионообменников проводят в водных растворах, смешанных растворителях (вода-метанол) или в водных буферных растворах. Катиониты диссоциирующие с образованием высокомолекулярного аниона и подвижного катиона, легко обменивающегося на другие катионы. Аниониты диссоциируют на высокомолекулярный катион и подвижный анион, способный обмениваться на другие анионы.
2. Отбор и подготовка к анализу почвенных проб.
При отборе проб почвы необходимо соблюдать два основных требования:
1. Количество отобранного материала должно быть достаточным для анализа.
2. Пробы по составу должны соответствовать среднему составу исследуемого объекта.
Этапом, предшествующим отбору проб, является изучение почвенных карт и рекогносцировочный осмотр территории. Точечные пробы (20-40 шт) отбирают на пробной площадке из одного или нескольких слоёв или горизонтов методом конверта, по диагонали или любым другим способом.
Масса объединённой пробы должна быть не менее 1 кг. При отборе точечных проб и составлении объединённой пробы должна быть исключена возможность их вторичного загрязнения.
Все объединённые пробы должны быть зарегистрированы в журнале и пронумерованы. На каждую пробу должен быть заполнен сопроводительный талон.
В процессе транспортировки и хранения почвенных проб должны быть приняты меры по пресечению возможности их вторичного загрязнения.
Пробы почвы для химического анализа высушивают до воздушно-сухого состояния. Воздушно-сухие пробы хранят в матерчатых мешочках, в картонных коробках или в стеклянной таре.
Для определения химических веществ пробу почвы в лаборатории рассыпают на бумаге или кальке и разминают пестиком крупные комки. Затем удаляют включения – корни растений, насекомых. Почву растирают в ступке пестиком и просеивают через сито с диаметром отверстий 1 мм.
Для определения валового содержания минеральных компонентов из просеянной пробы отбирают представительную пробу массой не более 20 г и растирают ее до пудрообразного состояния.
Билет № 8
1. Общая характеристика спектроскопических методов анализа.
Спектральный анализ – это физический метод определения состава вещества, основанный на изучении спектров испускания, поглощения, отражения и люминесценции. Атомы каждого элемента испускают излучение определенных длин волн, это в свою очередь, позволяет определить, какие элементы входят в состав данного вещества. Все спектроскопические методы основаны на взаимодействии атомов, молекул или ионов, входящих в состав анализируемого вещества, с электромагнитным излучением. Это взаимодействие проявляется в поглощении или испускании фотонов (квантов). В зависимости от того, какие частицы формируют аналитический сигнал, различают методы атомной и молекулярной спектроскопии(атомные спектры - линейчатые, в то время как молекулярные состоят из широких полос поглощения или испускания).
Классификация:
-В эмиссионных методах анализируемая проба в результате ее возбуждения излучает фотоны (кванты).
-В абсорбционных методах излучениепостороннего источника пропускают через пробу, при этом часть квантов избирательно поглощается атомами или молекулами.
-Комбинационные методы – используют спектры комбинационного рассеяния жидких, твердых и газообразных проб.
- Люминесцентные методы – используют спектры люминесценции вещества, возбуждаемые УФ и ИК излучениями.
- Рентгеновские методы – используют рентгеновские спектры атомов, получающиеся при переходах внутренних электронов.
- Радиоспектроскопические методы – использующие спектры поглощения молекул на участке спектра с длинами волн больше 1мм.
2. Методы получения хроматограмм. Типы стационарных и подвижных фаз.
Хроматография - физико-хим. метод разделения, обнаружения и определения смесей веществ, основанный на распределении компонентов между двумя несмешивающимися фазами - неподвижной и подвижной. Это динамический метод, обеспечивающий многократность актов сорбции-десорбции компонентов, разделяемых в потоке подвижной фазы. Этим обусловлена большая эффективность этого метода по сравнению с методами сорбции и экстракции в статических условиях.
По способу получения хроматоргамм различают фронтальный, элюентный и вытеснительный способ.
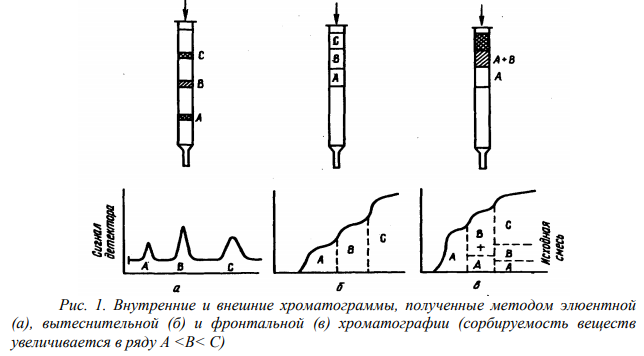
Элюентная (проявительная) хроматография. Метод разделения, анализа и физико-химического исследования веществ, в котором через слой сорбента непрерывно проходит поток элюента и периодически в слой сорбента вводится разделяемая смесь веществ. Через определенное время происходит деление исходной смеси на чистые вещества, располагающиеся отдельными зонами на сорбенте, между которыми находятся зоны элюента. Этот метод – наиболее распространенный, особенно часто применяется в газовой и в газо-жидкостной хроматографии.
Вытеснительная хроматография. метод разделения, анализа и физико-химического исследования веществ, при котором в сорбент вводится разделяемая смесь, а затем поток газа-носителя, содержащего вытеснитель (элюент), при движении которого смесь через некоторый период времени разделится на зоны чистых веществ, между которыми окажутся зоны их смеси. В ходе вытеснительного анализа образуются отдельные примыкающие друг к другу зоны компонентов, которые располагаются в порядке увеличения их сорбируемости.
Фронтальная хроматография. метод разделения, анализа и физико-химического исследования веществ, в котором анализируемая смесь непрерывно протекает через слой сорбента.
Билет № 9
1. Сущность и общая характеристика ионообменной хроматографии.
Ионообменная хроматография – основана на разной способности разделяемых веществ к ионному обмену между подвижной фазой и твердым ионообменником.
В зависимости от знака заряда функциональных групп ионообменные смолы являются катионитами или анионитами. Катиониты содержат кислотные функциональные группы [-SO3-, -COO-, -PO3-, -N(CH2CO2-)], Противоионы, в данном случае катионы, в отличие от функциональных групп каркаса обладают подвижностью и могут переходить в раствор в обмен на эквивалентное количество ионов из раствора. Функциональными группами каркаса анионитов являются четвертичные -NR3+, третичные –NR2Н+ или первичные -NН3+ аммониевые, пиридиновые и другие основания, а в качестве подвижных противоионов выступают анионы.
Простейшая методика ионообменного разделения состоит в поглощении компонентов смеси ионитом и последовательном элюировании каждого компонента подходящим растворителем. Применение ионообменной хроматографии к анализу смеси лантаноидов с использованием в качестве элюентов растворов лактата, цитрата, ЭДТА привело к разработке технологической схемы промышленной переработки руд лантаноидов. Этот метод используется даже для разделения изотопов. Большое практическое значение имеет основанный на ионном обмене процесс деминерализации воды.
2. Пределы обнаружения в методах спектрального анализа.
Спектральный анализ – это физический метод определения состава вещества, основанный на изучении спектров испускания, поглощения, отражения и люминесценции.
Предел обнаружения или предел определения (при определении микроконцентраций) (минимальное определяемое количество вещества, которое вызывает сигнал.
Предел обнаружения спектрального анализа расположен в промежутке между 102 до 103нм 3∗1015− 3∗1014Гц.
Билет № 10
1. Сущность и общая характеристика газовой хроматографии.
Газовая хроматография может быть применена для разделения и определения смесей веществ, которые могут быть легко переведены в газообразное состояние при сравнительно невысоких температурах (обычно – не выше2500C). Среди вариантов ГХ газо-жидкостный распространен несколько больше, чем газо-твердофазный.
Основными узлами хроматографической установки являются дозатор (система для ввода пробы), хроматографическая колонка и детектор. Кроме того, в установке имеются устройства для подачи газа-носителя или растворителя, для преобразования импульса детектора в соответствующий сигнал.
Дозатор предназначен для точного количественного отбора пробы и введения ее в хроматографическую колонку. Одним из основных требований к дозатору является воспроизводимость размера пробы и постоянство условий ее введения в колонку. Кроме того, введение пробы не должно вызывать резкого изменения условий работы колонки и других узлов хроматографической установки, а внутренняя поверхность дозатора не должна обладать каталитической или адсорбционной активностью по отношению к пробе. Газообразные и жидкие пробы обычно вводят с помощью специальных шприцев. Твердые пробы вводятся после перевода их в раствор или с помощью игольного ушка испарением пробы в нагретом дозаторе.
Детекторы классифицируют по различным признакам.
• 1 ) по способу регистрации вещества:
• у ниверсальные - регистрирующие многие вещества; селективные - чувствительные к химическим соединениям определённых классов;
• специфические - обладающие очень высокой селективностью.
• 2) по способу записи хроматограмм детекторы делятся на:
• интегральные (такие детекторы регистрируют суммарное количество компонента, вышедшего из колонки за определенный промежуток времени);
• дифференциальные (мгновенно регистрируют изменение какого-либо свойства, связанного с появлением вещества в подвижной фазе (ПФ).
2. Хранение и консервирование проб.
Правила хранения:
· Полное заполнение сосудов для проб, чтобы над пробой не оставалось воздуха. Это уменьшает взбалтывание во время транспортировки, а следовательно не изменяется содержание СО2, рН, гидрокарбонатов, Fe (II) и т.д.
· Полное заполнение сосудов для проб
· Применение максимально инертной посуды;
· Затемнение пробы;
· Удалить взвешенные вещества, осадок, водоросли и микроорганизмысразу же после отбора пробы методом фильтрации через бумажный или мембранный фильтр, или путем центрифугирования.
· Для отдельных видов проб применяется высушивание.
Правила консервации:
-Охлаждение пробы до температуры 3-4о С. При этом существенно замедляются все биохимические процессы (не долгосрочно).
-Используемые для консервации реагенты-стабилизаторы должны быть высочайшей чистоты.
-Материалы, из которых изготовлены сосуды, устройства и инструменты для пробоотбора должны быть устойчивы к действию образца и реагента.
-Время хранения законсервированных проб должно быть минимальным.
-Замораживание при -20о С (период хранения пробы до трех-четырех недель) Однако консервирование растворенных компонентов (таких, как ионы аммония, нитриты, нитраты, фосфаты) следует проводить только в профильтрованных пробах, т.к. вследствие автолиза планктонных организмов во время замораживания и размораживания могут произойти значительные нарушения в содержании компонентов.
Основной целью консервирования проб является сохранение компонентов, определяемых в воде, и ее свойств в том состоянии, в котором они находились в момент взятия пробы.
Билет № 11
1. Методы оптической спектрометрии: атомно-эмиссионный, атомноабсорбционный, атомно-флуоресцентный.
Атомноабсорбционный метод широко используется для измерений концентрации тяжелых металлов в окружающей среде и промышленных выбросах на производстве. Основной принцип метода – поглощение излучения пробы при предварительной атомизации. Поглощɺнная величина излучения измеряется в соответствии с законом БугераЛамберта-Бера: D = lg * (I0 / I) = klC, где D – оптическая плотность атомного пара пробы, k – коэффициент поглощения, 34 l – толщина поглощаемого слоя, C – концентрация определяемого элемента. Метод атомнофлуоресцентый основывался на наблюдении спектров флуоресценции атомов определяемых элементов. Флуоресценция – кратковременная люминесценция, затухающая сразу после прекращения возбуждения. Люминесценция – свечение вещества после поглощения им энергии возбуждения. Принцип действия. Нейтральные атомы анализируемого элемента в газовой фазе возбуждаются в ячейке атомизации внешним источником света, как и в атомной абсорбции, измеряется доля энергии, испускаемая возбуждɺнными атомами, претерпевающими переход в основное состояние путɺм излучения, как в атомной эмиссии
Атомно эмиссионные методы – используют спектры излучения атомов, основанный на регистрации атомных спектров с помощью специального прибора – спектрографа. Пробу изучаемого вещества вводят в источник излучения, где происходит ее испарение, молекулы диссоциируются и происходит возбуждение образовавшихся атомов. Последние испускают излучение, которое поступает в регистрирующее устройство спектрального прибора. При качественном атомном эмиссионном спектральном анализе спектры проб сравнивают со спектрами уже известных элементов, и потом устанавливают элементарный состав анализируемого вещества. При количественном анализе определяют количество данного элемента в исходном веществе. Точность и чувствительность атомного эмиссионного спектрального анализа зависят от температуры, концентрации электронов, времени пребывания атомов в зоне возбуждения. Минус метода – вещество, подвергающееся исследованию, уничтожается.
2. Применение хроматографии для определения и разделения неорганических и органических веществ.
Хроматография - физико-хим. метод разделения, обнаружения и определения смесей веществ, основанный на распределении компонентов между двумя несмешивающимися фазами - неподвижной и подвижной.
Хроматографические методы широко применяются в различных отраслях промышленности и научных исследованиях для анализа смесей газообразных, жидких и твердых веществ, для препаративного выделения соединений и изучения физико-химических свойств газов и растворов. На предприятиях органического синтеза контроль качества сырья и продуктов производства осуществляется преимущественно с использованием хроматографических методов анализа. Около 30% анализов по контролю состояния окружающей среды выполняется газохроматографическими методами.
Преимущества хроматографии перед другими методами разделения состоят в высокой разделяющей способности и возможности разделения небольших количеств веществ.
Билет № 12
1. Спектроскопические методы анализа. Общая характеристика метода. Классификация.
Спектральный анализ – это физический метод определения состава вещества, основанный на изучении спектров испускания, поглощения, отражения и люминесценции. Атомы каждого элемента испускают излучение определенных длин волн, это в свою очередь, позволяет определить, какие элементы входят в состав данного вещества. Все спектроскопические методы основаны на взаимодействии атомов, молекул или ионов, входящих в состав анализируемого вещества, с электромагнитным излучением. Это взаимодействие проявляется в поглощении или испускании фотонов (квантов). В зависимости от того, какие частицы формируют аналитический сигнал, различают методы атомной и молекулярной спектроскопии (атомные спектры - линейчатые, в то время как молекулярные состоят из широких полос поглощения или испускания).
Классификация:
-В эмиссионных методах анализируемая проба в результате ее возбуждения излучает фотоны (кванты).
-В абсорбционных методах излучение постороннего источника пропускают через пробу, при этом часть квантов избирательно поглощается атомами или молекулами.
-Комбинационные методы – используют спектры комбинационного рассеяния жидких, твердых и газообразных проб.
-Люминесцентные методы – используют спектры люминесценции вещества, возбуждаемые УФ и ИК излучениями.
-Рентгеновские методы – используют рентгеновские спектры атомов, получающиеся при переходах внутренних электронов.
-Радиоспектроскопические методы – использующие спектры поглощения молекул на участке спектра с длинами волн больше 1мм.
2. Пределы обнаружения в методах рентгеноспектрального анализа.
Рентгеноспектральный анализ — инструментальный метод элементного анализа, основанный на изучении спектра рентгеновских лучей, прошедших сквозь образец или испущенных им. Картинка внизу

Билет № 1
1) Физико-химические методы анализа. Классификация методов. Основаны на использовании зависимости физических свойств веществ (например, светопоглощения, электрической проводимости и т.д.) от их химического состава. По сравнению с классическими химическими методами ФХМА отличаются меньшим пределом обнаружения, временем и трудоёмкостью. ФХМА позволяют проводить анализ на расстоянии, автоматизировать процесс анализа и выполнять его без разрушения образца (недеструктивный анализ).
Ф-Х методы делятся на:
1. Оптические (молекулярная спектроскопия): колориметрия,фотоколориметрия, спектрофотометрия, турбидиметрия, нефелометрия, хемилюминесцентный метод. К оптическим методам анализа относится совокупность методов качественного и количественного анализов по
интенсивности инфракрасного (ИК), видимого и ультрафиолетового (УФ) излучения.
2. Элекрохимические: фтамперометрия (полярография, в/а на твёрдых электродах, дифференциальная в/а, инверсионная в/а), амперометрия, потенциометрия, кулонометрия, кондуктометрия. Электрохимические методы анализа (ЭХМА) основаны на изучении зависимости электрических параметров химической системы от концентрации, природы и структуры ее компонентов.
3. Кинетические (каталитические методы). Предел обнаружения до 10-11 мг/л. Это методы определения концентраций веществ, основанные на измерении скорости реакции. В кинетических методах анализа измеряемым свойством системы, на основании которого судят о концентрации вещества, является скорость химической реакции.
Сущность фотометрического анализа. Фотоколориметрические методы. Сущность колориметрического анализа. Закон Бугера-Ламберта-Бера. Оптическая плотность раствора.
Фотометрический анализ – один из видов молекулярного абсорбционного анализа (анализа поглощения электромагнитного излучения молекулами и сложными ионами анализируемого вещества в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра).
Спектрофотометрия- Метод основан на поглощении монохроматического излучения, т. е. излучения с одной длиной волны в видимой и УФ областях спектра. Не ниже 0,00005%
Фотоколориметрия- Метод основан на поглощении полихроматического излучения, т. е. пучка лучей с близкими длинами волны в видимой области спектра. Не ниже 0,0001%
Оба метода основаны на общем принципе — пропорциональной зависимости между светопоглощением и концентрацией определяемых веществ.
Применяя фотометрический анализ, можно определять малые количества вещества, например, содержание примесей спектрофотометрическом (физико-хим.метод) анализе измеряют поглощение монохроматических лучей узкого диапазона длин волн, что позволяет проводить измерения при той длине волны, при которой оптическая плотность раствора максимальна (в максимумах на кривых светопоглощения) – важно при опред.малыхконц.
Достоинстава: высокая чувствительность и точность опред., большое колич. компонентов можно определять.
Анализ: сравнивают оптическую плотность анализируемого раствора с опт.плотностью раствора, конц.которого неизвестна. Сравнение проводят с помощью спектрофотометров. Определяют по градуир.графику: измеряют оптич. плотность станд. р-ров и строят график зав-ти от конц.растворённого в-ва.
Фотоэлектроколориметрия– физико-хим.метод, основанный на измерении оптической плотности окрашенных растворов. Окраска раствора зависит от концентрации в нем растворенного вещества: чем выше концентрация, тем интенсивнее окраска и тем больше света поглощает раствор. Сущность: световой поток, проходя через окрашенную жидкость, частично поглощается. Остальная часть светового потока попадает на фотоэлемент, в котором возникает электр.ток, регистрирующийся при помощи амперметра. Чем больше конц.р-ра, тем больше его оптическая плотность и тем больше степень погл.света. При прохождении излучения через раствор светопоглощающего вещества поток излучения ослабляется. Понижение интенсивности зависит от концентрации поглощающего вещества и длины пути, проходимого потоком. Эта зависимость выражается законом Бугера – Ламберта – Бера.
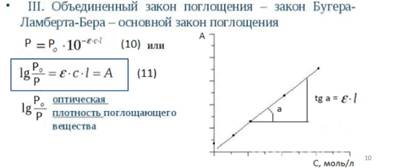
, где где e – молярный коэффициент поглощения, l – толщина поглощающего слоя, см; С – концентрация раствора, моль/л.; А –оптическая плотност
Билет № 2









