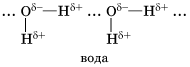Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке, называют металлической.
Такая связь характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов. Схема образования металлической связи (М – металл):

Любой металл способен отдавать электроны, превращаясь в положительно заряженный ион.
На примере железа: Fe0 -2e— = Fe2+
Куда направляются отделившиеся отрицательно заряженные частицы — электроны? Минус всегда притягивается к плюсу. Электроны притягиваются к другому иону (положительно заряженному) железа в кристаллической решетке: Fe2+ +2e— = Fe0
Ион становится нейтральным атомом. И такой процесс повторяется много раз. Получается, что свободные электроны железа находятся в постоянном движении по всему объему кристалла, отрываясь и присоединяясь к ионам в узлах решетки. Другое название этого явления — делокализованное электронное облако. Термин «делокализованный» обозначает — свободный, не привязанный.
Металлическая химическая связь — связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск.
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже Сl и S) другой молекулы (или ее части), называют водородной. Пример межмолекулярной водородной связи:
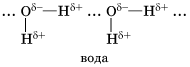
И хотя водородная связь более слабее, чем ковалентная, именно она обуславливает целых ряд аномальных свойств Н2О (воды).
Существует два типа водородной связи:
1. Водородная межмолекулярная связь – появляется между двумя молекулами, например: метанол, аммиак, фтороводород
2. Водородная связь внутримолекулярная – появляется внутри одной молекулы, например:
2-нитрофенол.
Также в настоящее время есть мнение, что водородная химическая связь бывает слабой и сильной. Они отличаются друг от друга по энергии и длине связи (расстояние между атомами):
1. Водородные связи слабые. Энергия – 10-30 кДж/моль, длина связи – 30. Все вещества, перечисленные выше, являются примерами нормальной или слабой водородной связи.
2. Водородные связи сильные. Энергия – 400 кДж/моль, длина – 23-24. Данные, полученные экспериментальным путем, свидетельствуют о том, что сильные связи образуются в следующих ионах: ион-водороддифторид [F-H-F]-, ион-гидратированный гидроксид [HO-H-OH]-, ион оксония гидратированный [H2O-H-OH2]+, а также в различных других органических и неорганических соединениях.
Единая природа химической связи. Деление химических связей на типы носит условный характер, так как все они характеризуются определенным единством. Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
Агрегатные состояния веществ. Переход вещества из одногоагрегатного состояния в другое.
Любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой. В обычной жизни мы наблюдаем три агрегатных состояния вещества — твердое, жидкое и газообразное.В зависимости от температуры и давления (условий) большинство веществ может находиться в газообразном, жидком или твердом состояниях, называемых агрегатными состояниями вещества. Различие между тремя агрегатными состояниями определяется расстоянием между молекулами и степенью их взаимодействия.
| Агрегатное состояние вещества
| Свойства вещества
| Расстояние между частицами
| Взаимодействие частиц
| Характер движения
| Порядок расположения
|
| Газ
| Не сохраняет форму и объем
| Гораздо больше размеров самих частиц
| Слабое
| Хаотическое (беспорядочное) непрерывное. Свободно летают, иногда сталкиваясь.
| Беспорядочное
|
| Жидкость
| Не сохраняет форму, сохраняет объем
| Сравнимо с размерами самих частиц
| Сильное
| Колеблются около положения равновесия, постоянно перескакивая с одного места на другое.
| <p >Беспорядочное
|
| Твердое тело
| <p >Сохраняет форму и объем
| Мало по сравнению с размерами самих частиц
| Очень сильное
| Непрерывно колеблются около положения равновесия
| В определенном порядке
|
Процессов, в которых происходит изменение агрегатных состояний веществ, всего шесть. Переход вещества из твердого состояния в жидкое называется плавлением, обратный процесс – кристаллизацией. Когда вещество переходит из жидкости в газ, это называется парообразованием, из газа в жидкость – конденсацией. Переход из твердого состояния сразу в газ, минуя жидкое, называют сублимацией, обратный процесс – десублимацией.
· 1. Плавление
· 2. Кристаллизация
· 3. Парообразование
· 4. Конденсация
· 5. Сублимация
· 6. Десублимация
Чистое вещество имеет определенный постоянный состав или структуру (соль, сахар).
В жизни редко встречаются чистые вещества, чаще - смеси веществ. Воздух – это смесь азота, кислорода и других газов, морская вода – смесь воды и растворенных солей.
Смеси - это физические сочетания чистых веществ, не имеющие определенного или чистого состава.
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара). Как видим, смесь под названием "чай" всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.