2.248. Вывести формулу, определяющую долю ω молекул, энергия ε которых много меньше kT. Функцию распределения молекул по энергиям считать известной.
2.249. Определить долю ω молекул, энергия которых находится в пределах от ε1 = 0 до ε2 = 0,01 kT.
2.250. Известно, что число молекул, энергия которых заключена в пределах от нуля до некоторого значения ε, составляет 0,5 % от общего числа молекул. Определить величину ε в долях kT.
2.251. Пологая, что функция распределения молекул по энергиям известна, вывести формулу, определяющую долю ω молекул, энергия ε которых много больше энергии теплового движения молекул.
2.252. Используя функцию распределения молекул по энергиям, определить наиболее вероятное значение энергии εв.
2.253. Найти относительное число ω молекул идеального газа, кинетические энергии которых отличаются от наиболее вероятного значения εв энергии не более чем на 5 %.
2.254. Во сколько раз изменится значение максимума функции f (ε) распределения молекул идеального газа по энергиям, если температура Т газа увеличится в 2 раза?
2.255. Определить, во сколько раз средняя кинетическая энергия  поступательного движения молекул идеального газа отличается от наиболее вероятного значения εв кинетической энергии поступательного движения при той же температуре.
поступательного движения молекул идеального газа отличается от наиболее вероятного значения εв кинетической энергии поступательного движения при той же температуре.
РАЗДЕЛ 2
ФИЗИЧЕСКИЕ ОСНОВЫ ТЕРМОДИНАМИКИ
Основные законы и формулы
Связь между молярной (С) и удельной (с) теплоемкостями газа:
 ,
,
где  – молярная масса газа.
– молярная масса газа.
Молярные теплоемкости при постоянном объеме (С V) и постоянном давлении (Ср) соответственно равны:
 ,
,
где i – число степеней свободы; R – универсальная газовая постоянная.
Удельные теплоемкости при постоянном объеме (с V) и постоянном давлении (ср) соответственно равны:
 .
.
Уравнение Майера: 
Показатель адиабаты:
 .
.
Внутренняя энергия идеального газа:

где  – средняя кинетическая энергия молекулы; N –число молекулгаза;
– средняя кинетическая энергия молекулы; N –число молекулгаза;  – количество молей вещества.
– количество молей вещества.
Работа, совершаемая газом при изменении его объема, в общем случае вычисляется по формуле:
 ,
,
где V 1 – начальный объем газа; V 2 – конечный объем газа.
Работа, совершаемая газом при изобарном процессе  :
:
 ,
,
где V 1 – начальный объем газа; V 2 – конечный объемы газа.
Работа, совершаемая газом при изотермическом процессе  :
:

Работа, совершаемая газом при адиабатном процессе (Q = 0):

где Т 1 – начальная температура газа; Т 2 – конечная температура газа.
Уравнение адиабаты (уравнение Пуассона):

Связь между начальным и конечным значениями параметров состояний газа при адиабатном процессе:
 .
.
Первое начало (закон) термодинамики:
а) для бесконечно малого изменения состояния системы (элементарного квазистатического процесса):
 ,
,
где  – бесконечно малое (элементарное) количество теплоты, подводимое к системе;
– бесконечно малое (элементарное) количество теплоты, подводимое к системе;  – бесконечно малое изменение внутренней энергии системы;
– бесконечно малое изменение внутренней энергии системы;  – бесконечно малая (элементарная) работа, совершаемая системой против внешних сил;
– бесконечно малая (элементарная) работа, совершаемая системой против внешних сил;
б) для конечного изменения состояния системы:

Количество теплоты Q, подводимое к системе, изменение  – внутренней энергии газа и работа A, совершаемая газом против внешних сил при изопроцессах:
– внутренней энергии газа и работа A, совершаемая газом против внешних сил при изопроцессах:
а) изохорном  :
:



б) изобарном  :
:



в) изотермическом  :
:

г) адиабатном (энтропия S = const при обратном процессе):

или

Термический коэффициент полезного действия (КПД) цикла в общем случае:

где  – количество теплоты, полученное от нагревателя рабочим телом;
– количество теплоты, полученное от нагревателя рабочим телом;  – количество теплоты, отданное холодильнику; А – работа, совершенная рабочим телом.
– количество теплоты, отданное холодильнику; А – работа, совершенная рабочим телом.
Термический КПД цикла Карно:

где  – температура нагревателя;
– температура нагревателя;  – температура холодильника.
– температура холодильника.
Изменение энтропии:
а) при обратимых процессах:

б) при необратимых процессах:


где  и
и  – энтропии начального и конечного состояний системы;
– энтропии начального и конечного состояний системы;
в) при фазовом переходе «твердое тело – жидкость»:

где знак «+» относится к плавлению, а знак «–» к отвердеванию,  – удельная теплота плавления;
– удельная теплота плавления;
г) при фазовом переходе «жидкость – газ»:

где знак «+» относится к испарению, а знак «–» к конденсации,  – удельная теплота парообразования;
– удельная теплота парообразования;
д) при изотермическом процессе  :
:

где при  расширение, энтропия растет, при
расширение, энтропия растет, при  сжатие, энтропия уменьшается;
сжатие, энтропия уменьшается;
е) при изобарном процессе  :
:

ж) при изохорном  :
:

з) при адиабатном процессе:  .
.
Формула Больцмана:
 ,
,
где 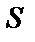 – энтропия системы;
– энтропия системы;  – статистический вес или термодинамическая вероятность состояния системы;
– статистический вес или термодинамическая вероятность состояния системы;  – постоянная Больцмана.
– постоянная Больцмана.
Примеры решения задач
Пример 1. Найти удельные теплоемкости ср и с v смеси газов кислорода и аргона, если массовые доли газов соответственно равны ω1 = 90 % и ω2 = 10 %.
| Дано:
ω1 = 90 %
М 1 = 32∙10–3 кг/моль
ω2 = 10 %
М 2 = 40∙10–3 кг/моль
| Решение:
Для определения удельной теплоемкости с v смеси при постоянном объеме найдем теплоту, необходимую для нагревания смеси газов на Δ Τ:
|
| Найти: ср и с v
| Q = с v ∙(m 1 + m 2)∙Δ Τ,
Q = (с v 1∙ m 1 + С v 2∙ m 2)∙Δ Τ,
|
где с v 1 – удельная теплоемкость кислорода, с v 2 – удельная емкость аргона.
Приравниваем равные части и делим на Δ Τ обе части равенства:
с v ∙(m 1 + m 2) = с v 1∙ m 1+ с v 2∙ m 2.
Откуда:

Или
с v = с v 1∙ω1 + с v 2∙ω2,
где  и
и 
Рассуждая аналогично, получаем формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
с p = с p 1∙ω1 + с p 2∙ω2.
Удельные теплоемкости идеальных газов выражаются по формулам:


где i 1 = 5 – число степеней свободы молекул кислорода, i 2 = 3 – число степеней свободы молекул аргона.
Получаем для удельных теплоемкостей смеси при постоянном объеме:
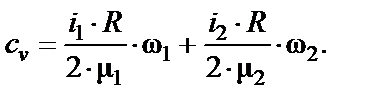
Производим вычисления:

Удельная теплоемкость смеси при постоянном давлении:

Производим вычисления:

Ответ: с v = 615,5  ; ср = 870
; ср = 870  .
.
Пример 2. Найти среднюю длину свободного пробега  молекул водорода при давлении Р = 105 Па и температуре t = 20 °C.
молекул водорода при давлении Р = 105 Па и температуре t = 20 °C.
Дано:
μ = 2·10–3  Р = 105 Па
t = 20 °C; Т = 293 К
Р = 105 Па
t = 20 °C; Т = 293 К
| Решение:
Длина свободного пробега молекул газа находится по формуле:

где d = 2,3·10–10 м – эффективное значение диаметра молекулы водорода;
n – концентрация молекул газа, находится из формулы p = n ∙ k ∙ T, получаем:
 , ,
где k – постоянная Больцмана.
|
Найти  =? =?
|
Подставляем значение концентрации n в формулу длины свободного пробега, получаем:

Сделаем проверку размерности:

Подставляем числовые значения в конечную формулу:

Ответ: 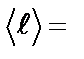 17 мм.
17 мм.
Пример 3. Водород занимает объем V = 20 м3 при давлении 0,2 МПа, его нагревают при постоянном объеме до давления 0,5 МПа. Определить изменение Δ U внутренней энергии газа; работу А, совершенную им, и количество теплоты Q, переданной газу.
Дано:
μ = 2·10–3  V = 20 м3 = const
P 1 = 0,2 МПа = 0,2·106 Па
P 1 = 0,5 МПа = 0,5·106 Па
V = 20 м3 = const
P 1 = 0,2 МПа = 0,2·106 Па
P 1 = 0,5 МПа = 0,5·106 Па
| Решение:
Изменение внутренней энергии газа:
 где i = 5 – число степеней свободы молекулы водорода.
Разность температур Δ Т находим из уравнения Менделеева–Клапейрона
где i = 5 – число степеней свободы молекулы водорода.
Разность температур Δ Т находим из уравнения Менделеева–Клапейрона
|
| Найти:
Δ U =?; А =?; Q =?
| 
|
Запишем его для двух температур Т 1 и Т 2:
 и
и 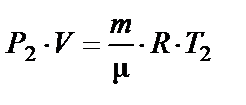 .
.
Откуда:

Получаем:

Полученное значение подставляем в формулу изменения внутренней энергии газа:

Производим вычисления:

Работа газа при V = const равна нулю.
Из первого начала термодинамики следует, что количество теплоты Q идет полностью на увеличение внутренней энергии газа.
Q = Δ U + A или Q = Δ U.
Ответ: Δ U = Q = 15 МДж; А = 0.
Пример 4. В бензиновом автомобильном двигателе степень сжатия горючей смеси равна 8,2. Смесь засасывается в цилиндр при t 1 = 30 °C. Найти температуру горючей смеси в конце такта сжатия. Горючую смесь рассматривать как двухатомный идеальный газ. Процесс считать адиабатным.
Дано:
 t 1 = 30 °C; Т 1 = 303 К
i = 5
t 1 = 30 °C; Т 1 = 303 К
i = 5
| Решение:
Уравнение адиабаты для идеального газа:
 Откуда:
Откуда:
|
| Найти:
Т 2 =?
| 
|
где  – показатель адиабаты.
– показатель адиабаты.
Для двухатомного газа i = 5, тогда:

Произведем необходимые вычисления:

Ответ: Т 2 = 703 К.
Пример 5. Работа изотермического расширения газа массой 50 г от объема V 1 до V 2 = 2 V 1, равна 2875 Дж. Найти среднюю квадратичную скорость молекул газа при этой температуре.
| Дано:
m = 50 г = 0,05 кг
V 1
V 2 = 2 V 1
A = 2875 Дж
| Решение:
Элементарная работа по расширению газа δ A = P d V, тогда полная работа:

|

|
Давление газа Р находим из уравнения Менделеева–Клапейрона:
|

Получаем:

Подставляем значение давления в формулу работы:

Из последнего выражения находим температуру:

Средняя квадратичная скорость равна:

Подставляем в формулу средней квадратичной скорости значение температуры:

Производим необходимые вычисления:

Ответ:  .
.
Пример 6. Найти изменение энтропии 8 г кислорода, занимающего объем 20 л при температуре 300 К, если давление увеличить в 3 раза при постоянной температуре, а затем повысить температуру до 350 К.
Дано:
μ = 32·10–3  m = 8 г = 8·10–3 кг
V 1 = 20 л = 0,02 м3
Т 1 = 300 К
Т 2 = 350 К
Р 2 = 3 Р 1
m = 8 г = 8·10–3 кг
V 1 = 20 л = 0,02 м3
Т 1 = 300 К
Т 2 = 350 К
Р 2 = 3 Р 1
| Решение:
Формула изменения энтропии:
 где d Q – изменение количества теплоты; Т – термодинамическая температура.
Изменение количества теплоты находим из первого закона термодинамики:
где d Q – изменение количества теплоты; Т – термодинамическая температура.
Изменение количества теплоты находим из первого закона термодинамики:
|
| Найти: Δ S =?
| d Q = d U + P d V,
|
где 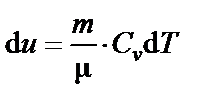 – изменение внутренней энергии.
– изменение внутренней энергии.

Величину давления P найдем из уравнения Менделеева–Клапейрона:
 ,
,
получаем:

Для двухатомного газа i = 5.
Получаем для молярной теплоемкости при постоянном объеме:

Подставляя эти уравнения в формулу первого начала термодинамики, получаем:

Находим изменение энтропии:

Из уравнения для изотермического процесса P 1· V 1 = P 2· V 2, находим:

Тогда для изменения энтропии Δ S получаем:
 .
.
Делаем подстановку и производим вычисления:

Ответ: Δ S = –1,48 
Пример 7. Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика Т 1 = 500 К. Определить термический к.п.д. цикла  и температуру Т 2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу
и температуру Т 2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу  .
.
Дано:
Цикл Карно

| Решение:
Термический к.п.д. тепловой машины показывает, какая доля теплоты, полученной от теплоотдатчика, превращается в механическую работу. Термический к.п.д. выражается формулой:
 , ,
где А – работа, совершенная рабочим телом рабочей машины.
|
|
|

|
Зная к.п.д. цикла, можно по формуле

определить температуру охладителя  :
:

Произведением вычисления:
 = 350/1000 = 0,35;
= 350/1000 = 0,35;
 = 500 (1 – 0,35) К = 325 К.
= 500 (1 – 0,35) К = 325 К.
Ответ: 35 %, 325 К.
Задачи
2.256. Вычислить удельные теплоемкости аргона и неона при постоянных объеме с v и давлении с P, считая эти газы идеальными.
2.257. Вычислить удельную теплоемкость с v , см смеси двух газов гелия массой 4 г и водорода массой 2 г при постоянном объеме.
2.258. Разность удельных теплоемкостей с p – cv некоторого двухатомного газа равна 260 Дж/(кг∙К). Найти молярную массу М газа и его удельные теплоемкости с p и с v.
2.259. Определить удельную теплоемкость с v смеси газов, содержащей V 1 = 10 л азота и V 2 = 2 л кислорода. Газы находятся при одинаковых условиях.
2.260. Определить удельную теплоемкость с p смеси азота и аргона, если количество вещества ν1 азота равно 2 моль, а количество вещества аргона равно 4 моль.
2.261. Смесь газов состоит из азота и криптона, взятых при одинаковых условиях и в равных объемах. Определить удельную теплоемкость с p смеси при постоянном давлении.
2.262. Удельная теплоемкость при постоянном давлении некоторого газа 970 Дж/(кг·К), молярная масса его равна μ = 0,03 кг/моль. Определить, сколько степеней свободы имеют молекулы этого газа.
2.263. Плотность некоторого газа при нормальных условиях ρ = 1,25 кг/м3. Отношение удельных теплоемкостей 1,4. Определить удельные теплоемкости с p и с v этого газа.
2.264. Определить показатель адиабаты γ для смеси газов, состоящей из азота массой 8 г, углекислого газа массой 22 г и гелия массой 2 г.
2.265. Смесь газов состоит из аргона и кислорода, взятых при одинаковых условиях и в одинаковых объемах. Определить показатель адиабаты γ газовой смеси.
2.266. Отношение удельных теплоемкостей смеси, состоящей из нескольких молей водорода и 6 молей аммиака, равно 1,36. Определить число молей водорода в смеси.
2.267. Найти показательадиабаты γ смеси газов, содержащей азот и криптон, если количества вещества того и другого газа в смеси одинаковы.
2.268. Степень диссоциации газообразного азота α = 0,7. Найти удельную теплоемкость с v такого частично диссоциировавшего азота.
2.269. Определить удельные теплоемкости с p и с v смеси, состоящей из кислорода в количестве ν1 = 2 моль, аммиака – ν2 = 4 моль и аргона массой 10 г.
2.270. Определить степень диссоциации α газообразного хлора, если показатель адиабаты γ такого частично диссоциировавшего газа равен 1,52.



 поступательного движения молекул идеального газа отличается от наиболее вероятного значения εв кинетической энергии поступательного движения при той же температуре.
поступательного движения молекул идеального газа отличается от наиболее вероятного значения εв кинетической энергии поступательного движения при той же температуре. ,
, – молярная масса газа.
– молярная масса газа. ,
, .
.
 .
.
 – средняя кинетическая энергия молекулы; N –число молекулгаза;
– средняя кинетическая энергия молекулы; N –число молекулгаза;  – количество молей вещества.
– количество молей вещества. ,
, :
: ,
, :
:


 .
. ,
, – бесконечно малое (элементарное) количество теплоты, подводимое к системе;
– бесконечно малое (элементарное) количество теплоты, подводимое к системе;  – бесконечно малое изменение внутренней энергии системы;
– бесконечно малое изменение внутренней энергии системы;  – бесконечно малая (элементарная) работа, совершаемая системой против внешних сил;
– бесконечно малая (элементарная) работа, совершаемая системой против внешних сил;
 – внутренней энергии газа и работа A, совершаемая газом против внешних сил при изопроцессах:
– внутренней энергии газа и работа A, совершаемая газом против внешних сил при изопроцессах: :
:








 – количество теплоты, полученное от нагревателя рабочим телом;
– количество теплоты, полученное от нагревателя рабочим телом;  – количество теплоты, отданное холодильнику; А – работа, совершенная рабочим телом.
– количество теплоты, отданное холодильнику; А – работа, совершенная рабочим телом.
 – температура нагревателя;
– температура нагревателя;  – температура холодильника.
– температура холодильника.


 и
и  – энтропии начального и конечного состояний системы;
– энтропии начального и конечного состояний системы;
 – удельная теплота плавления;
– удельная теплота плавления;
 – удельная теплота парообразования;
– удельная теплота парообразования;
 расширение, энтропия растет, при
расширение, энтропия растет, при  сжатие, энтропия уменьшается;
сжатие, энтропия уменьшается; :
:
 :
:
 .
. ,
,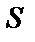 – энтропия системы;
– энтропия системы;  – статистический вес или термодинамическая вероятность состояния системы;
– статистический вес или термодинамическая вероятность состояния системы;  – постоянная Больцмана.
– постоянная Больцмана.
 и
и 


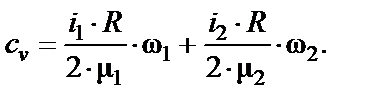



 ; ср = 870
; ср = 870  .
. молекул водорода при давлении Р = 105 Па и температуре t = 20 °C.
молекул водорода при давлении Р = 105 Па и температуре t = 20 °C. Р = 105 Па
t = 20 °C; Т = 293 К
Р = 105 Па
t = 20 °C; Т = 293 К

 ,
, =?
=?



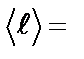 17 мм.
17 мм. V = 20 м3 = const
P 1 = 0,2 МПа = 0,2·106 Па
P 1 = 0,5 МПа = 0,5·106 Па
V = 20 м3 = const
P 1 = 0,2 МПа = 0,2·106 Па
P 1 = 0,5 МПа = 0,5·106 Па
 где i = 5 – число степеней свободы молекулы водорода.
Разность температур Δ Т находим из уравнения Менделеева–Клапейрона
где i = 5 – число степеней свободы молекулы водорода.
Разность температур Δ Т находим из уравнения Менделеева–Клапейрона

 и
и 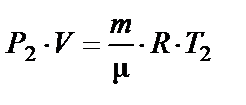 .
.



 t 1 = 30 °C; Т 1 = 303 К
i = 5
t 1 = 30 °C; Т 1 = 303 К
i = 5
 Откуда:
Откуда:

 – показатель адиабаты.
– показатель адиабаты.










 .
. m = 8 г = 8·10–3 кг
V 1 = 20 л = 0,02 м3
Т 1 = 300 К
Т 2 = 350 К
Р 2 = 3 Р 1
m = 8 г = 8·10–3 кг
V 1 = 20 л = 0,02 м3
Т 1 = 300 К
Т 2 = 350 К
Р 2 = 3 Р 1
 где d Q – изменение количества теплоты; Т – термодинамическая температура.
Изменение количества теплоты находим из первого закона термодинамики:
где d Q – изменение количества теплоты; Т – термодинамическая температура.
Изменение количества теплоты находим из первого закона термодинамики:
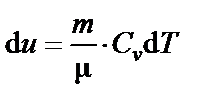 – изменение внутренней энергии.
– изменение внутренней энергии.
 ,
,




 .
.

 и температуру Т 2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу
и температуру Т 2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу  .
.
 ,
,

 :
:
 = 350/1000 = 0,35;
= 350/1000 = 0,35; = 500 (1 – 0,35) К = 325 К.
= 500 (1 – 0,35) К = 325 К.

