Число молекул, скорости которых заключены в пределах от  до
до 

где  – общее число молекул;
– общее число молекул;  – масса молекулы.
– масса молекулы.
Число молекул, относительные скорости которых заключены в пределах от  до
до  :
:
 ,
,
где  – относительная скорость, равная отношению скорости
– относительная скорость, равная отношению скорости  к наивероятнейшей скорости
к наивероятнейшей скорости  ;
;  – функция распределения по относительным скоростям.
– функция распределения по относительным скоростям.
Распределение молекул по импульсам
Число молекул, импульсы которых заключены в пределах от p до  :
:
 ,
,
где  – функция распределения по импульсам.
– функция распределения по импульсам.
Распределение молекул по кинетическим энергиям поступательного движения
Число молекул, энергии которых заключены в интервале от 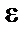 до
до  :
:
 ,
,
где  – функция распределения по кинетическим энергиям.
– функция распределения по кинетическим энергиям.
Эффективное сечение молекулы:
 ,
,
где d – эффективный диаметр молекулы.
Среднее число соударений, испытываемых одной молекулой газа в единицу времени:

где  – эффективный диаметр молекулы;
– эффективный диаметр молекулы;  – концентрация молекул;
– концентрация молекул;  – средняя арифметическая скорость молекул.
– средняя арифметическая скорость молекул.
Средняя длина свободного пробега молекул газа:

Средняя длина свободного пробега молекул для идеального газа, состоящего из молекул массами m 1 и m 2, радиусами r 1 и r 2 с концентрациями n 1 и n 2:

где  = π
= π  ;
;  ;
;  , здесь
, здесь  – эффективные диаметр и радиус молекулы.
– эффективные диаметр и радиус молекулы.
Среднее время между двумя соседними соударениями молекул:
 ,
,
где  – средняя арифметическая скорость молекул.
– средняя арифметическая скорость молекул.
Импульс, переносимый молекулами из одного слоя газа в другой через элемент поверхности:

где  – динамическая вязкость газа;
– динамическая вязкость газа;  – градиент (поперечной) скорости течения его слоев;
– градиент (поперечной) скорости течения его слоев;  – площадь элемента поверхности;
– площадь элемента поверхности;  – время переноса.
– время переноса.
Основной закон вязкого трения (закон Ньютона):

где  – сила внутреннего трения между движущимися слоями жидкости.
– сила внутреннего трения между движущимися слоями жидкости.
Динамическая вязкость газа (жидкости):

где ρ – плотность газа (жидкости); ‹υ› – средняя скорость хаотического движения молекул; ‹ l › – средняя длина свободного пробега.
Кинематическая вязкость газа (жидкости):
 ,
,
где η – динамическая вязкость, ρ – плотность газа (жидкости).
Основной закон теплопроводности (закон Фурье):
 ,
,
где  – количество теплоты, прошедшее посредством теплопроводности через сечение площадью S за время
– количество теплоты, прошедшее посредством теплопроводности через сечение площадью S за время  ;
;  – теплопроводность;
– теплопроводность;  – градиент температуры.
– градиент температуры.
Теплопроводность (коэффициент теплопроводности) газа:

где  – удельная теплоемкость газа при постоянном объеме;
– удельная теплоемкость газа при постоянном объеме;  – плотность газа;
– плотность газа; 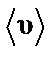 – средняя арифметическая скорость молекул;
– средняя арифметическая скорость молекул;  – средняя длина свободного пробега.
– средняя длина свободного пробега.
Закон диффузии (закон Фика):
 ,
,
где  – масса i -й компоненты газа, перенесенной в результате диффузии через поверхность площадью S, перпендикулярной оси
– масса i -й компоненты газа, перенесенной в результате диффузии через поверхность площадью S, перпендикулярной оси  , за время
, за время 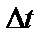 ;
;  – градиент парциальной плотности i -й компоненты.
– градиент парциальной плотности i -й компоненты.
Коэффициент диффузии:

Коэффициенты в явлениях переноса связаны между собой следующими соотношениями:

Примеры решения задач
Пример 1. Определить число молекул, содержащихся в 1 г углекислого газа, и найти объем, который занимает газ при нормальных условиях.
Дано:

| Решение:
Число N молекул углекислого газа равно
 ,
где ,
где  – количество вещества. – количество вещества.
|

| Получаем:

|
Произведем вычисления:
 .
.
Из уравнения  находим концентрацию молекул n:
находим концентрацию молекул n:

Концентрация молекул:

Тогда можно записать, что 
Откуда объем газа:

Сделаем проверку размерности:

Подставляем значения, получаем:

Ответ: 
Пример 2. Найти среднюю квадратичную скорость молекул воздуха при температуре 300 К. Молярная масса воздуха μ = 0,029 кг/моль.
Дано:
Газ-воздух

 
| Решение:
Средняя квадратичная скорость молекул определяется:
 . .
Произведем вычисления:

Сделаем проверку размерности:
|
|
|

|
| 
Ответ: 
|
Пример 3. В баллоне вместимостью 25 л находится смесь, содержащая 20 г водорода, 50 г водяного пара и 75 г двуокиси углерода, при температуре 27 °C. Определить давление смеси.
Дано:

| Решение:
Давление смеси газов определяется по закону Дальтона:
 где Р 1, Р 2, Р 3 – парциальные давления соответственно водорода, водяного пара и двуокиси углерода, которые находим из уравнения Менделеева–Клапейрона
где Р 1, Р 2, Р 3 – парциальные давления соответственно водорода, водяного пара и двуокиси углерода, которые находим из уравнения Менделеева–Клапейрона

|
| Р –?
| Тогда для каждого из газов получаем:

|
При подстановке этих выражений в закон Дальтона получаем:

Делаем проверку размерности:
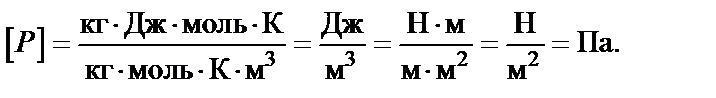
Производим вычисления:
 .
.
Ответ:  .
.
Пример 4. Найти среднюю длину свободного пробега молекул водорода при давлении  и температуре
и температуре  .
.
Дано:

| Решение:
Длина свободного пробега молекул газа находится по формуле:
 , ,
|

| где d – эффективное значение диаметра молекулы водорода, взяли из табл. 4; n – концентрация молекул газа, находится из формулы  . .
|
Получаем:

где  – постоянная Больцмана.
– постоянная Больцмана.
Подставляем значение концентрации n в формулу длины свободного пробега, получаем:

Сделаем проверку размерности:
 .
.
Подставляем числовые значения в конечную формулу:
 .
.
Ответ:  .
.
Пример 5. Сколько времени потребуется, чтобы накачать камеру автомобильной шины объемом V = 10 л до давления 0,2 МПа, если при каждом качании насос захватывает из атмосферы цилиндрический столб воздуха высотой 15 см и диаметром 6 см. Время одного качания t 1 = 1,5 с. Первоначальное давление в камере 0,1 МПа.
Дано:
Газ-воздух
Т = const

| Решение:
Общее время качания определяется:
 ,
где N – число качаний.
Запишем уравнение Менделеева–Клапейрона для начального состояния газа: ,
где N – число качаний.
Запишем уравнение Менделеева–Клапейрона для начального состояния газа:
 (1)
И по аналогии для конечного состояния: (1)
И по аналогии для конечного состояния:
 (2) (2)
|
 t =? t =?
| |
Вычтем из уравнения (2) уравнение (1):

где  , тогда:
, тогда:
 (3)
(3)

 – масса воздуха, закачанного в камеру
– масса воздуха, закачанного в камеру

 ,
,
где  – плотность воздуха, V 1 – объем захватываемого воздуха при одном качании
– плотность воздуха, V 1 – объем захватываемого воздуха при одном качании
 ,
,
где S – площадь поперечного сечения цилиндрического столба воздуха
 .
.
Тогда получаем:
 (4)
(4)
Приравниваем уравнения (3) и (4):
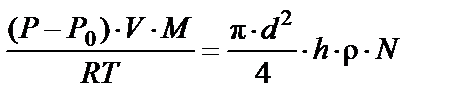 .
.
Тогда:
 .
.
Получаем:
 .
.
Произведем вычисления:

Сделаем проверку размерности:

Ответ: t = 9,07 ч.
Пример 6. Какова плотность воздуха в сосуде емкостью 2,5 л, если сосуд откачан до 10–3 мм рт. ст., а температура воздуха 17 °С? Как изменится плотность воздуха в сосуде, если добавить в него 5∙10–5 г воздуха? Какое давление установится в сосуде? Процесс считать изотермическим.
Дано:
Газ-воздух
Т = const

| Решение:
Запишем уравнение Менделеева–Клапейрона для начального состояния газа:

Из которого определим m 0:
 . .
Разделим выражение на объем V:
 . .
Получим:
 . .
|

|
И по аналогии запишем уравнение Менделеева–Клапейрона для конечного состояния газа:

где
 .
.
Произведем вычисления:

Ответ:  .
.
Задачи
Основы молекулярно-кинетической теории газов
2.1. Микроскопическая пылинка углерода обладает массой 0,2 нг. Определить, из скольких атомов она состоит.
2.2. Радоновые ванны, применяемые для лечения, содержат 1,8∙106 атомов радона в воде объемом 1 дм3. На сколько молекул воды приходится один атом радона в лечебной ванне?
2.3. Определить количество вещества и число молекул азота массой 0,5 кг.
2.4. Сколько атомов содержится в ртути: 1) количеством вещества 0,1 моль; 2) массой 2 г.
2.5. Найти молярную массу и массу одной молекулы поваренной соли.
2.6. Найти массу одной молекулы: 1) воды; 2) углекислого газа.
2.7. Сколько молекул содержится в 5 г сероводорода (H2S)?
2.8. Сколько атомов ртути содержится в воздухе объемом 1 м3 в помещении, зараженном ртутью, при температуре 20 °С, если давление насыщенного пара ртути при этой температуре 133 МПа?
2.9. Определить число атомов в 1 кг водорода и массу одного атома водорода.
2.10. Сколько частиц (атомов и молекул) находится в азоте массой 10 г, если степень диссоциации азота 20 %?
2.11. Определить концентрацию n молекул водорода, заполняющего сосуд объемом 3 л. Количество вещества кислорода равно 0,5 моль.
2.12. Определить количество вещества кислорода, заполняющего сосуд объемом 2 л, если концентрация молекул газа в сосуде 2∙1018 м–3.
2.13. В сосуде емкостью 10 л при нормальных условиях находится азот. Определить: 1) количество вещества; 2) массу азота; 3) концентрацию молекул в сосуде.
2.14. В сосуде вместимостью 1 л находится гелий массой 1 г. Определить концентрацию молекул гелия в сосуде.
2.15. Газ в колбе емкостью 250 см3, находящейся при температуре 17 °С, разряжен до давления133 мм. рт. ст. Определить, сколько молей и молекул содержится в колбе.
2.16. За сутки из сосуда испарилось 50 г воды. Сколько в среднем вылетало молекул из сосуда за 1 секунду?
2.17. Средняя квадратичная скорость некоторого газа при нормальных условиях равна 400 м/с. Сколько молекул содержит 1 г этого газа?
2.18. Определить давление газа в сосуде, если его плотность 0,012 кг/м3, а средняя квадратичная скорость молекул газа составляет 450 м/с.
2.19. Определить наиболее вероятную скорость молекул газа, плотность которого при давлении 50 кПа составляет 0,35 кг/м3.
2.20. При какой температуре средняя квадратичная скорость атомов водорода станет равной второй космической скорости 11,2 км/с.
2.21. При какой температуре молекулы азота имеют такую же среднюю квадратичную скорость, как молекулы водорода при температуре 200 К?
2.22. Колба вместимостью 0,5 л содержит углекислый газ СО2 массой 0,3 г под давлением 200 кПа. Определить среднюю квадратичную скорость молекул газа.
2.23. Найти среднюю квадратичную скорость молекул воздуха при температуре 300 К. Молярная масса воздуха 0,029 кг/моль.
2.24. Найти концентрацию молекул кислорода при давлении 500 Па, если средняя квадратичная скорость его молекул 2600 м/с.
2.25. Во сколько раз средняя квадратичная скорость пылинки, взвешенной в воздухе, меньше средней квадратичной скорости молекул кислорода при температуре 0 °С? Масса пылинки 10 нг.
2.26. Найти импульс молекулы азота при температуре 27 °С. Скорость молекулы считать равной средней квадратичной скорости.
2.27. Смесь аргона и криптона находится при температуре 450 °С. Определить среднюю квадратичную скорость и среднюю кинетическую энергию атомов аргона и криптона.
2.28. Найти среднюю арифметическую скорость молекул водорода, если их средняя квадратичная скорость равна 1500 м/с.
2.29. Определить наиболее вероятную скорость молекул водорода при температуре 300 К.
2.30. Найти наиболее вероятную, среднюю арифметическую и среднюю квадратичную скорости молекул гелия при 300 К.
2.31. Найти, при какой температуре средняя квадратичная скорость молекул водорода больше их наиболее вероятной скорости на 200 К.
2.32. Определить среднюю кинетическую энергию вращательного движения молекул кислорода, содержащихся в 2 молях при 290 К.
2.33. Найти среднюю кинетическую энергию молекул кислорода массой 8 г при температуре 27 °С. Какая часть этой энергии приходится на долю поступательного движения и какая на долю вращательного? Колебательные степени свободы молекул кислорода не учитывать.
2.34. В сосуде объемом 5 л находится газ под давлением 1,5 МПа. Чему равна средняя кинетическая энергия поступательного движения молекул газа?
2.35. Гелий в количестве 2,5 моля находится при температуре 150 К. Определить суммарную кинетическую энергию поступательного движения всех молекул газа.
2.36. Азот массой 14 г находится при температуре 800 °С, при этом 60 % молекул диссоциировано на атомы. Чему равна средняя кинетическая энергия теплового движения частиц? Колебательные степени свободы молекул азота не учитывать.
2.37. Метан находится при температуре 800 К. Найти среднюю кинетическую энергию его молекул, включая колебательную. Какая часть кинетической энергии молекул газа приходится на долю поступательного движения?
2.38. Определить среднее значение полной кинетической энергии одной молекулы водорода, гелия и углекислого газа. При температуре 300 К.
2.39. Давление газа равно 1 МПа, концентрация его молекул 105 см–3. Найти: 1) температуру газа; 2) среднюю кинетическую энергию поступательного движения молекул газа.
2.40. Определить среднюю кинетическую энергию поступательного движения и среднее значение полной кинетической энергии молекулы водяного пара при температуре 700 К. Найти кинетическую энергию поступательного движения всех молекул пара, содержащегося в 2 молях.
2.41. Найти среднее значение полной кинетической энергии одной молекулы гелия, водорода, водяного пара при температуре 10 °С.
2.42. Найти кинетическую энергию, приходящуюся в среднем на одну степень свободы молекулы углекислого газа, при температуре  , а также среднюю кинетическую энергию поступательного движения, вращательного движения и среднее значение полной кинетической энергии одной молекулы.
, а также среднюю кинетическую энергию поступательного движения, вращательного движения и среднее значение полной кинетической энергии одной молекулы.
2.43. Давление газа 0,1 МПа, температура 300 К. Определить концентрацию молекул и среднюю кинетическую энергию поступательного движения одной молекулы.
2.44. Найти среднюю кинетическую энергию поступательного и вращательного движения молекул, содержащихся в 10 кг водорода при температуре 373 К.
2.45. Баллон емкостью 50 л заполнен кислородом при температуре 400 К. Когда часть газа израсходовали, давление в баллоне понизилось на 250 кПа. Определить массу израсходованного кислорода. Процесс считать изотермическим.
2.46. Вычислить плотность водорода, находящегося в баллоне под давлением 5 МПа при температуре 400 К.
2.47. Вычислить относительную молярную массу газа, если при температуре 308 К и давлении 5,6 МПа он имеет плотность 6,1 кг/м3.
2.48. Определить плотность водяного пара, находящегося под давлением 0,1 МПа и имеющего температуру 100 °С.
2.49. Баллон вмещает при нормальных условиях углекислый газ массой 2 кг. Определить массу находящегося в баллоне газа, если его температура 27 оС, а давление 91 кПа.
2.50. Плотность газа при давлении 0,4 МПа и температуре 560 К равна 2,41 кг/м3. Какова масса 1 моля этого газа?
2.51. Объем баллона электрической лампы 500 см3. Лампа наполнена аргоном при давлении 0,08 МПа. Какой объем воды войдет в баллон лампы, если ее опустить на малую глубину и обломить кончик? Атмосферное давление 0,1 МПа.
2.52. Какова плотность воздуха в сосуде емкостью 2 л, если сосуд откачан до 10–3 мм рт. ст., а температура воздуха 15 °С? Как изменится плотность воздуха в сосуде, если добавить в него 5∙10–8 кг воздуха? Какое давление установится в сосуде? Считать процесс изотермическим.
Газовые законы
2.53. В баллоне содержится газ при температуре 100 °С. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в два раза?
2.54. При нагревании идеального газа на 1 К при постоянном давлении объем его увеличился на 1/350 первоначального объема. Найти начальную температуру газа.
2.55. Полый шар вместимостью 50 см3, заполненный воздухом при температуре 500 К, соединили трубкой с чашкой, заполненной ртутью. Определить массу m ртути, вошедшей в шар при остывании в нем воздуха до температуры 300 К. Изменением вместимости шара при остывании пренебречь.
2.56. Котел объемом 2,5 м3 содержит перегретый водяной пар массой 12 кг при температуре 500 К. Определить давление газа в котле.
2.57. Оболочка воздушного шара вместимостью 800 м3 полностью заполнена водородом при температуре 273 К. На сколько изменится подъемная сила шара при повышении температуры до 303 К? Cчитать объем оболочки неизменным, а внешнее давление нормальным. В нижней части оболочки имеется отверстие, через которое водород может выходить в окружающее пространство.
2.58. В оболочке сферического аэростата находится газ объемом 1200 м3, заполняющий оболочку лишь частично. На сколько изменится подъемная сила аэростата, если газ в аэростате нагреть от 273 до 303 К? Давление газа в оболочке и окружающего воздуха постоянны и равны нормальному атмосферному давлению.
2.59. Каков должен быть вес оболочки детского воздушного шарика, наполненного водородом, чтобы результирующая подъемная сила шарика была равна нулю, т. е. чтобы шарик находился во взвешенном состоянии? Считать, что водород и воздух находятся при нормальных условиях. Давление внутри шарика равно внешнему давлению. Радиус шарика равен 15 см. Молярные массы газов известны.
2.60. Воздушный шар объемом 800 м3 заполнен гелием. При нормальных условиях он может поднять груз массой 500 кг. Какой груз может поднять тот же шар при замене гелия водородом при той же температуре? Считать, что молярные массы газов известны.
2.61. Воздушный шар объемом 200 м3, заполненный водородом при температуре 300 К, поднимает полезный груз массой 250 кг. Какой полезный груз сможет поднять воздушный шар, если его заполнить горячим воздухом при температуре 400 К? До какой температуры нужно нагреть воздух, чтобы воздушный шар смог поднять такой же полезный груз, как и при заполнении его водородом? Молярная масса воздуха μ = 0,029 кг/моль.
2.62. Оболочка воздушного шара имеет вместимость 1400 м3. Найти подъемную силу водорода, наполняющего оболочку, на высоте, где давление 60 кПа и температура 280 К. При подъеме шара водород может выходить через отверстие в нижней части шара.
2.63. Оболочка аэростата вместимостью 1500 м3, находящегося на поверхности Земли, на 6/8 наполнена водородом при давлении 100 кПа и температуре 300 К. Аэростат подняли на некоторую высоту, где давление 70 кПа и температура 280 К. Определить массу водорода, выходящего из оболочки при его подъеме.
2.64. Объем пузырька воздуха по мере всплывания его со дна озера на поверхность увеличивается в 2 раза. Какова глубина озера?
2.65. В шаре диаметром 30 см находится воздух массой 10 г. До какой температуры можно нагреть этот шар, если максимальное давление, которое выдерживают стенки шара, 0,4 МПа? Молярная масса воздуха 0,029 кг/моль.
2.66. Открытая стеклянная колба объемом 0,5 дм3, содержащая воздух, нагрета до 150 °С. Какой объем займет вода в колбе при остывании ее до 30 °С, если после нагревания ее горлышко опустить в воду? Атмосферное давление нормальное.
2.67. Сколько качаний поршневого насоса надо сделать, чтобы накачать пустую камеру футбольного мяча объемом 2,5 дм3 до давления, превышающего атмосферное в 3 раза? За каждое качание насос захватывает из атмосферы воздух объемом 180 см3. Температуру мяча считать постоянной.
2.68. Сколько качаний поршневого насоса потребуется для того, чтобы давление в баллоне объемом 2,5 дм3 уменьшилось в 100 раз? Объем камеры насоса 125 см3. Изменением температуры при откачивании газа пренебречь.
2.69. Объем камеры насоса равен V 0. За сколько циклов работы насоса можно накачать автомобильную камеру объемом V от давления P 1 до давления P 2? Температуру воздуха считать постоянной. Давление атмосферы P а.
2.70. Газ находится при температуре 273 К и давлении 0,2 МПа. Какое давление потребуется для того, чтобы увеличить плотность газа в 2 раза, если температура его будет доведена до 303 К?
2.71. При сжатии газа его объем уменьшился на 1,5 л, а давление увеличилось в 2,5 раза. Найти первоначальный объем газа.
2.72. Сколько времени потребуется, чтобы накачать камеру автомобильной шины объемом 10 л до давления 0,2 МПа, если при каждом качании насос захватывает из атмосферы цилиндрический столб воздуха высотой 15 см и диаметром 6 см. Время одного качания 1,5 с. Первоначальное давление в камере 0,1 МПа.
2.73. В вертикально расположенном цилиндре под невесомом поршнем находится воздух. Расстояние от поршня до дна цилиндра 50 см, диаметр поршня 20 см. На какое расстояние опустится поршень, если на него поставить гирю массой 200 г? Атмосферное давление нормальное, процесс сжатия воздуха считать изотермическим.
2.74. На сколько градусов надо нагреть газ, чтобы он, изобарно расширяясь, увеличил объем на 40 %, если до нагревания его температура была 27 °С?
2.75. Бутылка, заполненная газом при нормальных условиях, закрыта пробкой диаметром 1,5 см. Чтобы вытащить пробку из бутылки, надо нагреть газ в ней на 80 К. Чему равна сила трения, удерживающая пробку в бутылке?
2.76. В цилиндре под свободно перемещающимся невесомом поршнем на расстоянии 40 см от дна находится газ. На какое расстояние передвинется поршень, если температуру понизить на 50 К? Начальная температура газа 450 К?
2.77. Два сосуда с объемом V 1 = 150 см3 и V 2 = 300 см3 разделены легким подвижным поршнем, не проводящим тепла. Первоначальная температура в сосудах была Т = 300 К, а давление P = 1,01∙105 Па, затем меньший сосуд охладили до Т 1 = 273 К, а большой нагрели до Т 2 = 373 К. Какое давление установится в сосудах?
2.78. Цилиндрическая трубка длиной 60 см погружается в ртуть на 1/3 своей длины. Затем трубку сверху закрывают пальцем и вынимают из ртути; при этом часть ртути вытекает. Какова длина столбика ртути, оставшейся в трубке, если атмосферное давление 0,105 МПа?
2.79. Какова плотность воздуха в сосуде емкостью 2,5 л, если сосуд откачан до 10–3 мм рт. ст., а температура воздуха 17 °С? Как изменится плотность воздуха в сосуде, если добавить в него 5∙10–5 г воздуха? Какое давление установится в сосуде? Процесс считать изотермическим.
2.80. Баллон вместимостью 40 л заполнен азотом при температуре 350 К. Когда часть азота израсходовали, давление понизилось на 200 кПа. Определить массу израсходованного газа. Процесс считать изотермическим.
2.81. В баллоне емкостью 20 л находится аргон под давлением 800 кПа и при температуре 320 К. Когда из баллона было взято некоторое количество газа, давление в баллоне понизилось до 500 кПа, а температура стала равна 270 К. Определить массу аргона, взятого из баллона.
2.82. Азот находится в баллоне при температуре 300 К. На сколько изменится плотность ρ азота при изменении давления на 2 МПа и неизменной температуре.
2.83. Во сколько раз изменится плотность водорода при увеличении давления от 1,5 МПа до 3,5 МПа при постоянной температуре.
2.84. Определить массу газа в баллоне емкостью 40 л при температуре 20 °С и давлении 0,5 МПа, если его плотность при нормальных условиях – 1,4 кг/м3.
2.85. Кислород массой 16 г находится под давлением 0,2 МПа и температуре 300 К. После изобарного нагревания кислород занял объем 10 л. Определить: 1) объем газа до расширения; 2) температуру газа после расширения; 3) плотности газа до и после расширения.
2.86. В баллоне емкостью 30 л находится аргон под давлением 250 кПа при температуре 17 °С. После того как из баллона выпустили аргон массой 40 г, температура газа стала равной 7 °С. Определить давление аргона, оставшегося в баллоне.
2.87. При сжатии газа объем уменьшился на 5 л, а давление увеличилось в 2 раза. Найти первоначальный объем газа.
2.88. Если давление газа изотермически повысить на 0,15 МПа, то его объем уменьшится на 3 л, а если давление увеличить по сравнению с первоначальным на 0,2 МПа, то объем газа уменьшится на 4,5 л. Найти первоначальные давления и объем газа.
2.89. Ротационный насос захватывает за один оборот объем газа 5 см3 и выбрасывает его в атмосферу. Сколько оборотов n должен сделать насос, чтобы понизить давление воздуха в сосуде объемом 10 л от 0,1 МПа до 0,05 МПа?
2.90. Поршневым воздушным насосом откачивают сосуд объемом 5 л. За один цикл (ход поршня) насос захватывает объем 10 см3. Через сколько циклов давление в сосуде уменьшится в 4 раза.
Смеси газов; закон Дальтона
2.91. В одном баллоне вместимостью 20 л находится газ под давлением 0,2 МПа, а в другом – тот же газ под давлением 0,8 МПа. Баллоны соединены трубкой с краном. Если открыть кран, то в обоих баллонах установится давление 0,5 МПа. Какова вместимость второго баллона. Процесс считать изотермическим.
2.92. Определить массу 1 моля смеси, состоящей из кислорода массой 16 г и углекислого газа массой 11 г.
2.93. Полагая, что воздух по массе состоит из 76 % азота, 23 % кислорода и 1 % аргона. Найти массу 1 моля воздуха.
2.94. Найти объем смеси, состоящей из азота массой 1,4 кг и кислорода массой 1,6 кг при температуре 27 °С и давлении 0,5 МПа.
2.95. В баллоне вместимостью 20 л находится смесь водорода с азотом общей массой 64 г при температуре 17 °С и давлении 0,15 МПа. Найти массу водорода и массу азота в смеси.
2.96. Определить плотность смеси, состоящей из водорода массой 4 г и аргона массой 10 г, при температуре 27 °С и давлении 0,15 МПа.
2.97. Гремучим газом называется смесь, состоящая из одной части водорода и восьми частей кислорода. Определить плотность гремучего газа при нормальных условиях.
2.98. В сосуде объемом 2,5 л находятся углекислой газ 8,8 г и водяной пар 3,6 г при температуре 100 °С. Найти давление смеси в сосуде.
2.99. В сосуде находятся 7 г азота и 4 г водорода при температуре 27 °С и давлении 1,5 МПа. Найти молярную массу смеси и объем сосуда.
2.100. В сосуде объемом 1 л находится 0,4 г углекислого газа. При температуре 1500 К часть молекул СО2 диссоциировала на молекулы окиси углерода согласно уравнению: 2СО2 = 2СО + О2. При этом давление в сосуде оказалось равным 160 кПа. Найти степень диссоциации СО2 при этих условиях.
2.101. В сосуде находится 22 г СО2 и 7 г N2. Найти плотность смеси газов при температуре 300 К и давлении 0,5 МПа.
2.102. В сосуде находится 10–5 моль водорода и 10–4 г азота. Температура смеси 150 °С, давление 266 МПа. Найти объем сосуда, парциальные давления водорода и азота и концентрацию молекул в сосуде.
2.103. В двух сосудах объемами V 1 = 3 л и V 2 = 5 л находится воздух под давлением P 1 = 0,2 МПа и P 2 = 0,1 МПа соответственно. Температура в обоих сосудах одинакова. Какое давление установится, если сосуды соединить между собой. Температура воздуха не изменяется.
2.104. В сосуде объемом 10 л содержится 5 г водорода и 10 г углекислого газа при температуре 250 К. Определить: 1) молярную массу смеси; 2) давление в сосуде; 3) давление после нагревания смеси до 400 К.
2.105. В закрытом сосуде находится смесь газов, состоящая из 50 г кислорода и 80 г углекислого газа. Определить плотность смеси при температуре 100 °С и давлении 0,1 МПа. Как изменится плотность смеси, если температура увеличится до 150 °С?
2.106. Три баллона емкостью 10, 15 и 20 л наполнены соответственно: аргоном (P 1 = 0,3.МПа), водородом (P 2 = 0,5.МПа) и азотом (P 3 = 6 МПа) при одной и той же температуре. Каково будет давление смеси газов, если баллоны соединить между собой? Процесс считать изотермическим.
2.107. Топочный газ имеет следующий состав (по массе): СО2 – 21,4 %, Н2О – 6,8 %, N2 – 71,8 %. Определить удельный объем этого газа при давлении 0,1 МПа и температуре 450 К.
2.108. Сухой атмосферный воздух состоит (по массе) из азота – 71,09 %, кислорода – 20,95 %, аргона – 0,93 % и углекислого газа – 0,03 %. Пренебрегая примесями других газов, найти: 1) среднюю молярную массу атмосферного воздуха; 2) парциальные давления составляющих газов. Давление воздуха 0,1 МПа.
2.109. В баллоне емкостью 10 л содержится смесь газов, состоящих из 1016 молекул кислорода, 5∙1016 молекул азота и 6∙10–6 г аргона. Определить: 1) давление смеси; 2) молекулярную массу смеси; 3) среднюю энергию поступательного движения молекул смеси. Температура смеси 450 К.
2.110. При температуре 17 °С и давлении 1,2∙105 Па плотность смеси кислорода и азота равна 1,5 кг/м3. Определить концентрацию молекул кислорода и азота в смеси.
2.111. В баллоне емкостью 1,5 м3 содержится смесь азота и углекислого газа. Определить массу углекислого газа, если масса смеси 2,4 кг, температура 320 К и давление 0,4 МПа.
2.112. В сосуде при температуре 400 К и давлении 0,5 МПа находится 0,5 м3 смеси углекислого газа СО2 и сернистого газа SО2. Определить парциальные давления компонентов, если масса сернистого газа равна 6 кг.
2.113. В сосуде емкостью 5 л находится воздух при нормальных условиях. В сосуд вводят 2,5 г воды и закрывают крышкой. Определить давление в сосуде при 473 К, если вся вода при этой температуре превращается в пар.
2.114. В баллоне содержится азот массой 40 г и аргон массой 120 г. Давление смеси 2 МПа, температура 400 К. Определить емкость баллона.
2.115. В закрытом сосуде емкостью 4 м3 находятся 1,6 кг кислорода и 2 кг гелия. Определить температуру газовой смеси и парциальное давление гелия, если парциальное давление кислорода равно 0,15 МПа.
2.116. Какой о



 до
до 

 – общее число молекул;
– общее число молекул;  – масса молекулы.
– масса молекулы. до
до  :
: ,
, – относительная скорость, равная отношению скорости
– относительная скорость, равная отношению скорости  к наивероятнейшей скорости
к наивероятнейшей скорости  ;
;  – функция распределения по относительным скоростям.
– функция распределения по относительным скоростям. :
: ,
, – функция распределения по импульсам.
– функция распределения по импульсам.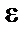 до
до  :
: ,
, – функция распределения по кинетическим энергиям.
– функция распределения по кинетическим энергиям. ,
,
 – эффективный диаметр молекулы;
– эффективный диаметр молекулы;  – концентрация молекул;
– концентрация молекул;  – средняя арифметическая скорость молекул.
– средняя арифметическая скорость молекул.

 = π
= π  ;
;  ;
;  , здесь
, здесь  – эффективные диаметр и радиус молекулы.
– эффективные диаметр и радиус молекулы. ,
, – средняя арифметическая скорость молекул.
– средняя арифметическая скорость молекул.
 – динамическая вязкость газа;
– динамическая вязкость газа;  – градиент (поперечной) скорости течения его слоев;
– градиент (поперечной) скорости течения его слоев;  – площадь элемента поверхности;
– площадь элемента поверхности;  – время переноса.
– время переноса.
 – сила внутреннего трения между движущимися слоями жидкости.
– сила внутреннего трения между движущимися слоями жидкости.
 ,
, ,
, – количество теплоты, прошедшее посредством теплопроводности через сечение площадью S за время
– количество теплоты, прошедшее посредством теплопроводности через сечение площадью S за время  ;
;  – теплопроводность;
– теплопроводность;  – градиент температуры.
– градиент температуры.
 – удельная теплоемкость газа при постоянном объеме;
– удельная теплоемкость газа при постоянном объеме;  – плотность газа;
– плотность газа; 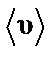 – средняя арифметическая скорость молекул;
– средняя арифметическая скорость молекул;  – средняя длина свободного пробега.
– средняя длина свободного пробега. ,
, – масса i -й компоненты газа, перенесенной в результате диффузии через поверхность площадью S, перпендикулярной оси
– масса i -й компоненты газа, перенесенной в результате диффузии через поверхность площадью S, перпендикулярной оси  , за время
, за время 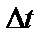 ;
;  – градиент парциальной плотности i -й компоненты.
– градиент парциальной плотности i -й компоненты.


 ,
где
,
где  – количество вещества.
– количество вещества.


 .
. находим концентрацию молекул n:
находим концентрацию молекул n:









 .
.




 где Р 1, Р 2, Р 3 – парциальные давления соответственно водорода, водяного пара и двуокиси углерода, которые находим из уравнения Менделеева–Клапейрона
где Р 1, Р 2, Р 3 – парциальные давления соответственно водорода, водяного пара и двуокиси углерода, которые находим из уравнения Менделеева–Клапейрона



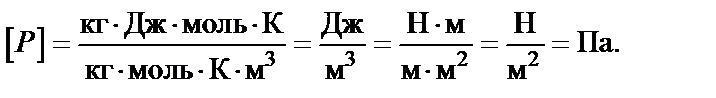
 .
. .
. и температуре
и температуре  .
.
 ,
,

 .
.

 – постоянная Больцмана.
– постоянная Больцмана.
 .
. .
. .
.
 ,
где N – число качаний.
Запишем уравнение Менделеева–Клапейрона для начального состояния газа:
,
где N – число качаний.
Запишем уравнение Менделеева–Клапейрона для начального состояния газа:
 (1)
И по аналогии для конечного состояния:
(1)
И по аналогии для конечного состояния:
 (2)
(2)
 t =?
t =?

 , тогда:
, тогда: (3)
(3)
 – масса воздуха, закачанного в камеру
– масса воздуха, закачанного в камеру ,
, – плотность воздуха, V 1 – объем захватываемого воздуха при одном качании
– плотность воздуха, V 1 – объем захватываемого воздуха при одном качании ,
, .
. (4)
(4)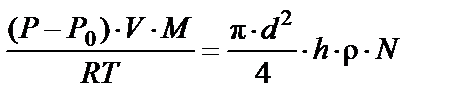 .
. .
. .
.



 .
. .
. .
.

 .
.
 .
. , а также среднюю кинетическую энергию поступательного движения, вращательного движения и среднее значение полной кинетической энергии одной молекулы.
, а также среднюю кинетическую энергию поступательного движения, вращательного движения и среднее значение полной кинетической энергии одной молекулы.


