

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
А) величина, указывающая на количественное содержание водяного пара в воздухе;
Б) величина, показывающая, насколько при данной температуре водяной пар близок к насыщению;
В) величина, указывающая на наличие водяного пара в атмосфере.
Введение
Из курса физики 8 класса вам хорошо известно, что такое агрегатное состояние вещества. Кроме того, вы хорошо знаете, каким образом вещество может переходить из одного состояния в другое. В частности, вы знаете, что, если жидкость превращается в пар, такой процесс называется парообразованием, обратный же процесс, переход из пара в жидкость, называется конденсацией. Схема таких преобразований представлена на рисунке 1.
 Рис. 1. Схема изменения агрегатного состояния вещества
Рис. 1. Схема изменения агрегатного состояния вещества
Парообразование – свойство капельных жидкостей заменять свое агрегатное состояние и превращаться в пар.
Из материала 8 класса мы знаем, что парообразование делится на два вида:
1. Испарение, которое происходит с поверхности раздела жидкости и окружающего воздуха;
2. Кипение, которое происходит во всем объеме жидкости при определенных условиях.
Насыщенный пар
Давайте задумаемся над таким вопросом. Как мы знаем, все молекулы жидкости находятся в состоянии непрерывного хаотического движения. Хаотичность, в частности, означает, что направление движения отдельных молекул носит случайный характер. Почему же при этом жидкость сохраняет свой объем, а не распадается на отдельные частицы? Между молекулами действуют силы притяжения, которые не позволяют им покинуть жидкость. Кроме того, очевидно, что значение скоростей молекул также случайны, а следовательно, среди них обязательно найдутся очень быстрые молекулы. Если такая молекула вследствие хаотического перемещения окажется вблизи поверхности раздела жидкости и окружающего воздуха, то ее кинетической энергии может хватить на то, чтобы преодолеть силы притяжения и вырваться наружу (см. рис. 2).
 Рис. 2. Наглядное изображение поведения молекул в жидкости
Рис. 2. Наглядное изображение поведения молекул в жидкости
Это и есть упомянутый выше процесс испарения. Когда количество испарившихся молекул становится значительным, они образуют пар. Конечно, может произойти и обратное. Вырвавшиеся за пределы жидкости молекулы вследствие хаотического движения снова вернутся в объем жидкости, такой процесс, как мы знаем, называется конденсацией. Если сосуд с жидкостью будет открыт, то испарившиеся молекулы могут безвозвратно покидать пространство над жидкостью, в результате чего количество последней будет постепенно уменьшаться. Примеры описанного мы можем повсеместно наблюдать вокруг, все процессы высыхания именно так и происходят – жидкость испаряется, а пар обратно не конденсируется вследствие того, что молекулы этого пара удаляются от жидкости.
Проделайте дома очень простой эксперимент: наполните стакан водой и проследите за уровнем воды в течение нескольких дней. Через несколько дней вы увидите, что уровень воды стал значительно ниже, вода испарялась.
Разные жидкости испаряются с разными скоростями. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии их преодолеть и вылететь наружу и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее – вода. Намного медленнее воды испаряются масло и ртуть.
Поскольку испарение – это уход из жидкости самых быстрых молекул, то средняя кинетическая энергия молекул, которые остались в жидкости, естественно уменьшается.
А что такое средняя кинетическая энергия молекул? Это, фактически, температура, т. е. жидкость при испарении остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости, особенно при ветре, когда выходишь из воды. Вода, испаряясь по всей поверхности тела, уносит тепло. Ветер же ускоряет процесс испарения.
А что будет, если мы закроем сосуд с жидкостью? Молекулы пара уже не смогут покидать пространство над ней, по мере испарения их количество сначала будет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
 Рис. 3. Процессы испарения и конденсации в закрытой системе (сосуде)
Рис. 3. Процессы испарения и конденсации в закрытой системе (сосуде)
Т. е. в такой системе будут идти два конкурирующих процесса (см. рис. 3).
Первый – это процесс испарения, для которого количество покидающих жидкость молекул будет определяться только температурой. Почему?
А второй процесс – это процесс конденсации, в котором количество возвращающихся в жидкость молекул будет, помимо прочего, зависеть и от концентрации молекул пара: чем больше молекул пара, тем большая вероятность, что одна из них вернется в жидкость.
Вначале, пока эта концентрация невелика, количество конденсирующихся молекул за единицу времени будет, естественно, меньше количества испаряющихся молекул, т. е. молекул, покидающих жидкость. Однако по мере роста концентрации пара поток молекул пар – жидкость будет расти, а обратный поток будет оставаться прежним, ведь он определяется только температурой.
В какой-то момент оба количества молекул станут равными. Как говорят физики, в системе установится динамическое равновесие, а пар достигнет состояния так называемого насыщения. Соответственно, пар, который находится в состоянии динамического равновесия со своей жидкостью, мы будем называть насыщенным.
Представьте себе здание с огромным количеством дверей. Какое-то количество людей заходит в это здание, а какое-то количество людей выходит из этого здания. Если количество людей, которые входят в здание, равно количеству людей, которые выходят из здания в единицу времени, то можно сказать, что достигнуто состояние насыщения. Вот точно так же происходит и в случае с паром.
Насыщенный пар – это в некотором смысле предельное состояние пара. Имеется в виду, что значение давления этого пара и его плотности являются максимальными при данном значении температуры. В противном же случае мы будем называть пар ненасыщенным.
До сих пор газообразное состояние мы обсуждали лишь на примере идеального газа, тем более удивительным является тот факт, что некоторые уравнения, которые описывают идеальный газ, вполне подходят и для состояния насыщенного пара.
Оказывается, что состояние насыщенного пара хоть и приближенно, но вполне удовлетворительно описывается уравнением Менделеева – Клапейрона:

Здесь индекс Н указывает на то, что данные параметры относятся к насыщенному пару, µ – это молярная масса пара.
Свойства насыщенного пара
Теперь обсудим, какими основными свойствами обладает насыщенный пар и как эти свойства отличаются от свойств идеального газа или совпадают с ними. Все то, о чем мы будем говорить ниже, получено экспериментально, однако мы постараемся дать и качественное объяснение этих свойств.
Итак, свойство первое: при постоянной температуре плотность насыщенного пара не зависит от его объема. Понять это свойство легко. Представим себе, что мы, не меняя температуры, уменьшим объем сосуда, в котором находится насыщенный пар (см. рис. 5).
 Рис. 5. Процесс сжатия пара в цилиндре (уменьшение обьема)
Рис. 5. Процесс сжатия пара в цилиндре (уменьшение обьема)
Количество молекул, переходящих от пара к жидкости в единицу времени, естественно, превысит количество испаряющихся молекул, но при этом часть пара просто сконденсируется, а оставшийся пар снова придет в состояние динамического равновесия. В итоге плотность этого пара будет равна начальной плотности:

Второе свойство: давление насыщенного пара не зависит от его объема. Этот факт очевиден ввиду простой связи давления и плотности, выраженной уравнением Менделеева – Клапейрона. Как следствие, закон Бойля-Мариотта для насыщенного пара выполняться не будет. Закон Бойля-Мариотта имеет вид:

Третье свойство: при неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры. Действительно, при увеличении температуры возрастает скорость испарения жидкости. Динамическое равновесие в первый момент будет нарушено, т. е. произойдет дополнительное испарение некоторой части жидкости. Плотность пара будет возрастать до тех пор, пока динамическое равновесие вновь не восстановится.
А при охлаждении произойдет обратный процесс: часть пара сконденсируется, уменьшая его плотность.
Четвертое свойство: давление насыщенного пара растет с температурой быстрее, чем по линейному закону, как это было в случае идеального газа. В самом деле, с ростом температуры возрастает плотность насыщенного пара, а согласно уравнению Менделеева – Клапейрона давление пропорционально произведению плотности на температуру.
Т. е. в случае идеального газа рост давления обуславливался только ростом температуры, теперь работают два фактора: зависимость давления насыщенного пара от температуры, что представлено участком 1-2 графика (см. рис. 6).
 Рис. 6. График зависимости давления насыщенного пара от температуры
Рис. 6. График зависимости давления насыщенного пара от температуры
Эту зависимость нельзя вывести из законов идеального газа. При изохорном нагревании или охлаждении насыщенного пара его масса меняется. Поэтому закон Шарля в данном случае работать не будет.
Обратите внимание: в точке 2 вся жидкость испаряется. При дальнейшем повышении температуры пар становится ненасыщенным и его давление здесь растет как раз согласно закону Шарля. Это участок 2-3 (см. рис. 6). Закон Шарля имеет вид:

Вспомним, что линейный рост давления идеального газа вызван ростом интенсивности ударов молекул о стенки сосудов. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще, ведь пара становится больше. Именно одновременным действием этих двух факторов и вызван нелинейный рост давления насыщенного пара на участке 1-2.
Если подытожить приведенные выше свойства, то можно сказать, что коренным отличием насыщенного пара от идеального газа является тот факт, что он не является замкнутой системой, т. е. находится в постоянном контакте с жидкостью.
Кипение
Обсудим еще один вид парообразования – кипение, хорошо знакомое каждому.
Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. А при нагревании внутрь этих микропузырьков начинают проникать испаряющиеся молекулы жидкости. В итоге пузырьки постепенно увеличиваются в размерах и становятся видимы невооруженным газом. В кастрюле с водой они осаждаются на дне и стенках. В течение короткого времени пар внутри пузырьков становится насыщенным, давление которого, как вы помните, быстро растет с повышением температуры. Чем крупнее становятся пузырьки по мере роста температуры, тем больше действует на них архимедова сила, и с определенного времени начнется отрыв и всплытие пузырьков, так как архимедова сила станет больше, чем сила тяжести, действующая на пузырек. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости, пар в них конденсируется и пузырьки сжимаются. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени, вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар. Шум сменяется бурлением. Мы говорим, что жидкость закипела.
В отличие от испарения, которое происходит при любой температуре, кипение, как мы знаем, происходит только при фиксированной температуре – той температуре, которой достаточно, чтобы пузырек смог вырасти, подняться на поверхность и лопнуть.
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость, чаще всего это атмосферное давление.
Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение (рис. 7).
 Рис. 7. График зависимости температуры кипенмя воды от давления среды
Рис. 7. График зависимости температуры кипенмя воды от давления среды
При нормальном атмосферном давлении, которое составляет приблизительно 100 000 Па, температура кипения воды, как мы знаем, равна  . Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре
. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре  равно 105 или 100 000 Па. Этот факт необходимо знать при решении задач. Очень часто он считается известным по умолчанию.
равно 105 или 100 000 Па. Этот факт необходимо знать при решении задач. Очень часто он считается известным по умолчанию.
Естественно, чем выше мы поднимаемся в атмосфере, тем меньше становится это атмосферное давление. Так, например, на вершине самой высокой горы Кавказа – Эльбруса – атмосферное давление составляет  , т. е. в 2 раза меньше, чем нормальное атмосферное давление (см. рис. 8).
, т. е. в 2 раза меньше, чем нормальное атмосферное давление (см. рис. 8).

Рис. 8. Наглядное представление зависимости температуры кипения воды от изменения давления с высотой
Естественно, что температура кипения там будет ниже, чем на уровне моря. Вода там закипит при температуре  .
.
Температура кипения при нормальном атмосферном давлении является строго определенной для данной жидкости величиной.Так, спирт кипит при  , эфир – при
, эфир – при  , ртуть – при
, ртуть – при  . Обратите внимание, чем более летучей является жидкость, тем ниже ее температура кипения. Например, кислород кипит при
. Обратите внимание, чем более летучей является жидкость, тем ниже ее температура кипения. Например, кислород кипит при  , поэтому при обычных температурах кислород – это газ.
, поэтому при обычных температурах кислород – это газ.
Естественно, если увеличивать давление над жидкостью, то и температура кипения будет расти, именно этот принцип положен в основу работы так называемых скороварок. Искусственным образом над жидкостью создается повышенное давление, и вода начинает кипеть при температурах значительно больше, чем  . В этом случае продукты, которые мы хотим приготовить, например картофель, будут приготовлены значительно быстрее, чем в случае нормального атмосферного давления, отсюда и название скороварка.
. В этом случае продукты, которые мы хотим приготовить, например картофель, будут приготовлены значительно быстрее, чем в случае нормального атмосферного давления, отсюда и название скороварка.
Мы знаем, что если чайник снять с огня, то кипение тут же прекратится. Процесс кипения требует непрерывного подвода тепла. Вместе с тем температура воды в чайнике после закипания перестает меняться, оставаясь равной  .
.
Куда же при этом девается подводимое тепло, не противоречит ли это закону сохранения энергии? В 8 классе мы уже отвечали на этот вопрос – тепло идет на увеличение потенциальной энергии молекул, в данном случае на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалеку друг от друга, и жидкость будет переходить в газообразное состояние. Следует сделать одно важное замечание: кипение будет невозможным, если в ней отсутствует растворенные газовые пузырьки. Подробнее об этом мы поговорим во втором ответвлении.
Абсолютная влажность
Попробуем сформулировать, что в физике понимается под влажностью воздуха. Прежде всего, что за вода содержится в воздухе? Ведь таковой, например, является туман, дождь, облака и прочие атмосферные явления, проходящие с участием воды в том или ином агрегатном состоянии. Если все эти явления учитывать при описании влажности, то как проводить измерения? Уже из таких простых рассуждений становится ясно, что интуитивными определениями здесь не обойтись. На самом деле речь идет, прежде всего, о парах воды, которые содержатся в нашей атмосфере.
Атмосферный воздух – это смесь газов, одним из которых и является водяной пар. Он вносит свой вклад в атмосферное давление, этот вклад называется парциальным давлением (а также упругостью) водяных паров.
Закон Дальтона
Основные закономерности, которые мы с вами получали в рамках изучения молекулярно-кинетической теории, относятся к так называемым чистым газам, т. е. газам, состоящим из атомов или молекул одного сорта. Однако очень часто приходится иметь дело со смесью газов. Самым простым и распространенным примером такой смеси является атмосферный воздух, который окружает нас. Как мы знаем, он на 78 % состоит из азота, на 21 % с лишним – из кислорода, а оставшийся процент занимают водяные пары и другие газы (рис. 1).

Рис. 1. Состав атмосферного воздуха
Каждый из газов, который входит в состав воздуха или любой другой смеси газов, безусловно, вносит свой вклад в общее давление данной смеси газов. Вклад каждого отдельного такого компонента носит название парциальное давление газа, т. е. то давление, которое оказывал бы данный газ в отсутствии других компонент смеси.
Английский химик Джон Дальтон экспериментальным путем установил, что для разреженных газовых смесей общее давление есть простая сумма парциальных давлений всех компонент смеси:

Данное соотношение носит название закона Дальтона.
Доказательство закона Дальтона в рамках молекулярно-кинетической теории хотя и не особо сложное, однако достаточно громоздкое, поэтому приводить здесь мы его не будем. Качественно же объяснять этот закон достаточно просто, если учесть тот факт, что мы взаимодействием между молекулами пренебрегаем, т. е. молекулы представляют собой упругие шары, которые могут только сталкиваться друг с другом и со стенками сосуда. На практике модель идеального газа хорошо работает лишь для достаточно разреженных систем. В случае же плотных газов будут наблюдаться отклонения от выполнения закона Дальтона.
Парциальное давление p водяных паров является одним из показателей влажности воздуха, который измеряется в паскалях или миллиметрах ртутного столба.
Давление водяного пара зависит от концентрации его молекул в воздухе, а также от абсолютной температуры последнего. Чаще за характеристику влажности принимают плотность ρ водяного пара, содержащегося в воздухе, она называется абсолютной влажностью.
Абсолютная влажность показывает, сколько граммов водяного пара содержится в  воздуха. Соответственно, единица измерения абсолютной влажности –
воздуха. Соответственно, единица измерения абсолютной влажности –  . Оба упомянутых показателя влажности связаны уравнением Менделеева – Клапейрона.
. Оба упомянутых показателя влажности связаны уравнением Менделеева – Клапейрона.

 – молярная масса водяного пара;
– молярная масса водяного пара;
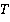 – его абсолютная температура.
– его абсолютная температура.
То есть, зная один из показателей, например плотность, мы можем легко определить другой, то есть давление.
Мы с вами знаем, что водяной пар может быть как ненасыщенным, так и насыщенным. В целом водяной пар в атмосфере, несмотря на наличие большого количества водоемов (океаны, моря, реки, озера и так далее), является ненасыщенным, ведь наша атмосфера не является закрытым сосудом. Однако перемещение воздушных масс (ветра, ураганы и так далее) приводят к тому, что в разных точках Земли в каждый момент времени наблюдается разное соотношение между скоростями конденсации и испарением воды, вследствие чего в отдельных местах пар может достигать насыщения. К чему это приводит? К тому, что в такой местности пар начинает конденсироваться, ведь мы помним, что насыщенный пар всегда контактирует со своей жидкостью. Как результат, может образоваться туман или облака, выпасть роса. Температура, при которой пар становится насыщенным, называется точкой росы. Давление водяного пара (насыщенного) в точке росы обозначим  .
.
Подумайте, почему, как правило, роса выпадает ранним утром. Что в этот момент суток происходит с температурой, а следовательно, и с предельным давлением, с давлением насыщенного пара? Очевидно, что знание абсолютной влажности или парциального давления водяного пара не дает нам никакого представления о том, насколько близок или далек данный пар от насыщения, а ведь именно от этой удаленности или близости к насыщению и зависит скорость процессов испарения и конденсации, т. е. тех процессов, которые и обуславливают жизнедеятельность живых организмов.

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!