61.Химические цепи без переноса (приведите пример). Зависимость ЭДС химических цепей без переноса от активности потенциалопределяющих ионов в растворе. Вывод и анализ уравнения Нернста. Примером такой цепи является водород-хлорсеребряный элемент
Pt | (H2) | HCl | AgCl | Ag, (I)
кот состоит из водородного и хлорсеребряного эл-дов, погруженных в р-р хлороводорода. При работе в таком элементе протекают эл-дные реакции: 1/2H2(газ)®H+(р-р) + e; AgCl (тв) + e ®Ag (тв) + Cl–(р-р)
Т о, суммарный процесс представляет собой химическую реакцию: 1/2H2(газ) + AgCl (тв)®Ag (тв) + Н+(р-р) + Cl–(p-p);
ЭДС такой цепи равна разности потенциалов хлорсеребряного и водородного электродов. Учитывая ур-ия получим
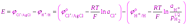
Разность стандартных потенциалов хлорсеребряного и водородного эл-дов дают стандрт ЭДС цепи Е о, но т к стандартный потенциал водородного эл-да принят равным нулю, то Е о равна стандартному потенциалу хлорсеребряного электрода. Если давление водорода =1, то
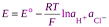 .
.
Если хлороводород полностью диссоциирован в р-ре, то произведение активностей ионов водорода и хлора можно заменить средней ионной активностью 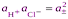 , тогда
, тогда
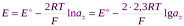 62.Концентрационные цепи без переноса, приведите примеры. Для произвольно выбранного концентрационного элемента названного типа запишите химический процесс, протекающий в элементе. Вывод уравнения Нернста для расчёта ЭДС этого элемента.
62.Концентрационные цепи без переноса, приведите примеры. Для произвольно выбранного концентрационного элемента названного типа запишите химический процесс, протекающий в элементе. Вывод уравнения Нернста для расчёта ЭДС этого элемента.
63.Классификация гальванических элементов. Примеры концентрационных цепей. Уравнение Нернста для концентрационного элемента, составленного из двух амальгамных электродов. Определение полярности электродов. Концентрационная цепь без переноса: Элемент, состоящий из двух одинаковых амальгамных электродов с различной концентрацией металла в них, опущенные в один раствор, содержащий ионы этого металла. Пример элемента: Pt | Zn(Hg)(a1) | ZnSO4 | Zn(Hg)(a2) | Pt; Уравнения полуреакций: Zn2+ + 2e → Zn для обоих электродов; Уравнение Нернста 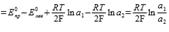 64.Концентрационные гальванические элементы, составленные из двух электродов первого рода, электрохимическая цепь с переносом. Уравнение Нернста для расчета ЭДС элемента. Дайте обоснование приведенного уравнения. Концентрационная цепь с переносом: Элемент, состоящий из одинаковых электродов, опущенных в растворы с различной активностью (концентрацией) ионов. Пример элемента: Cu | CuCl2 (a1) || CuCl2 (a2) | Cu; Уравнения полуреакций: Cu2+ + 2e → Cu для обоих электродов Уравнение Нернста:E=
64.Концентрационные гальванические элементы, составленные из двух электродов первого рода, электрохимическая цепь с переносом. Уравнение Нернста для расчета ЭДС элемента. Дайте обоснование приведенного уравнения. Концентрационная цепь с переносом: Элемент, состоящий из одинаковых электродов, опущенных в растворы с различной активностью (концентрацией) ионов. Пример элемента: Cu | CuCl2 (a1) || CuCl2 (a2) | Cu; Уравнения полуреакций: Cu2+ + 2e → Cu для обоих электродов Уравнение Нернста:E= 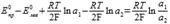 ЭДС таких элементов очень мала, они используются для определения pH и концентраций труднорастворимых солей.
ЭДС таких элементов очень мала, они используются для определения pH и концентраций труднорастворимых солей.
65.Концентрационные гальванические элементы. Приведите пример концентрационного гальванического элемента, составленного из двух электродов второго рода. Как определить полярность электродов данного элемента? Запишите уравнение Нернста для представленного элемента и дайте необходимые пояснения. Концентрационная цепь, составленная из электродов II рода: Ag, AgCl | KCl(a1) || KCl(a2) | AgCl, Ag; Уравнение Нернста: E=Eпр−Eлев= 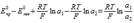 . Полярность опред-ся путем сравнения конц. Правым (+) будет тот эл-род, который опущен в р-р с более высокой конц. хлорид-ионов, т. к. только в этом случае E > 0.
. Полярность опред-ся путем сравнения конц. Правым (+) будет тот эл-род, который опущен в р-р с более высокой конц. хлорид-ионов, т. к. только в этом случае E > 0.
66. Зависимость ЭДС гальванического элемента от температуры. Определение изменения термодинамических функций окислительно-восстановительных реакций потенциометрическим методом. Проиллюстрируйте процедуру расчета на произвольном примере.



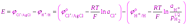
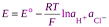 .
.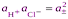 , тогда
, тогда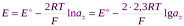 62.Концентрационные цепи без переноса, приведите примеры. Для произвольно выбранного концентрационного элемента названного типа запишите химический процесс, протекающий в элементе. Вывод уравнения Нернста для расчёта ЭДС этого элемента.
62.Концентрационные цепи без переноса, приведите примеры. Для произвольно выбранного концентрационного элемента названного типа запишите химический процесс, протекающий в элементе. Вывод уравнения Нернста для расчёта ЭДС этого элемента.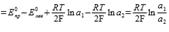 64.Концентрационные гальванические элементы, составленные из двух электродов первого рода, электрохимическая цепь с переносом. Уравнение Нернста для расчета ЭДС элемента. Дайте обоснование приведенного уравнения. Концентрационная цепь с переносом: Элемент, состоящий из одинаковых электродов, опущенных в растворы с различной активностью (концентрацией) ионов. Пример элемента: Cu | CuCl2 (a1) || CuCl2 (a2) | Cu; Уравнения полуреакций: Cu2+ + 2e → Cu для обоих электродов Уравнение Нернста:E=
64.Концентрационные гальванические элементы, составленные из двух электродов первого рода, электрохимическая цепь с переносом. Уравнение Нернста для расчета ЭДС элемента. Дайте обоснование приведенного уравнения. Концентрационная цепь с переносом: Элемент, состоящий из одинаковых электродов, опущенных в растворы с различной активностью (концентрацией) ионов. Пример элемента: Cu | CuCl2 (a1) || CuCl2 (a2) | Cu; Уравнения полуреакций: Cu2+ + 2e → Cu для обоих электродов Уравнение Нернста:E= 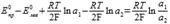 ЭДС таких элементов очень мала, они используются для определения pH и концентраций труднорастворимых солей.
ЭДС таких элементов очень мала, они используются для определения pH и концентраций труднорастворимых солей.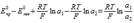 . Полярность опред-ся путем сравнения конц. Правым (+) будет тот эл-род, который опущен в р-р с более высокой конц. хлорид-ионов, т. к. только в этом случае E > 0.
. Полярность опред-ся путем сравнения конц. Правым (+) будет тот эл-род, который опущен в р-р с более высокой конц. хлорид-ионов, т. к. только в этом случае E > 0.

