2.1 Состав атома
Атом – это мельчайшая, химически неделимая электронейтральная частица вещества. В центре атома находится ядро, состоящее из протонов р и нейтронов n. Вокруг ядра вращаются электроны  . Разновидности атомов одного и того же элемента, отличающиеся своей массой, называются изотопами. Атомы, ядра которых имеют различные заряды, но одинаковую массу, называют изобарами.
. Разновидности атомов одного и того же элемента, отличающиеся своей массой, называются изотопами. Атомы, ядра которых имеют различные заряды, но одинаковую массу, называют изобарами.
Количество элементарных частиц (протонов р, электронов  и нейтронов n) можно определить по формулам:
и нейтронов n) можно определить по формулам:
 ; (2.1)
; (2.1)
 , (2.2),
, (2.2),
где Z – порядковый номер элемента; А – атомная масса изотопа элемента.
Любые изотопы, в том числе и стабильные, можно превратить в изотопы других элементов путем бомбардировки их ядер тяжелыми элементарными частицами (протоны, нейтроны), либо ядрами легких элементов (гелия, лития, кислорода и др.). При этом одновременно с дочерним ядром образуется одна или несколько элементарных частиц.
Процессы взаимодействия ядер одних элементов с ядрами других элементов или с элементарными частицами, при которых образуются ядра новых элементов, получили название ядерных реакци й. При составлении уравнений ядерных реакций необходимо учитывать закон сохранения массы веществ (масса электронов при этом не учитывается). Кроме того, заряды всех частиц в левой и правой частях уравнения должны быть равны. Подобно химическим, ядерные реакции подразделяются на реакции обмена, присоединения, разложения (радиоактивный распад).
Пример 1. Составить уравнение ядерной реакции, в которой ядра  поглощают α-частицу, а излучают протон. Определить тип реакции.
поглощают α-частицу, а излучают протон. Определить тип реакции.
Решение. Уравнение имеет вид  или в сокращенной форме:
или в сокращенной форме:  ; данная реакция является реакцией обмена.
; данная реакция является реакцией обмена.
Стабильность ядер зависит от числа протонов и нейтронов, входящих в их состав, и от их соотношения. При недостатке или избытке нейтронов ядро становится неустойчивым и распадается. Существует несколько типов радиоактивного распада:
 – протонный распад,
– протонный распад,
 – α-распад,
– α-распад,
 – позитронный распад,
– позитронный распад,
 – электронный распад.
– электронный распад.
2.2. Строение электронных оболочек
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:

 (2.3)
(2.3)
Пример 2. Сколько протонов и нейтронов содержат ядра изотопа  ? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам.
? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам.
Решение. 1. Количество протонов и нейтронов рассчитаем по формулам (2.1) и (2.2):  ,
,  .
.
Здесь заряд ядра атома кальция Z = 20, атомная масса изотопа кальция А = 41. Получим Р = 20, n = 41-20 = 21.
2. Используя алгоритм распределения электронов по подуровням (2.3), составим электронную формулу атома кальция:

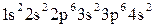 .
.
Так как последним заполняется s-подуровень, кальций относится к s-семейству.


 3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2
3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2
Пример 3. Какие значения квантовых чисел n, l, ml, ms имеют валентные электроны атома  ? Напишите электронную формулу элемента.
? Напишите электронную формулу элемента.
Решение. 1. Электронную формулу атома алюминия составим согласно формуле (2.3):

 .
.
Известно, что валентными для s и p-элементов являются электроны внешнего слоя. Для атома алюминия это 3s23p1.
2. Состояние электрона в атоме описывается набором четырех квантовых чисел в виде групп символов nlx:
а) n - главное квантовое число, определяется по номеру заполненного уровня;
б) l - побочное (орбитальное) квантовое число. Для s-подуровня l=0; для р-подуровня l=1; для d-подуровня l=2 и т.д.; х - число электронов на этом подуровне;
в) m l– магнитное квантовое число, принимающее следующие значения:  ;
;
г) m s - спиновое квантовое число, принимающее значения ±1/2.
| 13 Al
| 3s2
|
| 3p1
|
|
|
| ¯
|
|
|
|
|
|
| n=
| 3 3
| 3
1
-1

|
| l=
| 0 0
|
| ml =
ms=
| 0 0
 
|
| | | | | | | | | | |
Для определения квантовых чисел необходимо распределить валентные электроны по квантовым ячейкам: 



 . Разновидности атомов одного и того же элемента, отличающиеся своей массой, называются изотопами. Атомы, ядра которых имеют различные заряды, но одинаковую массу, называют изобарами.
. Разновидности атомов одного и того же элемента, отличающиеся своей массой, называются изотопами. Атомы, ядра которых имеют различные заряды, но одинаковую массу, называют изобарами. ; (2.1)
; (2.1) , (2.2),
, (2.2), поглощают α-частицу, а излучают протон. Определить тип реакции.
поглощают α-частицу, а излучают протон. Определить тип реакции. или в сокращенной форме:
или в сокращенной форме:  ; данная реакция является реакцией обмена.
; данная реакция является реакцией обмена. – протонный распад,
– протонный распад, – α-распад,
– α-распад, – позитронный распад,
– позитронный распад, – электронный распад.
– электронный распад.
 (2.3)
(2.3) ? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам.
? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам. ,
,  .
. 
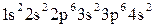 .
.

 3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2
3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2 ? Напишите электронную формулу элемента.
? Напишите электронную формулу элемента.
 .
. ;
;





