Периодический закон и периодическая система Д.И. Менделеева
I. Периодический закон и периодическая система
| | | | | |
| | Менделеевская формулировка
Свойства простых веществ и образуемых ими соединений находятся в периодической зависимости от величины их атомных масс
| | | | Современная формулировка
Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от величины зарядов ядер их атомов
| |
|
| |  |


 1-й – 2 элемента
1-й – 2 элемента
2-й – 8 элементов малые
3-й – 8 элементов


 4-й – 18 элементов
4-й – 18 элементов
5-й – 18 элементов
| Элементы больших периодов
только Ме
| |
| Элементы малых и больших периодов
Ме и Нем
| |
6-й – 32 элементов большие
7-й – 29 элементов
(незавершен)
II. Положение элемента в ПС и строение атома.
| Положение элемента
| Строение атома
|
| Порядковый номер элемента
| Заряд ядра; число протонов в ядре; общее число электронов в атоме
|
| Номер группы
| Высшая валентность в оксидах; число электронов на последнем уровне
(подгруппа А)
|
| Номер периода
| Число энергетических уровней в атоме
|
|
| Число нейтронов в атоме равно разности между относительной атомной массой и порядковым номером
|
III. Периодичность изменения свойств элементов.
Горизонтальное направление (слева направо по периоду):
Аr↑, заряд ядра ↑, Rат ↓, ↑ притяжение электронов к ядру, поэтому Ме свойства ↓, Нем свойства ↑, восстановительная способность ↓, окислительная способность ↑, ↑ высшая валентность в оксидах и гидроксидах, основный характер соединений ослабевает, кислотный усиливается.
I II III IV V VI VII
R2O RO R2O3 RO2 R2O5 RO3 R2O7
RO H R(OH)2 H3RO3 H2RO3 HRO3 H2RO4 HRO4
R(OH)3 H3RO4
Основания амфотерные к и с л о т ы
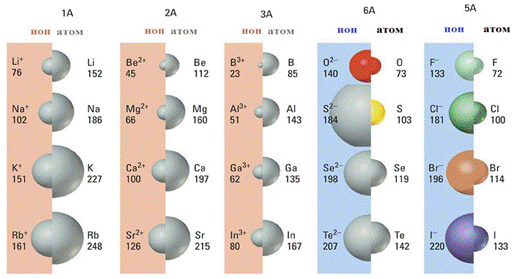
Вертикальное направление (верху вниз по группе):
Аr↑, заряд ядра ↑, Rат ↑, ↓ притяжение электронов к ядру, поэтому Ме свойства ↑, Нем свойства ↓, восстановительная способность ↑, окислительная способность ↓, высшая валентность в оксидах и гидроксидах равна номеру группы, основный характер соединений усиливается, кислотный ослабевает.
IV.Строение атома


Электронные и графические формулы
Электронная оболочка – совокупность всех электронов в атоме окружающих ядро.
От строения электронных оболочек атомов элементов зависят свойства образуемых ими веществ.
Каждый электрон имеет свою траекторию движения и запас энергии. Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки. По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее.
Самостоятельная работа.
1. Составьте схемы электронного строения атомов: Na, S, Br.
2. C помощью ПС определите химические элементы, если фрагменты их схем электронного строения:
а) +Х ))); б) +У )) в) +Z ))))
2 8 7 ? 2 ??? 3
2. Составление электронной формулы атома.
| Действия
| Теоретические знания
| Пример
|
| С помощью ПС:
1) составьте схему электронного строения атома;
| См. «1. Составление схемы электронного строения атома»;
| Fe (26e) 1(К) 2(L) 3(M) 4(N)
+26) ) ))
2 8 14 2
|
| 2) для всех уровней запиши обозначение составляющих их подуровней в порядке заполнения электронами
| порядок заполнения подуровней электронами (см. Рис1):
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p
|
1s2s2p3s3p4s3d4p
|
| 3) поочередно для каждого уровня запишите распределение электронов по подуровням (над значком подуровня пишем число, которое обозначает количество электронов, которые находятся на этой орбитали).
| максимальное число электронов на подуровнях:
s- 2, p- 6, d- 10, f –14
Число электронов не может превышать максимального значения на подуровне
|
1s2 2s 22p 63s23p64s2 3d6 4p0
|

Самостоятельная работа 2.
1.Составьте электронные формулы атомов: Сa, Sе, Аr.
P
2s
1s
| 3) распредели электроны по орбиталям
| Электроны на одном подуровне распределяются таким образом:
а) сначала каждый электрон заполняет орбиталь по одному;
б) потом электроны в пределах подуровня заполняют наполовину заполненные орбитали с неспаренным электроном.
| 2p
2s
1s
|
Самостоятельная работа 3. Для элементов с порядковыми номерами 3,8,15,29 изобразите схемы электронного строения, составьте электронные и электронно-графические формулы.
Проверь себя.
V. План характеристики химического элемента по положению в ПС Д.И.Менделеева
1. Положение элемента в ПС: порядковый номер,период, ряд, группа, подгруппа,относительная атомная масса.
2. Строение атома: заряд ядра атома,формула состава (количество протонов, нейтронов, электронов),
количество энергетических уровней и размещение электронов на них, электронная формула, электронно-графическая формула, число е на последнем слое
VI. Задание.
1. Составьте электронные формулы атомов элементов с порядковыми номерами
а) 12 и 23; б) 15 и 30; в) 17 и 25 с помощью символов и квантовых ячеек. Определите высшую и низшую степень окисления этих элементов.
2. Дайте характеристику химических элементов по положению в ПС Д.И.Менделеева с порядковыми номерами а) 11; б) 16; в) 35.
3. Какой элемент более активен (т.е. имеет большие металлические или неметаллические свойства) и почему
а) Mg или AL; P или As б) K или Ca; Br или I; в) Na или K; C или N?
3. Какое соединение более активно (т.е. имеет большие основные или кислотные свойства) и почему
а) KOH или Ca (OH)2; H 2 SiO 3 или H 2 CO 3 б) Mg (OH)2 или Ca (OH)2; H 3 PO 4 или H 2 SO 4; в) Ba (OH)2 или Ca (OH)2; HCLO 4 или H 2 SO 4?
Тест 1.
Задание1.1: Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Si 2) S 3) F 4) Zn 5) Ar
Задание 1.2: Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения их валентности в летучих водородных соединениях. 1) Cl 2) Sr 3) Se 4) P 5) K
Задание 1.3: Из указанных в ряду химических элементов выберите три элемента неметалла. Расположите выбранные элементы в порядке усиления окислительных свойств образованных ими простых веществ.
1) P 2) Al 3) Cl 4) Zn 5) H
Задание 2.5: 1) Mg 2) Cl 3) Al 4) Br 5) Ca
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И.Менделеева находятся в одном периоде. Расположите эти элементы в порядке уменьшения кислотных свойств их гидроксидов.
Задание 1.6: 1) Li 2) N 3) F 4) Rb 5) Cl
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И.Менделеева находятся в одном периоде. Расположите эти элементы в порядке возрастания кислотных свойств их водородных соединений.
Тренировочные задания 1:
1. Одинаковое число электронных слоев, содержащих электроны, имеют атомы элементов:
1) Al и S 2) N и Si 3) Li и Na 4) He и Ne
2. Пять электронов находятся во внешнем электронном слое атома
1) бора 2) стронция 3) фосфора 4) неона
3. На приведённом рисунке изображена модель атома химического элемента
1) 2-го периода VA группы 2) 3-го периода VIIA группы
3) 3-го периода VA группы
4) 2-го периода VIIA группы
4. Сколько электронов находится во внешнем электронном слое атома, в ядре которого 14 протонов?
1) 2 2) 4 3) 8 4) 14
5. Схема строения электронных оболочек соответствует атому химического элемента
1) 2-го периода VIIA группы 2) 5-го периода VIIA группы
3) 2-го периода VA группы 4) 5-го периода IIА группы
6. Распределению электронов в атоме химического элемента соответствует ряд чисел: 2, 8, 3. В Периодической системе Д. И. Менделеева этот элемент расположен
1) в 3-м периоде, IIIА группе 2) в 3-м периоде, IIA группе
3) во 2-м периоде, IIA группе 4) во 2-м периоде, IIIA группе
7. Заряд ядра атома химического элемента, расположенного во 2-м периоде, IVA группе равен: 1) +4 2) +12 3) +8 4) +6
8. Четыре электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) C, Si, Sn 2) O, Cl, I 3) N, C, S 4) Mg, Be, Ca
9. Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 6, образует высший оксид
1) SeO3 2) SO3 3) N2O3 4) P2O3
10. Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 4, образует водородное соединение:
1) CH4 2) NH3 3) SiH4 4) H2
Тренировочные задания 2:
1. В каком ряду химические элементы расположены в порядке усиления металлических свойств соответствующих им простых веществ?
1) кальций → калий → натрий 2) калий → натрий → литий
3) натрий → магний → алюминий 4) магний → кальций → барий
2. Неметаллические свойства у кремния выражены сильнее, чем у
1) углерода 2) азота 3) алюминия 4) фосфора
3. В каком ряду химические элементы расположены в порядке увеличения радиуса атома?
1) K → Na → Li 2) F → O → N 3) P → S → Cl 4) Ca → Mg → Be
4. От кислотных к основным меняются свойства оксидов в ряду
1) CaO → SiO2 → SO3 2) Na2O → MgO → Al2O3
3) CO2 → Al2O3 → MgO 4) SO3 → P2O5 → SiO2
5. Наиболее сильными основными свойствами обладает оксид
1) магния 2) бериллия 3) алюминия 4) натрия
6. Атомный радиус химических элементов уменьшается в ряду
1) Si → Al → Mg 2) Be → Al → C
3) As → P → N 4) F → Cl → Br
7. От основных к кислотным меняются свойства оксидов в ряду
1) N2O5 → P2O5 → As2O5 2) Li2O → Na2O → K2O
3) MgO → SiO2 → SO3 4) CO2 → B2O3 → Li2O
8. Металлические свойства магния выражены сильнее, чем металлические свойства 1) кальция 2) бериллия 3) калия 4) бария
9. Неметаллические свойства серы выражены сильнее, чем неметаллические свойства 1) селена 2) фтора 3) кислорода 4) хлора
10. Амфотерным является высший оксид каждого из химических элементов, имеющих в Периодической системе Д. И. Менделеева порядковые номера
1) 4, 13, 30 2) 6, 11, 16 3) 19, 12, 3 4) 6, 14, 17
Периодический закон и периодическая система Д.И. Менделеева






 1-й – 2 элемента
1-й – 2 элемента

 4-й – 18 элементов
4-й – 18 элементов






