Явления смачивания и растекания
Во многих технологических процессах играют большую роль явления, происходящие в контакте жидкости с поверхностью твердого тела.
От хорошего смачивания поверхностей твердого тела зависит, например, эффективность их очистки разными химическими реагентами.
Рассмотрим растекание капель на твердой поверхности, используя рисунок 5.2, а.

Рисунок 5.2.
Капля АВ жидкости 1 лежит на поверхностной границе PQ твердого тела 2 и фазы 3 (газа или другой жидкости). Поверхностное натяжение σ23 на границе 2-3 стремится растянуть каплю вдоль этой границы. Другое поверхностное натяжение σ12 капли на границе фаз 1-2 стремится, наоборот, стянуть каплю к ее центру. Поверхностное натяжение σ13 на третьей границе 1-3 направлено в точке В к поверхности капли по касательной под некоторым углом α с поверхностью PQ. Этот угол называется краевым углом.
На рисунке 5.2, а этот угол – острый. В этом случае проекция силы σ13 на плоскость PQ, равная σ13 cosα, по направлению совпадает с σ12. Поэтому действие этих сил складывается.
Отсюда условием равновесия капли на поверхности будет равенство сил:
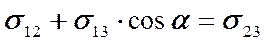 (5.4)
(5.4)
На рисунке 5.2, б изображена другая ситуация с тупым краевым углом. В этом случае слагаемое σ13 cosα является отрицательным.
В отсутствии равновесия равенство (5.4) не соблюдается, и отклонения от равенства могут быть в обе стороны.
Если σ23 больше суммы сил левой части равенства, то сила σ23 растягивает каплю во все стороны от центра. Капля уплощается, угол α уменьшается, а cosα увеличивается. Следовательно, увеличивается проекция силы σ13 на плоскость PQ. При таком увеличении может наступить момент, что левая часть равенства (5.4) сравняется с правой частью и растянутая капля окажется в равновесном состоянии.
Но может сложиться так, что даже при максимальном значении cosα =1 величина σ23 будет больше суммы, стоящей в левой части (5.4), т.е.
 (5.5)
(5.5)
Равновесия капли не будет, и она растекается в жидкую пленку на поверхности твердого тела. Этот случай можно наблюдать при растекании капли воды или спирта на стекле.
Если краевой угол острый, то считают, что жидкость смачивает твердое тело и, наоборот, при тупом краевом угле – жидкость его не смачивает. Известны еще понятия абсолютного смачивания (α = 0) и абсолютного несмачивания (α = 180о).
Хемосорбция
В случае действия сил химической природы между адсорбируемыми атомами и поверхностными атомами кристалла происходит химическая реакция между ними. Этим хемосорбция отличается от физической адсорбции. Связь между теми и другими атомами, как и во всяком химическом соединении, определяется ковалентными силами с некоторой долей ионности.
Отличие хемосорбции от физической адсорбции можно понять из рисунка 5.5, на котором изображены адсорбционные кривые, отражающие зависимость энергии W системы от расстояния r между поверхностью адсорбента и адсорбируемой частицей. (Здесь ΔHs – теплота адсорбции, а ro - равновесное расстояние).

Рисунок 5.5.
Кривая 1 с неглубоким минимумом на большом расстоянии от поверхности характеризует физическую адсорбцию. Кривая 2 с глубоким минимумом описывает более прочную хемосорбцию. Отсюда видна разница в теплотах адсорбции: хемосорбцию отличают значительно большие значения ΔHs по сравнению с физической адсорбцией.
Таким образом, обоим видам адсорбции соответствуют различные кривые W(r). Энергетический барьер, разделяющий два адсорбционных минимума, соответствует Wa в точке С пересечения кривых (рисунок 5.5). Следовательно, физически адсорбированная молекула, получившая энергию Wa, эквивалентную энергии в точке С, может перейти на кривую 2 и хемосорбироваться в виде атомов диссоциированной молекулы. Следует отметить, что любые факторы, смещающие или изменяющие кривые W(r) так, что точка С понижается, способствуют хемосорбции.
Поскольку в хемосорбции фигурируют силы, сходные с теми, что приводят к образованию обычных химических соединений, то очевидно, что в хемосорбции также определяющую роль должен играть обмен электронами между адсорбентом и адсорбатом. Поэтому в этом процессе главную роль играет электронная структура твердого тела.
Адсорбция из жидкой фазы
Во многих случаях, связанных с твердым телом, важны адсорбционные эффекты на поверхности кристалла, граничащего с жидким раствором. Так же, как и из газа, из жидкости на поверхность тела переходят молекулы, находящиеся в растворе. Между их концентрациями в растворе и на поверхности адсорбента устанавливается равновесие.
Вещества, адсорбируемые из раствора, называются поверхностно-активными (ПАВ). Их отличительная черта – высокая адсорбируемость – связана с сильным снижением поверхностного натяжения раствора на днной поверхности по сравнению с поверхностным натяжением чистого растворителя на той же поверхности.
Наоборот, вещества, повышающие поверхностное натяжение, относятся к инактивным. Они ухудшают адсорбцию раствора по сравнению с растворителем.
Избыток ПАВ в пограничном слое, примыкающем к твердотельной поверхности (поверхностную или межфазную концентрацию) обозначим Сгр. Эта величина показывает, насколько больше молей растворенного вещества содержит приграничный слой, чем слой равного объема внутри раствора:
 (5.10)
(5.10)
где S – площадь поверхности раздела твердой и жидкой фаз; n – число молей в растворе в объеме, равном объему приграничного слоя.
Адсорбция зависит от изменения свободной поверхностной энергии dγ c концентрацией С растворенного вещества в растворе. Для разбавленных растворов это изменение описывается уравнением Гиббса:

 (5.11)
(5.11)
Это уравнение показывает, что адсорбция или повышение Сгр будет происходить только при понижении межфазной энергии, т.е. при отрицательном знаке производной dγ/dC.
Понижение Δγ, обусловленное адсорбцией, описывается уравнением Шишковского:
 (5.12)
(5.12)
где γ0 – межфазная энергия на границе с чистым растворителем; γС – на границе с жидкой фазой, содержащей ПАВ в том же растворителе; С∞ - предельная адсорбция.
Константа b определяется:
 (5.13)
(5.13)
где V – молярный объем адсорбированных молекул в граничном слое; ΔHs – теплота адсорбции.
Из уравнения Шишковского следует, что понижение межфазной энергии тем больше, чем меньше молекулярный объем, предельная адсорбция и теплота адсорбции.
Общие представления о поверхности твердых тел
Поверхность твердого тела – это всегда граница раздела двух фаз (сред). Это может быть граница между твердым телом и газом, жидкостью или другим твердым телом.
Поэтому сама поверхность раздела взаимодействует с обеими фазами по обе стороны от границы. Таким образом, многие задачи, связанные с поверхностью, являются не двумерными, а трехмерными. Именно изучение явлений на поверхности представляет пример взаимопроникающего единства физического и химического подходов в материаловедении.
Для химиков поверхность – это место, на котором происходит явление адсорбции – прилипание посторонних молекул к границе твердого тела. На поверхности также протекают каталитические реакции, а катализ – процесс ускорения химических реакций без вступления в реакцию самого катализатора – широко используется во многих химических технологиях. Поэтому знание свойств поверхности и умение управлять ими имеют первостепенное значение. С поверхностными свойствами многих материалов (например, металлов) связано явление коррозии, приводящей к их разрушению.
Поэтому, процессы, происходящие на поверхности твердого тела чрезвычайно важны как для понимания сути различных физико-химических явлений, лежащих в основе технологии изготовления многих неметаллических материалов, так и для определения их основных физико-механических и эксплуатационных свойств.
Рассмотрим модельные представления о структуре поверхности и дадим определение ее характеристик. При этом следует иметь в виду, что реальные структуры поверхности и приповерхностного слоя чрезвычайно сложны и для каждого вида твердого тела имеется столько индивидуальных особенностей, что их изучение не завершено и вряд ли когда-нибудь завершится.
Однако хорошо установлены некоторые общие черты, которые характеризуют поверхность твердого тела.
Первая состоит в незавершенности химических связей у атомов, составляющих поверхность. Это означает, что поверхностные атомы основного кристалла ведут себя иначе, чем атомы, находящиеся в его объеме. Существование самой поверхности уже является нарушением внутреннего потенциального периодического поля в кристалле. Как и при всяком нарушении периодичности, в этом случае возникают локальные энергетические уровни – поверхностные состояния. Для них характерна локализация не только по энергии, но и в пространстве – они сосредоточены лишь на самой поверхности раздела твердого тела с другой фазой.
Плотность поверхностных уровней равна числу атомов на 1 см2 поверхности. Так как параметры кристаллических решеток равны примерно 3*10-8 см, то плотность поверхностных уровней составляет около 1015 см-2. Поверхностные уровни играют чрезвычайно важную роль при протекании различных физико-химических процессов на поверхности твердых тел, в частности, при спекании.
Поверхностные уровни играют важную роль в полупроводниках, когда объемные процессы, определяющие работу того или иного полупроводникового устройства, происходят в тонких поверхностных слоях порядка 10-6 см. В полупроводниках поверхностные уровни были исследованы И.Е. Таммом.
Таммовские уровни должны существовать на чистой поверхности. Однако в реальных условиях на поверхности твердого тела практически всегда присутствует оксидная пленка или слой адсорбированных атомов и ионов посторонних веществ. Оксидные и другие поверхностные пленки образуют некоторую промежуточную фазу, разделяющую твердое тело с собственно внешней фазой. В результате поверхностная область приобретает сложную многослойную структуру. В этом состоит вторая общая черта поверхности твердых тел.
Подобная многослойная структура не является плоской. Поверхность тела уже может быть сильно разветвленной из-за механической (шлифовка, полировка) и химической (травление) обработок поверхности. Кроме того, для поверхности характерна неоднородность химического состава и структуры по их толщине.
В подавляющем большинстве случаев «шуба», покрывающая поверхность твердого тела, имеет полупроводниковый (диэлектрический) характер со своими примесями и дефектами, образующими также локальные уровни. Эти уровни локализованы только в области слоя. Такие внешние поверхностные состояния отличаются от первых, внутренних, временем оклика на воздействие внешнего электрического поля. Внутренние собственные поверхностные состояния реагируют быстро, и поэтому их называют быстрыми состояниями. Внешние уровни получили название медленных состояний.
Количественной характеристикой поверхности является поверхностная s или межфазная энергия γ. Величину s называют также поверхностным натяжением и понимают ее как силу, которую надо приложить для увеличения поверхности в расчете на единицу длины линии, ограничивающей поверхность.
Для лучшего понимания этого определения используем рисунок 5.1.
Рисунок 5.1. Повышение энергии в области межфазной границы
Будем считать, что граница образована путем раскалывания кристалла на две части. При этом будут разорваны связи атомов (ионов, молекул), из которых построен кристалл. Внутри кристалла силовые поля, относящиеся к какому-либо из атомов, компенсируются полями окружающих атомов. Для атомов на образованной поверхности раздела такой компенсации уже нет и симметрия силовых взаимодействий нарушена. Поэтому на поверхности концентрируется затраченная энергия. Пусть F 1 и F 2 – энергии обеих частей кристалла без учета поверхностной энергии, тогда общая объемная энергия F 1 + F 2. С учетом поверхностной составляющей s D S, где D S – поверхность контакта:
 (5.1)
(5.1)
Следовательно,
 (5.2)
(5.2)
или
 (5.3)
(5.3)
Таким образом, D F является избыточной энергией поверхности раздела фаз. В общем случае величины s и γ определяются изменением свободной энергии, происходящим при увеличении поверхности раздела.
Так как D F >0, т.е. частицы на поверхности кристалла обладают большей энергией, чем атомы внутри кристалла, то поверхностную энергию кристалла можно определить как свободную энергию, которую необходимо затратить для создания поверхности.
Следует отметить, что идентичность величин s и γ только кажущаяся из-за одинаковой размерности. В действительности эти величины численно совпадают только для границ раздела «жидкость – газ» и «жидкость – жидкость». Для поверхностей раздела твердых тел разница между величинами s и γ может быть значительной.
Причина такого различия состоит в том, что в жидкости имеется лишь ближний порядок в расположении структурных элементов. Поэтому если на жидкость действуют усилия сдвига, то возникающие в ней напряжения снимаются перестройкой малых групп структурных элементов (атомов, молекул). В твердом же теле сдвиговые напряжения снимаются только перемещением составляющих атомов. Кроме того, в твердом теле присутствуют дислокации, перемещение которых также приводит к сдвигу. Поэтому в величину полной поверхностной энергии твердого тела вносит вклад еще и изменение энергии дислокаций.
Структура поверхности реального кристалла весьма сложна. Из изложенного выше следует, что под поверхностью понимают некоторый, пусть атомарно тонкий, но все же объемный слой. Толщины таких слоев могут достигать даже десятка периодов кристаллической решетки. Кроме того, поверхность реального кристалла обладает большим количеством разных дефектов. Поскольку поверхность контактирует с внешней средой, то существенную роль в формировании ее структуры играет кислород. Естественные оксидные слои толщиной 150-200 нм практически всегда присутствуют в поверхностных слоях твердых тел. Кроме них из-за явления адсорбции на поверхности и в приповерхностных слоях присутствуют посторонние примесные атомы. Следует отметить также характерную шероховатость поверхности в виде неоднородно чередующихся выступов и канавок рельефа. В результате поверхность твердого тела оказывается существенно неоднородной по своей структуре.
Дефекты структуры поверхности обусловливают разную энергию связи атомов с поверхностью. Это связано с тем, что количество соседей, с которыми атом взаимодействует в разных местах поверхности различно. Сложная структура поверхности определяет и многие отличия ее свойств от свойств в объеме твердого тела.




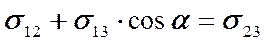 (5.4)
(5.4) (5.5)
(5.5)
 (5.10)
(5.10)
 (5.11)
(5.11) (5.12)
(5.12) (5.13)
(5.13)
 (5.1)
(5.1) (5.2)
(5.2) (5.3)
(5.3)


