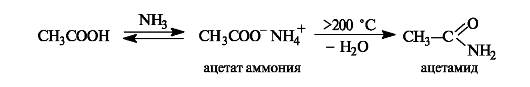Химические свойства карбоновых кислот обусловлены прежде всего карбоксильной группой, которая в отличие от изученных ранее функциональных групп (спиртовой, карбонильной) имеет более сложное строение. Внутри самой группы имеется р,л-сопряжение в результате взаимодействия р-орбитали атома кислорода группы ОН с π-связью группы С=О (см. также 2.3.1).

Карбонильная группа по отношению к группе ОН выступает в роли электроноакцептора, а гидроксильная группа за счет +М-эффек- та - в роли электронодонора, подающего электронную плотность на карбонильную группу. Особенности электронного строения карбоновых кислот обусловливают существование нескольких реакционных центров (схема 6.1):
• ОН-кислотный центр, обусловленный сильной поляризацией связи О-Н;
• электрофильный центр - атом углерода карбоксильной группы;
• n- основный центр - атом кислорода карбонильной группы с неподеленной парой электронов;
• слабый СН-кислотный центр, проявляющийся только в производных кислот, так как в самих кислотах имеется несравненно более сильный ОН-кислотный центр.
Схема 6.1. Реакционные центры в молекуле карбоновых кислот

Кислотные свойства
Кислотные свойства карбоновых кислот проявляются в их способности отщеплять протон. Повышенная подвижность водорода обусловлена полярностью связи О-Н за счет р,п -сопряжения (см. схему 6.1). Сила карбоновых кислот зависит от стабильности карбоксилат-иона RCOO, образующегося в результате отрыва протона. В свою очередь, стабильность аниона определяется прежде всего степенью делокализации в нем отрицательного заряда: чем лучше делокализован заряд в анионе, тем он стабильнее (см. 4.2.1). В карбоксилат-ионе заряд делокализуется по р,π-сопряженной системе с участием двух атомов кислорода и распределен поровну между ними
(см. 2.3.1).

Для карбоновых кислот значения рла лежат в интервале 4,2-4,9. Эти кислоты обладают существенно более высокой кислотностью, чем спирты (рКа 16-18), фенолы (рКа ~10) и тиолы (рКа 11-12) (см. табл. 4.5).
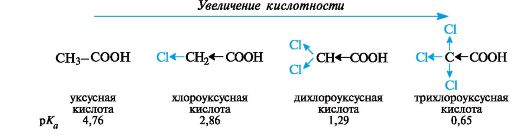
Длина и разветвленность насыщенного алкильного радикала не оказывает существенного влияния на кислотные свойства карбоновых кислот. В целом алифатические монокарбоновые кислоты обладают практически одинаковой кислотностью (pKa 4,8-5,0), за исключением муравьиной кислоты, у которой кислотность на порядок выше.
Объяснить более высокую кислотность муравьиной кислоты можно с привлечением еще одного фактора, влияющего на стабильность аниона, а именно сольвата- ции. В водной среде заряд в небольшом по размеру формиат-ионе НСОО лучше делокализован с участием полярных молекул растворителя, чем в более крупных карбоксилат-ионах.
Надо отметить, что ароматические кислоты незначительно превышают алифатические по кислотности (pKa бензойной кислоты 4,2). В делокализации заряда в бензоат-ионе бензольное кольцо выступает как слабый электроноакцептор, не принимая участия в сопряжении с электронами, обусловливающими отрицательный заряд.
На кислотность карбоновых кислот значительно влияют заместители, введенные в углеводородный радикал. Независимо от механизма

передачи электронного влияния заместителя в радикале (индуктивного или мезомерного), электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анионы и тем самым увеличивают кислотность. Электронодонорные заместители, напротив, ее понижают.
В водных растворах карбоновые кислоты слабо диссоциированы.
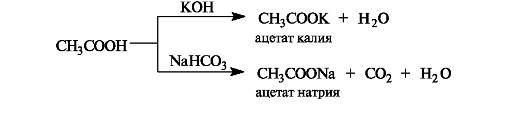
Кислотные свойства проявляются при взаимодействии карбоновых кислот со щелочами, карбонатами и гидрокарбонатами. Образующиеся при этом соли в заметной степени гидролизованы, поэтому их растворы имеют щелочную реакцию.
Нуклеофильное замещение
Нуклеофильное замещение у sp2-гибридизованного атома углерода карбоксильной группы представляет наиболее важную группу реакций карбоновых кислот.
Атом углерода карбоксильной группы несет частичный положительный заряд, т. е. является электрофильным центром (см. схему 6.1). Он может быть атакован нуклеофильными реагентами, в результате чего происходит замещение группы ОН на другую нуклеофильную частицу.
Гидроксид-ион является плохой уходящей группой, поэтому реакции нуклеофильного замещения в карбоксильной группе проводятся в присутствии кислотных катализаторов, особенно когда используются слабые нуклеофильные реагенты, такие, как спирты.
Наиболее важные реакции монокарбоновых кислот приведены на схеме 6.2.
Схема 6.2. Некоторые реакции нуклеофильного замещения в карбоновых кислотах
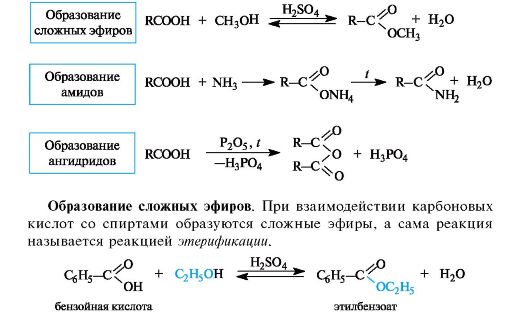
Реакция этерификации катализируется сильными кислотами.
Механизм реакции этерификации. Каталитическое действие серной кислоты состоит в том, что она активирует молекулу карбоновой кислоты, которая протонируется по основному центру - атому кислорода карбонильной группы (см. схему 6.1). Протонирование приводит к увеличению электрофильности атома углерода. Мезомерные структуры показывают делокализацию положительного заряда в об- разовавшемся катионе (I).
Далее молекула спирта за счет неподеленной пары электронов атома кислорода присоединяется к активированной молекуле кис- лоты. Последующая миграция протона приводит к формированию хорошей уходящей группы - молекулы воды. На последней стадии отщепляется молекула воды с одновременным выбросом протона (возврат катализатора).

Этерификация - обратимая реакция. Смещение равновесия вправо возможно отгонкой из реакционной смеси образующегося эфира, отгонкой или связыванием воды, либо использованием избытка одного из реагентов. Реакция, обратная этерификации, приводит к гидролизу сложного эфира с образованием карбоновой кислоты и спирта.
Образование амидов. При действии на карбоновые кислоты аммиака (газообразного или в растворе) непосредственно замещения группы ОН не происходит, а образуется аммониевая соль. Лишь при значительном нагревании сухие аммониевые соли теряют воду и превращаются в амиды.
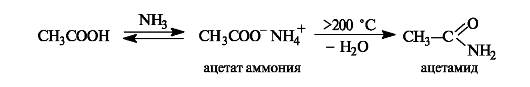
Образование ангидридов кислот. Нагревание карбоновых кислот с оксидом фосфора(V) приводит к образованию ангидридов кислот.