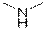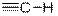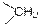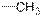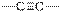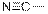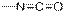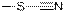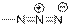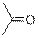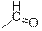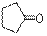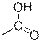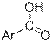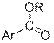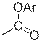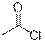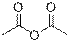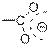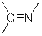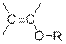Самым простым результатом ионизации является удаление одного электрона из молекулы под действием потока электронов из молекулы в газовой фазе с образованием молекулярного иона, который является катион-радикалом.

Таким образом, зная молекулярный ион можно установить молекулярную массу вещества.
Менее вероятным результатом ионизации электронным ударом является присоединение электрона и образование анион-радикала.

При ионизации молекул электронным ударом образуется несколько типов ионов.
1. Молекулярный ион – м олекула с положительным зарядом, полученным за счет отрыва одного электрона. Относительная интенсивность пика молекулярного иона связана с его стабильностью, которая, в свою очередь, зависит от структуры молекулы.
2. Основной или максимальный ион – ион, интенсивность которого в спектре максимальна. Основной ион представляет собой наиболее стабильный ион в масс-спектре, а его масса представляет существенную ценность для идентификации. Этот ион может быть молекулярным или фрагментным.
3. Фрагментный ион образуется при простом разрыве связей в молекуле исследуемого соединения.
4. Перегруппировочный ион образуется при разрыве связей с одновременной миграцией атомов.
5. Двухзарядный ион – ион, имеющий двойной положительный заряд за счет потери двух электронов. Регистрируются как ионы с массой, в два раза меньшей, чем ожидаемая. Двухзарядные ионы также информативны, так как они образуются при ионизации определенных классов органических соединений. Соединения с большой молекулярной массой и тяжелые ароматические соединения образуют многочисленные двухзарядные ионы.
6. Метастабильный ион. Ион, с массой m 1, попадающий на коллектор, будет зарегистрирован с той же массой. Если этот ион превратится в ион m 2 не в камере, а на пути следования в коллектор, то он уже не будет зарегистрирован ни как m 1, ни как m 2, так как он отличается по скорости движения от этих ионов. Большинство этих ионов рассеивается и составляет фон масс-спектра, и только те из них, которые образовались в узком пространстве перед входом в магнитный анализатор, имеют достаточную интенсивность для регистрации с кажущейся массой m *=(m 2)2/ m 1. Это и есть метастабильные ионы, которые отличаются уширенными пиками низкой интенсивности и часто нецелочисленным значением m / е.
Масс-спектры представляют собой линейчатый график, в котором распространенность всех ионов выражена в процентах от наиболее интенсивного сигнала (рис. 2).

Рис. 2. Масс-спектр электронного удара о -метилфенола (С7Н8О, Мм 108)
Одной из важных задач масс-спектрометрии является определение молекулярной массы исследуемого вещества. Пик молекулярного иона является пиком с наибольшим массовым числом, за исключением пиков изотопных ионов.
Кроме величины молекулярной массы вещества, молекулярный ион обеспечивает некоторой дополнительной информацией. Так, «азотное правило» устанавливает, что молекула с четным молекулярным весом либо не должна содержать атомы азота, либо число атомов азота должно быть четным. Нечетная молекулярная масса говорит о том, что в молекуле имеется нечетное количество атомов азота.
Следует отметить, что обычные масс-спектрометры определяют молекулярную массу с точностью до единиц. Однако времяпролетные масс-спектрометры и масс-спектрометры с двойной фокусировкой позволяют определить молекулярную массу с точностью до ± 0.00001 массовой единицы (масс-спектры высокого разрешения). Поскольку масса атомов каждого элемента известна с высокой точностью, то молекулы, которые имеют одинаковую массу при точности измерения до единиц массы, могут различаться при измерении с такой высокой точностью. В этом случае ограниченные комбинации атомов разных элементов будут соответствовать величине молекулярного (фрагментного) иона. Этот факт позволяет точно установить молекулярную формулу исследуемого соединения.
Таблица 2.
Точные массы некоторых изотопов
| Изотоп
| Природное содержание
| Масса
|
| 1Н
| 99,98
| 1,00783
|
| 12С
| 98,9
| 12,0000
|
| 13С
| 1,1
| 13,00336
|
| 14N
| 99,6
| 14,0031
|
| 16O
| 99,8
| 15,9949
|
| 19F
| 100,0
| 18,99840
|
| 31P
| 100.0
| 30,97376
|
| 32S
| 95.0
| 31,9721
|
| 33S
| 0,75
| 32,9715
|
| 34S
| 4,2
| 33,9679
|
| 35Cl
| 75,8
| 34,9689
|
| 37Cl
| 24,2
| 36,9659
|
| 79Br
| 50,7
| 78,9183
|
| 81Br
| 49,3
| 80,9163
|
Некоторые элементы имеют несколько природных изотопов. Присутствие таких изотопов в исследуемом веществе приводит к появлению дополнительных пиков рядом с пиком молекулярного иона. Важно, что интенсивность пиков [M] .+, [M+1] .+, [M+2] .+ определяется природным содержанием разных изотопов одного и того же элемента и количеством атомов одного вида, входящих в состав молекулы исследуемого вещества. Поэтому по соотношению интенсивностей пиков изотопных ионов и молекулярного иона можно определить количество атомов данного типа, которое присутствует в молекуле.
Основные элементы, входящие в органические соединения, с точки зрения их изотопного состава, можно разделить на три группы.
1. Элементы, имеющие низкий процент содержания тяжелых изотопов, но число их атомов в молекуле велико: 1H; 13C, 14N, 16O.
2. Элементы, имеющие высокий процент содержания тяжелых изотопов, но число их атомов в молекуле, как правило, невелико: Cl(35Cl, 37Cl), Br (79Br, 91Br)
3. Моноизотопные элементы; 19F, 31P, 127I.
Таблица 3.
Относительное содержание изотопов распространенных элементов
| Элемент
| Изотоп
| Относительное содержание
|
| Водород
| 1Н
| 100
|
| 2Н
| 0,016
|
| Углерод
| 12С
| 100
|
| 13С
| 0,11
|
| Азот
| 14N
| 100
|
| 15N
| 0,38
|
| Кислород
| 16O
| 100
|
| 17O
| 0,04
|
| 18O
| 0,2
|
| Фтор
| 19F
| 100
|
| Кремний
| 28Si
| 100
|
| 29Si
| 5,1
|
| 30Si
| 3,35
|
| Фосфор
| 31P
| 100
|
| Сера
| 32S
| 100
|
| 33S
| 0,78
|
| 34S
| 4,4
|
| Хлор
| 35Cl
| 100
|
| 37Cl
| 32,5
|
| Бром
| 79Br
| 100
|
| 81Br
| 98
|
Таким образом, молекулярные ионы соединений, имеющих большое число атомов C, H, N, O дают фактически два пика за счет вклада основных изотопов и изотопов, имеющих на 1 единицу большую массу (в основном от 13С). Для элементов, имеющих более тяжелые изотопы, появляются пики [M+2] .+, [M+4] .+ и т. д.
Определение структуры органического соединения основывается на изучении пиков фрагментных ионов. В принципе возможен разрыв любой связи в молекулярном ионе, но вероятность разрыва и, следовательно, интенсивность пика соответствующего осколочного иона будут зависеть от энергии связей.
Вероятность разрыва данной связи обусловлена прочностью связи, вероятностью переходов с низкой энергией и стабильностью как заряженных частиц, так и незаряженных осколков, образовавшихся в процессе фрагментации. Например, разрыв одинарных связей происходит быстрее, чем разрыв кратных, связи С–С разрываются легче, чем С–Н, и т. д. Относительная интенсивность пика соответствующего осколочного иона зависит от его собственной устойчивости, от стабильности образующегося одновременно с ним радикала или нейтральной частицы. Таким образом, основные пути фрагментации определяются характером связей в молекуле и стабильностью образующихся частиц.
Детальную интерпретацию масс-спектров можно провести, используя некоторые надежно установленные механизмы и правила фрагментации. В некоторых случаях интерпретация масс-спектра позволяет однозначно идентифицировать молекулы исследуемого соединения. В других она обеспечивает только частичное решение задачи идентификации, и в этом случае необходимо использовать другие методы, дополняющие полученную информацию.
4.2. Спектроскопические методы исследования
структуры органических соединений
Среди многообразных физических методов, которые применяются при исследовании строения органических молекул, наибольшую информацию можно получить при изучении взаимодействия вещества с электромагнитным излучением в широком интервале частот начиная с радиоволн и кончая g-лучами, т. е. по всему электромагнитному спектру. При этом происходит изменение энергии молекул, которое определяется уравнением 1:
D Е = Е к – Е н = h n, (1)
где D Е – изменение энергии системы;
Е к и Е н – энергии системы в конечном и начальном состоянии;
h – постоянная Планка;
n – частота излучения.
Если энергия конечного состояния выше энергии начального состояния, происходит поглощение энергии и наоборот. Первый случай соответствует спектрам поглощения, второй – спектрам излучения.
Электромагнитное излучение может быть охарактеризовано волновыми и энергетическими параметрами. Волновой параметр выражается длиной волны l (Ả, нм(ммк), мкм, см, м) или частотой колебания n (с-1), которые связаны между собой соотношением l = с /n. Часто употребляют такую характеристику как волновое число, также называемое частотой n =1/l.
Таблица 4.
Характеристики электромагнитного спектра
| Тип излучения
| l, см
| Е, эВ
| Процессы, происходящие при поглощении или излучении
|
| g-лучи
| 10-11–10-8
| 107
| Изменения в энергетическом состоянии ядер (спектроскопия g–резонанса)
|
| Рентгеновские лучи
| 10-8–10-6
| 105
| Изменения в энергетическом состоянии внутренних электронов атомов (рентгеноспектроскопия)
|
| Ультрафиолетовое и видимое излучение
| 10-6–10-4
| 10
| Изменения в энергетическом состоянии внешних электронов (электронные спектры)
|
| Инфракрасное
| 10-4–10-2
| Доли эВ
| Колебания атомов в молекуле (колебательные спектры)
|
| Микроволновое
| 10-1–10
| 10-3
| Колебание атомов в кристаллической решетке; изменения вращательного энергетического состояния
|
| Радиоволны
| >100
| 10-6
| Изменения энергетического состояния спинов ядер и электронов (спектроскопия ЯМР, ЯКР, ЭПР)
|
В настоящее время при исследовании органических соединений широко применяются спектры поглощения в ультрафиолетовой, видимой, инфракрасной областях и cпектроскопия ядерного магнитного резонанса.
ИК-спектроскопия
Инфракрасное излучение относится к той части электромагнитного спектра, которая находится между видимой и микроволновой областями. Среди химиков-органиков наибольшее применение нашла только ограниченная его часть между 4000 и
650 см-1.
Следует отметить, что даже простые молекулы могут дать чрезвычайно сложный спектр. Исследователи пользуются этим, когда сравнивают спектр неизвестного вещества со спектром заведомо известного образца. Совпадение всех полос является доказательством идентичности. Никакие два соединения, за исключением оптических изомеров, не могут дать одинаковые ИК-спектры.
ИК-излучение с частотой менее 100 см-1 поглощается и преобразуется молекулой в энергию вращения. Поглощение квантовано, и, таким образом, вращательный спектр молекул состоит из дискретных линий.
ИК-излучение в интервале 10000 ‒100 см-1 при поглощении преобразуется органической молекулой в энергию колебания. Это поглощение также квантовано, но колебательный спектр состоит не из линий, а из полос, поскольку каждое изменение колебательной энергии сопровождается изменениями многочисленных состояний вращательной энергии.
Частота, при которой наблюдается полоса поглощения (ν), зависит от относительных масс атомов, силовых постоянных атомов и геометрии молекулы (уравнение 2).
ν = ½ π с √ k / μ, (2)
где k ‒ силовая постоянная связи
μ ‒ приведенная масса μ = m1 m2 / (m1+ m2)
Следует отметить, что в ИК-спектрах проявляются только те колебания, которые происходят с изменением дипольного момента. Колебания симметричных связей в ИК-спектре не проявляются.
Инфракрасные спектры можно измерить для газообразных, жидких и твердых соединений. Для измерения спектров газообразных соединений используют специальные газовые кюветы. Жидкие соединения наносят в виде пленки на пластинки из материала, прозрачного в исследуемой области (например, KBr, NaCl, CsI, KCl). Из твердых веществ приготовляют суспензию в вазелиновом масле, которую помещают между солевыми пластинками. Нужно иметь в виду при этом, что само вазелиновое масло поглощает при 3000‒2800 см-1 , 1460 и 1380 см-1.
Можно получить спектры твердых веществ, запрессовывая их с бромистым калием и снимая спектр полученной пластинки. ИК-спектры могут быть измерены и для растворов веществ. Поскольку не имеется растворителей, прозрачных для всей области спектра, то обычно регистрация ИК-спектра растворов делается только для узких областей.
Хотя ИК-спектр является характеристикой всей молекулы, оказывается, что некоторые группы атомов поглощают при определенной частоте или вблизи нее независимо от структуры остальной части молекулы. Эти полосы, которые называют характеристическими, настолько постоянны, что по ним можно судить о структурных элементах молекулы. Характеристическими являются колебания групп, содержащих легкий атом водорода (С–Н, О–Н, N–H) и колебания групп с кратными связями.
Различают два типа молекулярных колебаний: валентные и деформационные.
Валентное колебание – это ритмичное движение вдоль оси связи, при этом межатомное расстояние увеличивается и уменьшается.
Деформационные колебания вызывают изменение угла, образованного связями около общего атома, или движение группы атомов по отношению к остальной части молекулы без смещения атомов по отношению друг к другу внутри этой группы. Примером деформационных колебаний могут быть крутильные (twisting), маятниковые (rocking), и торсионные (torsional) колебания
При записи ИК-спектров поглощения параметром длины волны (λ) являются микроны (мкм) или частоты (ν) в см-1. Интенсивность поглощения выражается в процентах поглощения (рис. 3).
Наиболее важные и надежно интерпретируемые характеристические полосы поглощения располагаются в коротковолновой (высокочастотной) области частот колебаний молекул от 4000 до 1500 см-1. Длинноволновая часть инфракрасного спектра (<1500 cм-1) гораздо более сложна и содержит наряду с характеристическими полосами большое число интенсивных полос поглощения, положение и форма которых индивидуальны для каждой сложной молекулы. Поэтому эту часть спектра называют «областью отпечатков пальцев».
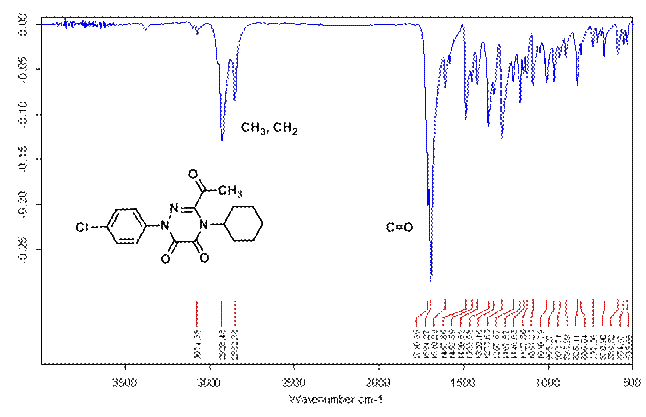
Рис. 3. ИК-спектр 1,2,4-триазин-5,6(1 H,4 H)-диона
Таблица 5.
Полосы поглощения важнейщих функциональных групп и связей в ИК-спектре
| Функциональная группа
| Структура
| ν, см-1
| Интенсивность
|
| OH (неассоциированная)
| –OH
| 3600
| сильная
|
| ОН (водородная связь)
| –
| 3550–3200
| средняя
|
| Аминогруппа
| 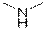
| 3300–3500
| –
|
| Ацетилены (концевая)
| 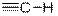
| 3300
| сильная
|
| Ароматические связи С-Н
|
| 3020
| средняя
|
| Метиленовые связи С-Н
| 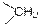
| 2850–2960
| –
|
| Метильные связи С-Н
| 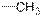
|
| –
|
|
|
|
| –
|
| Алкины
| 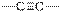
| 2100–2300
| слабая или средняя
|
| Нитрилы
| 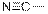
| 2215–2260
| средняя
|
| Цианаты
|
| 2270
| сильная
|
| Изоцианаты
| 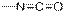
| 2200–2300
| сильная
|
| Тиоцианаты
| 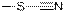
| 2150
| сильная
|
| Аллены
| 
| 1950
| сильная
|
| Изонитрилы
|
| 2120–2185
| сильная
|
| Азиды
| 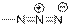
| 2120–2160
| –
|
| диазогрупа
| 
| 2100–2330
| сильная
|
| Кетоны
| 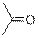
| 1700–1725
| –
|
| Альдегиды
| 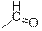
| 1720–1740
| –
|
| Ароматические альдегиды или кетоны
| 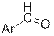
| 1660–1715
| –
|
| Циклопентаноны
| 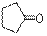
| 1740–1750
| –
|
| Карбоновые кислоты
| 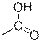
| 1700–1725
| –
|
| Ароматические кислоты
| 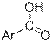
| 1680–1715
| –
|
| Сложные эфиры
| 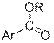
| 1735–1750
| –
|
| Фенольные эфиры
| 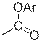
| 1760–1800
| –
|
| Ароматические эфиры
| 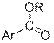
| 1715–1730
| –
|
| Амиды
| 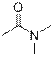
| 1630–1690
| –
|
| Хлорангидриды
| 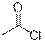
| 1785–1815
| –
|
| Ангидриды (две полосы)
| 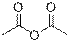
| 1740–1850
| –
|
| Карбоксилаты
| 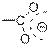
| 1550–1610
1300–1450
| –
|
| Имины
| 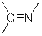
| 1480–1690
| –
|
| Енольные эфиры
| 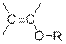
| 1600–1660
| сильная
|
| Алкены
| 
| 1640–1680
| от слабой до сильной
|
| Нитрогруппа
| 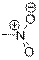
| 1500–1650
1250–1400
| сильная
сильнаяя
|
| Эфиры
| 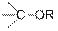
| 1085–1150
| сильная
|
| Алкилфториды
|
| 1000–1400
| сильная
|
| Алкилхлориды
|
| 580–780
| сильная
|
| Алкилбромиды
|
| 560–800
| сильная
|