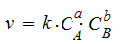Любое химическое взаимодействие можно, как и всякий другой процесс, характеризовать скоростью. Скорость химической реакции (v) определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема (для гомогенной реакции –уравнение (4) или на единице поверхности раздела фаз (для гетерогенной системы – уравнение (5).
V гомог= n/(V t), (4)
V гетер= n/(S t) (5)
где n – число молей данного компонента;
V – объем; S – площадь; t – время.
Необходимым условием химического взаимодействия различных веществ является столкновение молекул. Очевидно, что скорость химического взаимодействия должна определяться числом столкновений различных молекул в единицу времени. Вероятность столкновения молекул различных веществ друг с другом пропорциональна концентрации этих веществ, поэтому скорость реакции должна быть пропорциональна концентрациям реагирующих веществ [1].
Если в ходе реакции объем постоянен во времени, то скорость определяется по формуле:
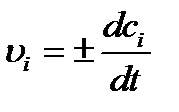 ,
,
где c i = ni / V – концентрация в единице объема, моль/л.
Различают среднюю и истинную скорости химической реакции.
Средняя скорость – изменение концентрации реагирующих веществ в единицу времени:
v =- Δc /Δ t (6)
Истинная скорость:
 , (7)
, (7)
т.е. vi = - dc i /dt. где с i - концентрация вещества (обычно в моль/л).
Скорость реакции всегда положительна и зависит прежде всего от концентрации реагирующих веществ. Если измерять скорость по продуктам реакции, то она представит собой увеличение концентрации этих веществ в единицу времени. Концентрация исходных веществ при протекании реакции уменьшается во времени и поэтому в выражениях (6, 7) ставят знак (-).
Истинная скорость реакции v представляет собой тангенс угла наклона, образованного осью времени и касательной, проведенной к кривой изменения концентрации, в данный момент времени.
Скорость химической реакции зависит от следующих факторов: природы реагирующих веществ, температуры, присутствия катализатора или ингибитора и их концентра ц ии (для гомогенного катализа), для реакций в растворах – от природы растворителя, для фотохимических реакций – от энергии квантов света, для электрохимических реакций – от потенциала электрода [1,3].
Уравнения, выражающие связь между скоростью реакции и концентрациями реагирующих веществ, называются кинетическими.
Скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ с учетом их стехиометрических коэффициентов. Если реакция протекает по уравнению:
аА + bB→ dD,
где a, b, d – стехиометрические коэффициенты, то скорость химической реакции может быть выражена кинетическим уравнением (8):
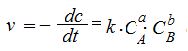 (8)
(8)
Данное уравнение выполняется для простых реакций, протекающих в одну стадию. Коэффициент пропорциональности k называется константой скорости химической реакции. Константа k характеризует скорость химической реакции при концентрациях реагирующих веществ, равных единице: k = υ при с А = с B = 1.
Константа скорости реакции химической реакции зависит от тех же факторов, что и скорость реакции (за исключением концентрации). Численное значение константы скорости зависит от выбора единиц времени и концентрации, а ее размерность определяется порядком реакции (см. ниже).
Различаются кинетически необратимые и обратимые реакции. Необратимые (односторонние) реакции фактически могут проходить только в одном направлении, вне зависимости от внешних условий. К типичным необратимым реакциям относятся реакции, протекающие со взрывом, с образованием осадков, трудно растворимых веществ и газов, например:
2KCIO3→2KCI + 3O2↑.
Обратимые (двусторонние) реакции проходят с конечной скоростью как в прямом, так и в обратном направлениях. Общая скорость реакции будет определяться как разность скоростей прямой и обратной реакции. Например, для реакции в газовой фазе:
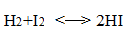
v=v(→) – v(←)= k(→)CH2 . CI2 - k(←)C2HI
Когда скорость прямой реакции становится равной скорости обратной v (→) = v (←), общая скорость равна 0(v =0), наступает равновесие:
k (→) C равн. H 2 . C равн. I 2 = k (←) (C 2 HI)равн.
или
 ,
,
где Кс – константа равновесия.
Молекулярность реакции - это наименьшее число частиц, принимающее участие в элементарном акте реакции. Число молекул образующихся веществ не имеет значения. Для простой реакции аА + bB → dD кинетическое уравнение имеет вид:
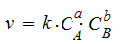
В этом случае показатели степени при концентрациях в кинетическом уравнении совпадают со стехиометрическими коэффициентами, и их сумма будет определять молекулярность реакции, т.е. a + b. Молекулярность реакции всегда целое число. Различают реакции:
- мономолекулярные (например, CH3COCH3→CO2 + C2H4 + H2);
- бимолекулярные (например, H2 + I2 → 2HI);
- тримолекулярные (редко, поскольку вероятность одновременного столкновения трех молекул мала): 2NO + Cl2→2NOCl.
Если реакция сложная (протекает через нескольких элементарных стадий), то установление молекулярности необходимо для каждой элементарной стадии. В большинстве случаев показатели степеней при концентрациях в кинетическом уравнении не совпадают со стехиометрическими коэффициентами реакций.
Сумма показателей степеней при концентрациях в кинетическом уравнении называется порядком реакции.
Различают общий (суммарный) порядок реакции (n a + n b)= n и частные порядки (n a - порядок реакции по веществу А и n b – порядок реакции по веществу В). Если порядок равен единице, то реакция называется реакцией первого порядка, если двум – второго порядка, если трем – третьего порядка.
Порядок реакции, как и константа скорости, являются важнейшими характеристиками реакции. В зависимости от порядка реакции кинетическое уравнение для расчета константы скорости реакции различны. Порядок реакции является чисто эмпирической величиной и определяется экспериментально. Только для простой реакции, протекающей в один элементарный акт, порядок совпадает с молекулярностью, так как стехиометрическое уравнение правильно отражает истинный механизм такой реакции.
Константы скорости реакций вычисляют из опытных данных с помощью кинетических уравнений.



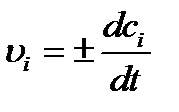 ,
,  , (7)
, (7)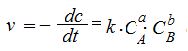 (8)
(8)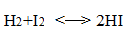
 ,
,