Направление протекания самопроизвольного процесса можно определить на основе второго закона или начала термодинамики, сформулированного, например, в виде постулата Клаузиуса:
Теплота сама собой не может переходить от холодного тела к горячему, т. е. невозможен такой процесс, единственным резуль татом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Клаузиусом была введена функция состояния S, названная энтропией, изменение которой равно теплоте обратимого процесса, отнесенной к температуре:
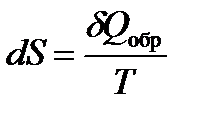 ,
,
где S – энтропи я, Дж/моль·К; Q обр. - теплота обратимого процесса; Т – температура, К.
Для любого процесса:
Энтропия (S) характеризует тенденцию к росту беспорядка реакционной системы на молекулярном уровне. Энтропию относят к 1 моль вещества, обозначают символом S, а в стандартных условиях — S°.
Поскольку энтропия есть функция состояния, то её изменение ∆ S, сопровождающее химическую реакцию, можно рассчитать аналогично изменению энтальпии. Для химической реакции в стандартных условиях
∆ S 0298 (реакции) = ∑ (n'S 0298)прод. − ∑ (n''S 0298)исх. ,
где n', n'' – соответствующие стехиометрические коэффициенты в уравнении реакции.
Энтропия является возрастающей функцией температуры, причем особенно резко, скачкообразно она изменяется при температурах фазовых переходов. Изменение энтропии (∆ Si) при фазовых превращениях (плавление ↔ кристаллизация – D m H; испарение ↔ конденсация – D v H; полиморфные превращения кристаллов) можно рассчитать:
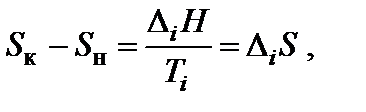
где D i H и Ti – соответственно энтальпия и температура фазового перехода.
Вообще для любого обратимого процесса при постоянных р, T, когда известна величина ∆ H, изменение энтропии
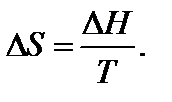
Температура является характеристикой (мерой) теплового движения молекул и атомов. Поэтому с ростом температуры растет интенсивность движения частиц и соответственно уменьшается упорядоченность системы, следовательно, возрастает энтропия:
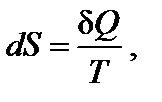
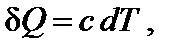
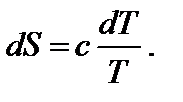
При нагревании в изобарных условиях (р = const) изменение энтропии (если есть фазовые переходы)
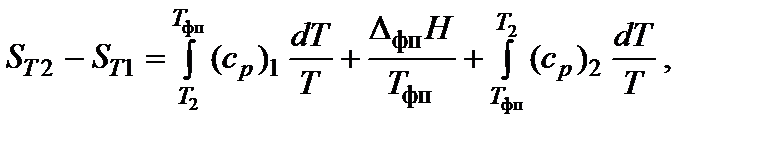
где Т 1 и Т 2 – температурный интервал, Т фп – температура фазового перехода, D H фп– энтальпия фазового перехода, (ср) i – изобарная теплоемкость соответствующей фазы.
В соответствии с первым и вторым началами термодинамики для обратимого процесса:
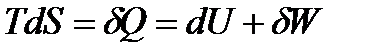 max,
max,
где 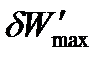 - максимальная полезная работа обратимого процесса, которая включает все виды работ, кроме работы расширения газа.
- максимальная полезная работа обратимого процесса, которая включает все виды работ, кроме работы расширения газа.
Если продифференцировать это выражение и обозначить (H – TS) как G, то получим:
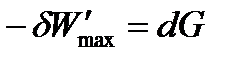
Максимальная полезная работа в изобарно-изотермических условиях равна изменению термодинамической функции, которая получила название свободная энергия Гиббса (изобарно-изотермический потен циал)и условно обозначается буквой G. Изменение энергии Гиббса представляет собой ту часть полной энергии системы, которую в принципе можно превратить в максимальную полезную работу и является суммарной движущей силой процесса в изобарно-изотермических условиях.
Для конечного процесса:
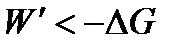
В общем случае (для любой температуры):
ΔG0Т = ΔН0Т – Т . Δ S 0 Т, кДж (Дж) (3)
Выражение (3) является математическим выражением второго начала термодинамики. Из него следует, что теплота процесса (Δ H) может быть лишь частично превращена в работу, которую характеризует свободная энергия Гиббса (Δ G). Функция T Δ S – тепло, которое не может быть превращено в работу, TΔS называется связанной энергией.
Стандартные энергии Гиббса ΔG0298, энтальпии образования ΔH0f,298 и ΔS0298 приводятся справочниках физико-химических величин. В этих таблицах ΔH0f,298 и ΔG0f,298 простых веществ в стандартном состоянии условно принимаются равными нулю.
Движущей силой химической реакции является изменение энергии Гиббса. Изменение энергии Гиббса и Гельмгольца служит критерием направления самопроизвольного процесса в закрытых системах. В табл.3 приведено влияние температуры на самопроизвольное протекание реакции.
Таблица 3
Влияние изменения ΔH и ΔS при Т на протекание реакции
| ΔHТ
| ΔSТ
| ΔGТ
| Протекание реакции
|
| < 0
| > 0
| Всегда < 0
| Реакция самопроизвольна при любых температурах, обратная реакция всегда не самопроизвольна
|
| > 0
| < 0
| Всегда > 0
| Реакция не самопроизвольна при любых температурах, обратная реакция самопроизвольна
|
| < 0
| < 0
| При низких температурах < 0, при высоких температурах > 0
| Реакция самопроизвольна при низких температурах, обратная реакция становится самопроизвольной при высоких температурах
|
| > 0
| > 0
| При низких температурах > 0, при высоких температурах < 0
| Реакция не самопроизвольна при низких температурах, но при высоких температурах становится самопроизвольной
|
В закрытых системах самопроизвольные процессы могут протекать только в направлении уменьшения энергии Гиббса (при p = const и T = const) или энергии Гельмгольца (при V = const и T = const), а в состоянии равновесия эти функции имеют минимальное значение.
Примеры решения типовых задач
Пример 1. Определить тепловой эффект процесса термического разложения хлорида аммония и составить термохимическое уравнение реакции.
Решение. Реакция выражается уравнением NH4Cl(к) → NH3(г) + + HCl(г). Согласно следствию из закона Гесса (2):
∆ H 0298 (реакции) = ∑(n' ∆ fH 0298)прод − ∑(n'' ∆ fH 0298)исх =
= ∆ H 0298(NH3)(г) + ∆ H 0298(HCl)(г) - ∆ H 0298(NH4Cl)(к).
Используя справочные данные значений ∆ H 0298веществ, получаем
∆ H 0298(реакции) = (-46,2 – 92,2) – (-314,2) = + 175 кДж.
Таким образом, термическое разложение NH4Cl является эндотермической реакцией. Термохимическое уравнение имеет вид
NH4Cl(к) → NH3(г) + HCl(г) - 175 кДж.
Пример 2. Возможен ли процесс получения металлического железа из оксида Fe2O3 действием водорода при стандартных условиях Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(ж)? Как скажется повышение температуры на вероятности протекания этой реакции?
Решение. Для ответа на первый вопрос задачи необходимо рассчитать изменение свободной энергии Гиббса ∆ G 0298 для рассматриваемой реакции, используя уравнение ∆GT (реакции) = ∆ HT (реакции) − T ∆ SТ (реакции). Значения ∆ H 0298 и ∆ S 0298 для всех веществ, участвующих в реакции, приводятся в задании или берутся из таблиц термодинамических величин.
По следствию из закона Гесса ∆ H 0298(реакции) = ∑(n' ∆ fH 0298)прод − ∑(n'' ∆ fH 0298)исх,найдем
∆ H 0298(реакции) = 3∆H0298 (H2O)(ж) – ∆ H 0298(Fe2O3)(к) = 3 (-285,8) – (-822,0)=
= - 857,4 + 822,0 = - 35,4 кДж.
Значение ∆ H 0298 (H2)(г) = 0 и ∆ H 0298 (Fe)(к) = 0.
Согласно ∆ S 0298(реакции)= ∑(n'S 0298)прод − ∑(n''S 0298)исх, найдем
∆ S 0298(реакц) = [3 S 0298(H2O)(ж) + 2 S 0298(Fe)(к)] - [ S 0298 (Fe2O3)(к) +
+ 3 S 0298(H2)(г)] = (3·70,1 + 2·2,27) - (87,0 + 3·130,5) = - 213,8 Дж/К.
По найденным данным вычисляем
∆ G 0298 = ∆ H 0298 − T ∆ S 0298 = - 35,4 + 213,8·10-3·298 = 28,34 кДж.
Положительное значение ∆ G указывает на невозможность восстановления Fe2O3 водородом при стандартных условиях.
Ответ на второй вопрос задачи определяется знаком ∆ S. Рас-
чет показал, что ∆ S 0298реакции < 0, следовательно, в уравнении ∆ G = ∆ H − T ∆ S величина − T ∆ S > 0. Повышение температуры приводит к увеличению значения ∆ G, а значит, не будет способствовать протеканию реакции в прямом направлении.
Пример 3. Определить возможность самопроизвольного окисления ртути кислородом в стандартных условиях (прямая реакция) и температуру, при которой возможен самопроизвольный распад окиси ртути на ртуть и кислород (обратная реакция):
Hg(ж) + ½ O2(газ) = HgO(кр).
| Вещество
| Hg(ж)
| O2(газ)
| HgO(кр)
|
| D f H 0298, кДж/моль
| 0
| 0
| –90,88
|
| S 0298, Дж/моль×К
| 75,90
| 205,04
| 70,29
|
Решение. Изменение энергии Гиббса в ходе реакции вычисляют по тепловому эффекту и энтропии реакции при Т =298 К:
D r G 0(Т)» D r Н0298 – Т D r S0298,
D r Н 0298 = (å n i D f Н 0298 i )прод – (å n i D f Н 0298 i )исх. вещества,
D r S 0298 = (ån i S 0298 i )прод – (ån i S 0298 i ) исх. вещества,
D r Н 0298 = 1(–90,88) – (1×0 +½×0) = –90,88 кДж/моль,
D r S 0298 = 1×70,29 – (1×75,90 +½×205,04) = –108,13 Дж/моль×K,
D r G 0298 = –90,88 – 298(–108,13×10-3) = –58,65 кДж/моль.
Поскольку D r G 0298 < 0, то окисление ртути в стандартных условиях возможно.
Самопроизвольное разложение окиси ртути на кислород и ртуть возможно, если для обратной реакции  . Поскольку
. Поскольку  то обратная реакция по отношению к окислению возможна, если D r G 0(Т)» D r Н - Т D r S 0 > 0, что выполняется при температуре выше
то обратная реакция по отношению к окислению возможна, если D r G 0(Т)» D r Н - Т D r S 0 > 0, что выполняется при температуре выше  = 840,47 К.
= 840,47 К.



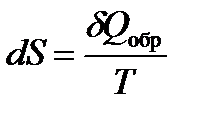 ,
,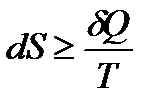
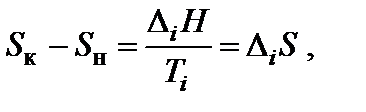
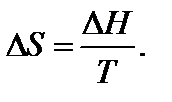
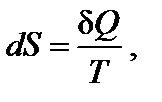
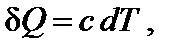
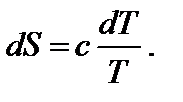
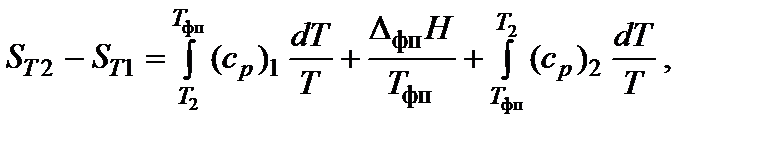
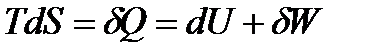 max,
max, 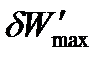 - максимальная полезная работа обратимого процесса, которая включает все виды работ, кроме работы расширения газа.
- максимальная полезная работа обратимого процесса, которая включает все виды работ, кроме работы расширения газа.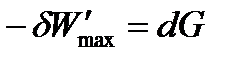
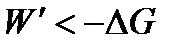
 . Поскольку
. Поскольку  то обратная реакция по отношению к окислению возможна, если D r G 0(Т)» D r Н - Т D r S 0 > 0, что выполняется при температуре выше
то обратная реакция по отношению к окислению возможна, если D r G 0(Т)» D r Н - Т D r S 0 > 0, что выполняется при температуре выше  = 840,47 К.
= 840,47 К.

