Многие элементы могут находиться в разных степенях окисления. Переход элемента из одной степени окисления в другую характеризуется определенным значением окислительно-восстановительного потенциала.
Например, восстановление Mn (VII) до Mn (рН=0) можно представить в виде следующего ряда (ряд или диаграмма Латимера):
1е 2е 1е 1е 2е
MnО4– → MnО42– → MnО2 → Mn3+ → Mn2+ → Mn
0,56 2,26 0,95 1,51 –1,18
Рассчитаем j 0 MnО4–| Mn2+, имея в виду, что всего в этом процессе передается 5е, и в каждой стадии участвует 1 атом марганца:
j 0 =  = 1,51 В
= 1,51 В
Рассмотрим еще один пример с изменением числа атомов:
2·4е 2е 2е
2BrO3– → 2HBrO → Br2 → 2Br–
+1,495 +1,574 + 1,087
Всего от 2BrO3– к 2Br– передается 12 е, значит j 0 реакции BrO3– | Br– в стандартных условиях будет составлять:
j 0 =  = 1,440 В
= 1,440 В
Гальванические элементы
Для гальванических элементов принята специальная форма записи. Согласно рекомендации IUPAC слева указывается электрод, на котором протекает реакция окисления (анод), а справа – электрод, на котором протекает реакция восстановления (катод). В гальванических элементах анод является отрицательно заряженным электродом, а катод – положительно заряженным. Контакт между электролитами, в которые погружены катод и анод, может обеспечиваться за счет солевого мостика (обозначается двумя вертикальными чертами «||») или за счет пористой перегородки (обозначается вертикальным пунктиром «⁞»).
Следует помнить, что при записи правильно разомкнутой цепи на концах должны быть указаны одинаковые металлы, например:
Cu | Zn | ZnSO4 || CuSO4 | Cu
Однако на практике от этого правила отходят, исходя из того, что провода приборов, применяемых для измерения ЭДС, выполнены из одинаковых металлов.
а) пример записи гальванических элементов с солевым мостиком:
анод | электролит1 || электролит2 | катод
Пример: Zn | ZnSO4 || CuSO4 | Cu
б) пример записи гальванических элементов с пористой перегородкой:
анод | электролит1 ⁞ электролит2 | катод
Zn | ZnSO4 ⁞ CuSO4 | Cu
в) пример записи гальванических элементов, в которых анод и катод находятся в одном растворе:
анод | электролит | катод
Cu | H2SO4 | Pt
Для сокращения записи вместо полной формулы электролита часто используют только формулы потенциалопределяющих ионов.
Например:
Zn | Zn2+ || Cu2+ | Cu
При записи концентрационных элементов обычно указываются активности потенциалопределяющих ионов.
Например:
Cu | Cu2+(0,01моль/дм3) || Cu2+(1моль/дм3) | Cu
Обратите внимание на то, что электрод, находящийся в менее концентрированном растворе электролита, будет иметь более отрицательное значение потенциала (анод), поэтому этот электрод записывается первым.
Если несколько веществ образуют одну фазу, то их формулы записывают через запятую.
Например:
Pt | Fe(II), Fe(III) || Ce(IV),Ce(III) | Pt
Pt, H2 | HCl ⁞ Cu2+ | Cu | Pt
Электродные полуреакции принято записывать как реакции восстановления, т.е. в левой части уравнения записываются окисленные формы, а в правой восстановленные.
Например:
Cr2O72– + 14H+ + 6e– = 2Cr3+ + 7H2O
Cu2+ + 2e = Cu
Zn2+ + 2e = Zn
Общая реакция, протекающая в гальваническом элементе, находится путем линейной комбинации реакций, протекающих на левом и правом электродах (разность между реакциями на правом и левом электродах).
Правый электрод: Cu2+ + 2e = Cu
Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Для того чтобы рассчитать ЭДС гальванического элемента, следует из значения потенциала катода вычесть значение потенциала анода. Катод в гальваническом элементе имеет более положительное значение потенциала, чем анод.
Термодинамические расчеты
Разность потенциалов на концах равновесной электрохимической цепи (Е) связана с изменением свободной энергии Гиббса (Δ G) следующим соотношением:
Δ G = – nFE,
где n – число электронов, принимающих участие в электрохимической реакции;
F – число Фарадея.
Зная значение ЭДС в стандартных условиях (Ео), можно рассчитать константу равновесия протекающей в элементе реакции (К):
К = exp  = exp
= exp 
Е0 =  lnKp
lnKp
Зная температурный коэффициент ЭДС, можно найти другие термодинамические функции:
а) изменение энтропии:
ΔS = nF 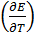
б) изменение энтальпии:
ΔH = ΔG + TΔS = – nFE + nF 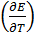
Следует помнить, что электрохимические цепи могут быть строго равновесными, только в условиях отсутствия границ между различными растворами, поскольку на таких границах происходят процессы диффузии и возникает диффузионный потенциал.
Упражнения и задачи
1. Выполните расчеты и заполните таблицу
| Электродное равновесие
| Стандартный электродный потенциал j0, В
| Электродный потенциал
j, В
| Активность,
моль/дм3
| Температура
Т, К
|
| Ag+ + e = Ag
| 0,799
|
| [Ag+ ]=0,1
| 298
|
| Br2(ж)+2e = 2Br–
| 1,065
|
| [Br–]=0,05
| 298
|
| МnO4–+8H++5e=Mn2++4H2O
| 1,51
|
| [МnO4–] = 0,01
[Mn2+] = 0,05
pH = 2
| 283
|
| H2O2+2H++2e=2H2O
| 1,776
|
| [H2O2] = 1,776
pH = 3
| 293
|
| Cl2(г)+2e = 2Cl–
| 1,358
|
| [Cl–] = 0,5
pCl2 = 2 атм.
| 298
|
| Cr2+ + 2e = Cr
| -0,913
|
| [Cr2+] = 0,1
| 298
|
| Al3+ + 3e = Al
| -1,662
|
| [Al3+] = 0,2
| 298
|
2. Запишите схемы гальванических цепей, содержащих указанные компоненты, приведите электродные реакции, протекающие при замыкании соответствующих цепей:
а) хлорсеребряный и каломельный электроды в водном растворе хлороводородной кислоты;
б) медный электрод в растворе хлорида меди, стандартный водородный электрод, пористая перегородка;
в) водородный электрод в растворе серной кислоты, хлорный электрод в растворе хлорида калия, пористая перегородка;
г) никелевый электрод в 1 моль/дм3 растворе сульфата никеля, никелевый электрод в 0,05 моль/дм3 растворе сульфата никеля, солевой мостик;
д) каломельный электрод, цинковый электрод в растворе сульфата цинка, солевой мостик;
е) хлорсеребряный электрод, солевой мостик, цинковый электрод в растворе нитрата цинка;
ж) стеклянный электрод, кислородный электрод в растворе кислоты, солевой мостик.
3. Запишите схему цепи, включающую стеклянный электрод, раствор серной кислоты, хлорсеребряный электрод, солевой мостик.
4. Составьте схемы цепей, с помощью которых можно реализовать следующие реакции:
а) Cd + CuSO4 = Cu + CdSO4
б) Н2 + Сl2 = 2HCl
в) Н2 + ОН– = Н2О
г) 2Н2 + О2 = 2Н2О
4. Запишите схемы цепей для измерения потенциалов медного, никелевого, свинцового электродов относительно стандартного водородного электрода.
5. ЭДС цепи: Cd | CdI2р-р | AgIт | Ag при 25оС составляет 0,286 В. Рассчитайте активность иодида кадмия в растворе.
(Ответ: 0,065 моль/дм3)
6. Рассчитайте константу равновесия реакции Fe2+ + S2– = Fe + S для температуры 298 С.
(Ответ: К = 1,313)
7. ЭДС концентрационного элемента, состоящего из двух цинковых электродов, один из которых находится в растворе сульфата цинка, имеющего концентрацию 0,01 моль/кг, а второй в растворе сульфата цинка, имеющего концентрацию 0,1 моль/кг составляет 0,0235 В. Рассчитайте величину диффузионного потенциала на границе этих растворов и определите, можно ли в данном случае пренебречь величиной диффузионного потенциала.
(Ответ: 0,01735 В)
8. Составьте схему гальванического элемента, в котором протекает следующая реакция: Ag+ + Br– = AgBr.
9. Составьте схему гальванического элемента, в котором будет протекать окисление меди.
10. Рассчитайте ΔS и ЭДС гальванического элемента, в котором реализуется следующая реакция: Pb + Hg2Cl2 = PbCl2 + 2Hg, если ΔН этой реакции при 298 K равно –94.2 кДж/моль. При увеличении температуры на 1 К ЭДС элемента возрастает на 1,45·10–4 В.
(Ответ: ΔS = 28 Дж/(моль· K); ЭДС = 0,531 В).
11. Рассчитайте ЭДС элемента
Pt, H2 │ NаOH (0,1 моль/кг) ││ H2SO4 (1,0 моль/кг) │ H2, Pt
при температуре 298 K, если давление водорода составляет 1,01325 · 10 5 Па; средние ионнные коэффициенты активности γ + (NaOH) = 0,766; γ + (H2SO4) = 0,132.
(Ответ: 0,758 В)
12. Рассчитайте стандартный электродный потенциал для электродной реакции Fe3+ + 3е = Fe, если известны значения стандартных электродных потенциалов следующих реакций:
Fe2+ + 2е = Fe j0 = –0,440 В
Fe3+ + е = Fe2+ j0 = +0.771 В
(Ответ: –0,036 В)
13. Выполните расчеты и установите направление самопроизвольного протекания следующей окислительно-восстановительной реакции в стандартных условиях:
2KBr + PbO2 + 4HNO3 = Pb(NO3)2 + Br2 + 2KNO3 + 2H2O
(Ответ: слева направо)
14. Пользуясь данными приложения 1, рассчитайте значение j0 для реакции Cu2+ + 2e = Cu.
(Ответ: +0,337 В)
15. Можно ли приготовить стабильный раствор, содержащий смесь хлорида олова (II) и хлорида железа (III) одинаковых концентраций?
(Ответ: такой раствор приготовить нельзя, поскольку в нем начнет протекать окислительно-восстановительная реакция)
16. Выполните расчеты и определите, возможность окисления сульфида меди пероксидом водорода в стандартных условиях в соответствии со следующим уравнением реакции:
CuS + H2O2 + 2HCl = CuCl2 + S + 2H2O
17. Рассчитайте константу равновесия следующей реакции в стандартных условиях:
10Br– + 2MnO4– + 16H+ = 5Br2 + 2Mn2+ + 8H2O,
если j0 (Br2/Br–) = 1,06В; j0 (MnO4– /Mn2+) = 1,51В.
(Ответ: K =2,63·1075)
18. Рассчитайте диффузионный потенциал, возникающий при 18о С на границе растворов нитрата цезия различной концентрации:
CsNO3 (a = 0,1 моль/дм3) ⁞ CsNO3 (a = 0,01 моль/дм3), если подвижности ионов Cs+ и NO3– при этой температуре соответственно равны 66,8·10–4 и 62,6·10–4 См⋅м2/моль-экв.
(Ответ: Δjдифф = 0,0019 B).
19. Рассчитайте диффузионный потенциал при 18оC на границе растворов: LiCl (a = 0,1 моль/дм3) и LiCl (a = 0,01 моль/дм3), если подвижности ионов Li+ и Cl– при этой температуре равны, соответственно, 32,6·10–4 и 65,5·10–4 См⋅м2/моль-экв.
(Ответ: Δjдифф = 0,0194 B).
20. Рассчитайте средний ионный коэффициент активности (γ±) в 0,05 моль/кг растворе сульфата цинка, если известно, что ЭДС цепи
Zn | ZnSO4 (0,05 моль/кг) || ZnSO4 (0,005 моль/кг) | Zn
при 295 К составляет0,0185 В, а γ± разбавленного раствора = 0,477.
21. Рассчитайте потенциал серебряного электрода, находящегося в насыщенном растворе бромида серебра, в который добавлен бромид калия. Концентрация раствора бромида калия составляет 0,1 моль/дм3. Произведение растворимости AgBr = 6·10-13.
(Ответ: 0,14 В)
22. Потенциал водородного электрода в растворе кислоты составляет 0,082 В. Рассчитайте активность ионов Н+ в этом растворе.
(Ответ: 0,041 моль/дм3).
3.5. Контрольные вопросы
1. Что такое электрохимическая система?
2. В чем особенности электрохимических реакций?
3. Какие электроды называются инертными?
4. Какие ионы называются потенциалопределяющими?
5. Что такое электрохимический потенциал?
6. Что такое ток обмена?
7. Каковы условия термодинамического равновесия в электрохимических системах?
8. Что называется равновесным электродным потенциалом?
9. Какие величины входят в уравнение Нернста?
10. Что такое двойной электрический слой?
11. Какие электроды называются обратимыми?
12. Какие электроды являются необратимыми?
13. Каково устройство водородного электрода?
14. Какие электроды называются электродами первого рода?
15. Что такое электроды второго рода?
16. Приведите пример газового электрода.
17. Какие электроды называются обратимыми по катиону, а какие по аниону. Приведите примеры. Напишите уравнение Нернтста для этих электродов.
18. Какие электроды называются окислительно-восстановительными?
19. Что такое стандартный электродный потенциал?
20. Что такое стандартная ЭДС?
21. Какая форма записи принята для гальванических элементов?
22. Что такое концентрационные электрохимические цепи?
23. Какая цепь называется правильно разомкнутой?
24. Какой порядок записи принят для электродных полуреакций?
25. Каков механизм возникновения диффузионного потенциала?
26. Какие приемы используются для устранения диффузионного потенциала?
27. Какие цепи называются цепями с переносом?
28. Что такое электроды сравнения?
29. Какова связь между ЭДС цепи и изменением энергии Гиббса?
30. Какова связь между ЭДС и константой равновесия протекающей в элементе реакции?
31. В каких расчетах используются диаграммы Латимера?
32. На чем основано потенциометрическое титрование?
33. Чем определяется скорость электрохимической реакции?
34. Какая стадия электродной реакции называется лимитирующей?
35. Что такое поляризация электрода?
36. Чем обусловлена концентрационная поляризация?
37. Что такое предельный ток?
38. Какие факторы оказывают влияние на скорость электродных процессов?
39. Какие зависимости отражает уравнения Тафеля?
40. Что такое перенапряжение?
ЭЛЕКТРОЛИЗ. ЗАКОНЫ ФАРАДЕЯ
Содержание темы
Электролиз. Электролиз растворов кислот, щелочей, солей. Электролиз воды. Электролиз с инертными и растворимыми анодами. Электролиз расплавов. Законы Фарадея. Электрохимический эквивалент. Постоянная Фарадея. Кулонометрия. Кулонометры. Кулонометрическое титрование. Побочные и вторичные процессы при электролизе. Напряжение электролиза. Выход по току. Выход по энергии.
Практическое применение электролиза: электрохимический синтез неорганических и органических веществ, электрохимическое получение и рафинирование металлов, электрохимическое травление металлов. Гальванотехника.
Материал для повторения
Таблица 4.1
| Предмет
| Тема
| Вопросы для повторения
|
| Общая химия
| Электролиз
| Электролиз. Катодные и анодные процессы. Стандартные электродные потенциалы. Электролиз расплавов. Электролиз растворов. Участие воды в процессах электролиза растворов. Электрохимическое окисление и восстановление воды. Электролиз с активными и инертными анодами. Электролиз растворов солей, кислот, щелочей. Законы электролиза. Число Фарадея. Электрохимическая поляризация. Перенапряжение.
|
| Физика
| Электричество и магнетизм
| Постоянный электрический ток. Сила тока. Плотность тока. Работа и мощность тока.
|
Основные понятия и соотношения по изучаемой теме, используемые при решении задач
Таблица 4.2
| Понятие
| Символ
| Размерность
| Определение, формула
|
| 1
| 2
| 3
| 4
|
| Сила тока
| I
| А (ампер)
| Сила тока (I) – физическая величина, равная отношению количества заряда (количества электричества) (ΔQ), прошедшего через некоторую поверхность за время (Δt) к величине этого промежутка времени: I = ΔQ/Δt
|
| Электрический заряд (количество электричества)
| Q
| Кл (кулон)
| Количество электричества (Q) или электрический заряд — это произведение силы тока (I) на время прохождения тока (t):
Q = I · t
Количество электричества, равное 1 кулону, иначе называют ампер-секундой, так как при токе 1 ампер через поперечное сечение проводника за 1 секунду протекает количество электричества равное 1 кулону: Q (Кл) = I (А) · t (с)
|
| Иногда используется внесистемная единица Ф (или F) (фарадей)
| Фарадей – внесистемная единица измерения электрического заряда, используемая в электрохимии.
1 фарадей соответствует заряду 1 моля электронов или однозарядных ионов:
1 Ф = NA · e,
где NA – число Авогадро (6,02 · 1023);
e – заряд электрона.
При пропускании через электролитическую ячейку заряда в 1 фарадей на каждом электроде выделяется 1 моль эквивалентов вещества. Численно 1 фарадей равен постоянной Фарадея.
1 фарадей = 96485,33 Кл
|
Продолжение таблицы 4.2
| 1
| 2
| 3
| 4
|
| Постоянная Фарадея (число Фарадея)
| F
| F = 96485,33
Кл/моль
| Постоянная Фарадея (число Фарадея) F — фундаментальная физическая постоянная, определяющая соотношение между электрохимическими и физическими свойствами вещества. Для постоянной Фарадея справедливо соотношение: F = e · NA,
где e – элементарный заряд;
NA – число Авогадро
|
| Электрохимический эквивалент
| k
| кг/Кл
или
г/(А·ч)
или
г/Кл
| Электрохимический эквивалент – масса вещества, которое должно выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества: k = М / F,
где k – электрохимический эквивалент (г/Кл);
М – молярная масса эквивалентов вещества, г/моль; F – число Фарадея (96500), Кл
|
| Молярная масса эквивалентов (эквивалентная масса)
| М (экв)
| кг/моль
(г/моль)
| Молярная масса эквивалентов – масса одного моля эквивалентов вещества (г/моль-экв).
М (экв) = М / z,
где М – молярная масса вещества;
z – число отдаваемых или принимаемых электронов
|
| Выход по току
| η
| %
или доли единицы
| Выходом по току называют отношение количества фактически пропущенного через электролит заряда Qf к теоретически необходимому Qt для осуществления фактически наблюдаемого массопереноса m: η = 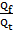 Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по 1-му закону Фарадея: η =
Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по 1-му закону Фарадея: η = 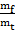
|
Законы Фарадея
Таблица 4.3.
| I закон Фарадея
| Масса вещества, прореагировавшего на электроде при пропускании постоянного электрического тока, пропорциональна силе тока и времени электролиза.
M = k · I · t = k · Q,
где m – масса вещества, кг;
k – электрохимический эквивалент, кг/Кл;
I – сила тока, А;
t – время, с;
Q – количество электричества, Кл.
|
| II закон Фарадея
| При постоянном количестве пропущенного через электрод электричества массы продуктов реакции пропорциональны их химическим эквивалентам.
K = 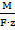 ,
где k – электрохимический эквивалент, кг/Кл;
M – молярная масса вещества, кг/моль;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции. ,
где k – электрохимический эквивалент, кг/Кл;
M – молярная масса вещества, кг/моль;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции.
|
| Объединенный закон Фарадея
|
m =  ,
где m – масса вещества, кг;
M – молярная масса вещества, кг/моль;
Q – количество электричества, Кл;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции ,
где m – масса вещества, кг;
M – молярная масса вещества, кг/моль;
Q – количество электричества, Кл;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции
|



 = 1,51 В
= 1,51 В = 1,440 В
= 1,440 В = exp
= exp 
 lnKp
lnKp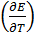
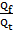 Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по 1-му закону Фарадея: η =
Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по 1-му закону Фарадея: η = 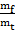
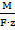 ,
где k – электрохимический эквивалент, кг/Кл;
M – молярная масса вещества, кг/моль;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции.
,
где k – электрохимический эквивалент, кг/Кл;
M – молярная масса вещества, кг/моль;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции.
 ,
где m – масса вещества, кг;
M – молярная масса вещества, кг/моль;
Q – количество электричества, Кл;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции
,
где m – масса вещества, кг;
M – молярная масса вещества, кг/моль;
Q – количество электричества, Кл;
F – постоянная Фарадея, Кл/моль;
z – число электронов, принимаемых или отдаваемых эквивалентом вещества в электрохимической реакции



