

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ЧАСТЬ А
1. Запишите определения:
химическая формула – ………………………………………………………………………..
……………………………………………………………………………………………………
относительная атомная масса – ……………………………………………………………….
……………………………………………………………………………………………………
относительная молекулярная масса – ……………………………………………………….
……………………………………………………………………………………………………
2. Заполните пропуски в следующих предложениях.
Химические формулы отражают …………. состав и состав. ………….…………. состав показывает
……………………………………………………………….……………………………………
…………………………………………………………………………………………………...
................ состав показывает …………………………………………………………………….
……………………………………………………………………………………………………
Например, формула H2SO4 означает ……………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
ЧАСТЬ Б
У р о в е н ь 1
1. Дайте характеристику следующим веществам, руководствуясь планом (приведенным ниже).
Углекислый газ CO2
1) Формула вещества: ………………………………………...………….......................
2) Качественный состав: ………………………………………...…………....................
3) Количественный состав: ………………………………………...………….................
4) Тип вещества по составу: ………………………………………...………..................
5) Mr = ………………………………………...………..................................................
6) Соотношение масс элементов в веществе: ……………………………………….....
7) Массовые доли каждого элемента в данном веществе:...................................
|
|
Метан СН4
1) Формула вещества: ………………………………………...………….......................
2) Качественный состав: ………………………………………...…………....................
3) Количественный состав: ………………………………………...………….................
4) Тип вещества по составу: ………………………………………...…………...............
5) Mr = ………………………………………...…………...............................................
6) Соотношение масс элементов в веществе: ……………………………………….....
7) Массовые доли каждого элемента в данном веществе: ………………................
Сода Na2CO3
1) Формула вещества: ………………………………………...…………........................
2) Качественный состав: ………………………………………...………….....................
3) Количественный состав: ………………………………………...………….................
4) Тип вещества по составу: ………………………………………...………..................
5) Mr = ………………………………………...…………...............................................
6) Соотношение масс элементов в веществе: ……………………………..................
7) Массовые доли каждого элемента в данном веществе:………………….............
Гашеная известь Са(ОН)2
1) Формула вещества: ………………………………………...………........….................
2) Качественный состав: ………………………………………...………….......................
3) Количественный состав: ………………………………………...……….…..................
4) Тип вещества по составу: ………………………………………...………….................
5) Mr = ………………………………………...………….................................................
6) Соотношение масс элементов в веществе: ……………………………....................
7) Массовые доли каждого элемента в данном веществе: …………………...............
У р о в е н ь 2
Сахароза С12Н22О11
1) Формула вещества: ………………………………………...………….........................
2) Качественный состав: ………………………………………...…………......................
3) Количественный состав: ………………………………………...……….…..................
4) Тип вещества по составу: ………………………………………...………….................
5) Mr = ………………………………………...………….................................................
6) Соотношение масс элементов в веществе: ………………………………................
|
|
7) Массовые доли каждого элемента в данном веществе: ……………………..........
ЧАСТЬ В. Задания для самоконтроля
Обведите кружком правильный ответ.
1. Формула вещества, в состав молекулы которой входит
в а р и а н т I – один атом калия, один атом азота, три атома кислорода;
в а р и а н т II – один атом калия, один атом азота, два атома кислорода:
а) Сa(NO3)2; б) KNO2; в) KNO3; г) K3N.
2. Приведенные записи
в а р и а н т I – 4О и 4О2;
в а р и а н т II – 3N2 и 3N
означают:
а) 4 молекулы и 4 атома кислорода;
б) 4 атома и 4 молекулы кислорода;
в) 3 атома и 3 молекулы азота;
г) 3 молекулы и 3 атома азота.
3. В строке приведены формулы
в а р и а н т I – простых веществ;
в а р и а н т II – сложных веществ:
а) H2, H2O, O2, NO;
б) N2, Cu, O3, O2;
в) Cu2O, CuO, N2, Al;
г) NH3, C2H2, CO2, CaO.
4. Ряд веществ, в которых относительная атомная масса
в а р и а н т I – увеличивается;
в а р и а н т II – уменьшается:
а) S, Si, Al, Na;
б) Be, C, O, Ne;
в) S, Cl, N, Ar;
г) Na, Li, B, H.
5. Атом
в а р и а н т I – кремния;
в а р и а н т II – серы
тяжелее атома водорода в:
а) 14 раз; б) 28 раз; в) 32 раза; г) 16 раз.
6. Относительная молекулярная масса
в а р и а н т I – этана С2Н6;
в а р и а н т II – этилена С2Н4
равна:
а) 18; б) 32; в) 28; г) 30.
АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Строение атома. Изотопы. Строение электронных оболочек атомов
ЧАСТЬ А
1. Какие частицы входят в состав атома? Укажите их характеристики (заряд, массу)
……………………………………….........................................………….........................
2. Дайте определение:
изотопы – ………………………………………...…………..............................................;
орбиталь – ………………………………………...………….............................................
ЧАСТЬ Б
У р о в е н ь 1
3. Заполните таблицу (табл. 6).
Таблица 6
| Порядковый номер | Знак элемента | Заряд ядра | Число протонов | Число нейтронов | Число электронов | Относительная атомная масса |
| 8 | О | +8 | 8 | 16 – 8 = 8 | 8 | 16 |
| F | ||||||
| 11 | ||||||
| Ar | ||||||
| 19 |
4. Определите число элементарных частиц для атомов элементов № 7, 23, 4, 25 по образцу:

…………………………………………..……………………...............
5. Запишите план, которым следует руководствоваться при составлении схем электронного строения атома.
…………………………………………..…………………………………
…………………………………………..…………………………………
|
|
…………………………………………..…………………………………
…………………………………………..…………………………………
…………………………………………..………………………………...
6. Составьте схемы электронного строения атомов первых двадцати химических элементов. Подчеркните внешний энергетический уровень и определите число электронов на нем.
| № 1 | № 8 | № 15 |
| № 2 | № 9 | № 16 |
| № 3 | № 10 | № 17 |
| № 4 | № 11 | № 18 |
| № 5 | № 12 | № 19 |
| № 6 | № 13 | №20 |
| № 7 | № 14 |
У р о в е н ь 2
7. Запишите электронные и электронно-графические формулы атомов первых двадцати химических элементов.
| № 1 | № 2 |
| № 3 | № 4 |
| № 5 | № 6 |
| № 7 | № 8 |
| № 9 | № 10 |
| № 11 | № 12 |
| № 13 | № 14 |
| № 15 | № 16 |
| № 17 | № 18 |
| № 19 | № 20 |
ЧАСТЬ В
Обведите кружком правильный ответ.
1. Число энергетических уровней и число электронов на внешнем энергетическом уровне в атоме
в а р и а н т I – бора;
в а р и а н т II – алюминия:
а) 2 и 2; б) 2 и 3; в) 3 и 2; г) 3 и 3.
Дополните предложения.
2. Заряд ядра, число протонов в ядре и число электронов в атоме.................................
3. Порядковый номер химического элемента показывает.................................
4. Число энергетических уровней в атоме равно.................................
5. Заряд ядра атома
в а р и а н т I – лития равен...................................;
в а р и а н т II – аргона равен.................................
6. Число электронов на внешнем энергетическом уровне в атомах элементов главных подгрупп равно........................................................
7. Уровень, на котором находится максимально допустимое число электронов, называется.................................
8. Разновидность атомов одного и того же химического элемента с одинаковым зарядом ядра, но с разной относительной атомной массой называется.................................
9. 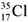 и
и 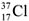 – это.................................
– это.................................
10. Ядро атома
в а р и а н т I – 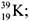
в а р и а н т II – 
содержит: ………. p и ……. n.
11. В атоме
в а р и а н т I – азота;
в а р и а н т II – фтора:
…… энергетических уровней и..... электронов на внешнем уровне.
Обведите кружком правильный ответ.
12. Выявите
в а р и а н т I – сходство;
в а р и а н т II – различие
в составе атомов изотопов.
а) разное число нейтронов;
б) одинаковое число протонов и электронов;
в) одинаковое число нейтронов;
г) разное число протонов.
|
|
13. Распределение электронов по уровням
в а р и а н т I – 2, 8, 4;
в а р и а н т II – 2, 2
соответствует атому:
а) бора; б) бериллия; в) углерода; г) кремния.
14. Максимальное число электронов на внешнем уровне
в а р и а н т I – 5;
в а р и а н т II – 8
содержат атомы элементов:
а) F и Cl; б) N и Р; в) Ne и Ar; г) Р и S.
15. Химический элемент 3-го периода образует оксид
в а р и а н т I – Э2О5;
в а р и а н т II – ЭО2.
Распределение электронов в атоме этого элемента:
а) 2, 8, 3; б) 2, 8, 4; в) 2, 8, 5; г) 2, 8, 6.
16. Химический элемент расположен
в а р и а н т I – во 2-м периоде IIIа группе;
в а р и а н т II – во 2-м периоде Vа группе.
Распределение электронов в атоме этого элемента:
а) 2, 8, 3; б) 2, 3; в) 2, 5; г) 2, 6.
17. Распределение электронов в атоме элемента:
в а р и а н т I – 2, 8, 7;
в а р и а н т II – 2, 8, 5.
Формулы высшего оксида и летучего водородного соединения для этого элемента соответственно:
а) ЭО3 и Н2Э; б) Э2О7 и НЭ; в) ЭО2 и Н4Э; г) Э2О5 и Н3Э.
18. Число протонов
в а р и а н т I – наименьшее;
в а р и а н т II – наибольшее
содержится в ядре атома:
а) гелия; б) хлора; в) натрия; г) водорода.
Установите соответствие.
| 19. Конфигурация внешнего уровня 1) 3 s 2. 2) 2 s 22 p 4. 3) 2 s 1. 4) 3 s 23 p 3. | Атом элемента а) Литий. б) Магний. в) Кислород. г) Фосфор. |
Ответ.
| 1 | 2 | 3 | 4 |
| 20. Формула высшего оксида 1) Э2О. 2) ЭО3. 3) Э2О3. 4) ЭО2. | Конфигурация внешнего уровня а) ns 2 np 4. б) ns 2 np 1. в) ns 1. г) ns 2 np 2. |
Ответ.
| 1 | 2 | 3 | 4 |
5. Периодическая система химических элементов Д.И.Менделеева
в свете представлений о строении атома
Подведение итогов
1. Дайте формулировку периодического закона Д.И.Менделеева 1869 г.:
.................................................................................................................
.................................................................................................................
................................................................................................................
Современная формулировка:
.................................................................................................................
.................................................................................................................
................................................................................................................
2. В пределах периодов с увеличением порядкового номера:
а) число электронов на внешнем уровне атомов элементов..........................................
б) число энергетических уровней...................................................................................
в) радиус атома.............................................................................................................
г) металлические свойства.............................................................................................
д) неметаллические свойства.........................................................................................
3. В пределах главных подгрупп:
а) число электронов на внешнем уровне атомов элементов.............................................
б) число энергетических уровней....................................................................................
в) радиус атома...............................................................................................................
|
|
г) металлические свойства...............................................................................................
д) неметаллические свойства............................................................................................
4. Число электронов на внешнем энергетическом уровне атомов элементов:
а) в периодах...................................................................................................................
б) в главных подгруппах....................................................................................................
5. Напишите, что общего в строении атомов элементов:
а) углерода и азота............................................................................................................
б) углерода и кремния.......................................................................................................
ХИМИЧЕСКАЯ СВЯЗЬ
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!