УГАЭС
Кафедра Общей химии
Аналитическая химия
(методы химического анализа)
Уфа 2011
УДК 371.385.54
Составители: к.х.н., доцент О.Г.Горлевских
Методические указания: «Аналитическая химия. Методы химического анализа».- Уфа,УГАЭС 2011. 24 с.
Предназначены для студентов заочной формы обучения всех специальностей.
Рецензент:
Методические указания для студентов заочной формы обучения
Ó Издательский центр УГАЭС 2011
Аналитическая химия - наука о методах изучения химического состава вещества. Аналитическая химия включает качественный и количественный анализ. Качественный анализ позволяет определять и идентифицировать состав вещества. Количественный анализ - определять содержание различных компонентов в анализируемой системе.
В качественном и количественном анализе используют химические, физические и физико-химические методы исследования. Химические методы анализа основаны на способности веществ вступать в химические взаимодействия. Физические методы основаны на измерении каких-либо физических параметров веществ. Физико-химические методы основаны на наблюдении за изменением физических свойств веществ, которые происходят в результате химической реакции.
В качественном анализе для обнаружения ионов и молекул используют химические и физико-химические методы.
При количественных определениях применяются химические методы (титриметрический и гравиметрический), физические и физико-химические (атомная и молекулярная абсорбционная спектроскопия, эмиссионный спектральный анализ, флуориметрия, поляриметрия,рефрактометрия, кондуктометрия, потенциометрия; полярография, кулонометрия, хроматография и т.д.). Несмотря на преимущества, которые имеют физические и физико-химические методы по сравнению с химическими методами количественного анализа, последний широко используются в практике научно-исследовательских и заводских лабораторий. Это объясняется простотой методики эксперимента и сочетанием правильности и воспроизводимости результатов анализа.
В настоящем пособии основное внимание уделено химическим методам количественного анализа, имеющим наибольшее значение для работников пищевых предприятий.
Пособие состоит из трех разделов:
1) равновесия в растворах труднорастворимых соединений;
2) гравиметрический анализ;
3) титриметрический анализ.
В начале каждого раздела кратко изложена теория, даны примеры решения задач. В конце каждого раздела приведены контрольные вопросы и задачи для выполнения контрольной работы. Варианты контрольных работ и справочные таблицы помещены в конце пособия.
1. Равновесия в растворах малорастворимых соединений. Растворимость и произведение растворимости.
Ионные равновесия, связанные с образованием осадков, являются обратимыми, подчиняются закону действующих масс и характеризуются константой равновесия, которую принято называть произведением растворимости (ПР). Произведение растворимости - постоянная величина. Она равна произведению активностей ионов в насыщенном растворе малорастворимого электролита.
Например, при образовании осадка хлорида серебра имеет место равновесие, которое описывается уравнением:
AgCl «А g + + С l -
Для приближенных раcчетов произведение растворимости AgCl можно записать в виде следующего выражения:
ПР(AgCl)=[ Ag + ] +[ Cl - ],
так как молярные концентрации ионов в данном случае мало отличаются от их активностей. Таким образом, для любой труднорастворимой соли Мp Aq можно записать в общем виде:
ПР (М p А q) =[ M ] p + [ A ] q
По опытным данным о растворимости труднорастворимых электролитов рассчитывают их произведение растворимости или на основании табличных данных о произведении растворимости решают обратную задачу. При этом необходимо, помнить, что растворимость вещества может быть выражена в любых единицах измерения, а ПР рассчитывается только по концентрациям, выраженным в моль/дм3 или в моль/л.
Все вычисления, связанные с образованием и растворением осадков, выполняют по следующей схеме:
- составляют уравнения диссоциации электролитов;
- составляют ионные уравнения образования осадков;
- записывают выражение ПР в соответствии с ионным уравнени-
ем, описывающим образование осадка и находят значение ПР по таб-
лице;
- вычисляют значения равновесных концентраций ионов по за-
данным концентрациям сильных электролитов или с учетом Кдис. для
слабых электролитов;
- сопоставляя заданные концентрации и условия задачи, составляют алгебраическое уравнение, по которому определяют искомую величину.
Пример1. Вычислить ПР (BaSO4), если его растворимость равна 2,33 мг/л.
Решение: Для вычисления ПР (BaS04)= [Ва2+]•[SO 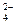 ] необходимо рассчитать концентрацию BaS04 в моль/л. Для этого нужно весовое колическтво соли BaSQ4, равное 2,33 мг, выразить в молях, для чего данное его весовое количество надо разделить на мольную массусульфата бария, т.е. 233,4 г/мол:
] необходимо рассчитать концентрацию BaS04 в моль/л. Для этого нужно весовое колическтво соли BaSQ4, равное 2,33 мг, выразить в молях, для чего данное его весовое количество надо разделить на мольную массусульфата бария, т.е. 233,4 г/мол:
0,00233г: 233,4 г/моль=10-5 моль.
Поскольку концентрация соли BaS04 очень мала, то соль в растворе диссоциирована полностью и тогда концентрация ионов Ba2+ и S0 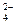 будет равна 10-5 моль/л. Соответственно, произведение
будет равна 10-5 моль/л. Соответственно, произведение
растворимости
ПР(BaSO 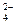 )= [Ва2+]•[SO
)= [Ва2+]•[SO 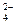 ]= 10-5 • 10-5 = 10-10.
]= 10-5 • 10-5 = 10-10.
Пример 2. Вычислить растворимость СаСО3 в граммах на 100 г насыщенного раствора, если ПР(СаСОз) =1,7•10 -8.
Решение: Записываем уравнение образования осадка:
Сa2+ + CO 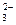 = CaCO3
= CaCO3
Согласно уравнению [Сa 2+]•[ CO 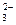 ]= В насыщенном растворе СаСОз равновесные концентрации Са2+ и CO
]= В насыщенном растворе СаСОз равновесные концентрации Са2+ и CO 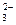 равны; обозначим эту концентрацию "х", т.е. [Сa 2+]•[ CO
равны; обозначим эту концентрацию "х", т.е. [Сa 2+]•[ CO 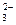 ] =х. Тогда
] =х. Тогда
[Сa 2+]•[ CO 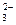 ]=1,7•10 -8 = х2, откуда
]=1,7•10 -8 = х2, откуда
х=  = 1,3•10-4моль/л.
= 1,3•10-4моль/л.
Следовательно, и концентрация СаСОз в насыщенном растворе равна 1,3•10-4 моль/л. Растворимость "а" СаСОз в г получим, умножив мольную концентрацию на молекулярную массу соли:
а=1,3•10-4•100=1,3•10-2 г/л, или 1,3•10-4 /10=1,3•10-3 г/100см3 .
Принимая плотность очень разбавленного раствора равной 1 г/см3, получим, что растворимость СаСОз равна 1,3•10-4г на 100 г раствора.
Радение данной задачи носит приближенный характер.
Условия образования и растворения осадков.
Следствием из определения произведения растворимости является вывод, что осадок выпадает из перенасыщенного раствора, т.е
когда произведение концентраций ионов выше ПР, взятых из справочных таблиц. Если произведение концентраций ионов - меньше ПР, то осадок не выпадает, и при внесении в такой раствор кристалликов твердой фазы этого вещества будет наблюдаться растворение твердого вещества.
Пример 3. Может ли образовываться осадок Mg(OH)2 , если смешать равные объёмы 0,5М раствора MgCl2 и 0,1М раствора NH4 OH?
Решение: За счет увеличения объёма при сливании растворов вдвое следует учитывать уменьшение начальных концентраций также вдвое, т.е. концентрация раствора MgCl2 станет равной 0,5М:2 – 0,25М/л, а концентрация NH4 OH - равной 0,1М:2 – 0,05 М/л.
Уравнения записываются в следующем виде:
Mg+2 + 2OH- «Mg(OH)2
ПР(Mg(OH)2)=[ Mg+2] •[ OH-]2 .
Для ответа на вопрос, выпадает ли в осадок Mg(OH)2 , нужно знать концентрацию ионов Mg+2 и OH- . Концентрацию ионов магния принимаем равной 0,25 моль/л, учитывая, что хлорид магния является сильным электролитом и диссоциирует полностью.
Для вычисления концентрации ионов OH- используют выражение константы диссоциации:
NH4 OH«NH4 + + OH-
К=[ NH4 +]•[ OH-]/[ NH4 OH]=1,8•10-5
Принимаем равновесные концентрации [ NH4 +]=[ OH-]=х и
[ NH4 OH]=0,05-х. Тогда х2 / (0,05-х)= 1,8•10-5 .
Решим уравнение в упрощенном виде, т.е. примем, что 0,05-х=0,05М/л. Теперь находим значение «х»:
х = 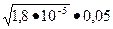 = 9,5•10-4моль/л.
= 9,5•10-4моль/л.
Используя значения концентраций [ Mg+2] =0,25 моль/л и [ OH-]= 9,5•10-4моль/л для вычисления произведения начальных концентраций по выражению для ПР, получим:
[ Mg+2] •[ OH-]2 =0,25•(9,5•10-4)2 =2,25•10-7 .
Полученную величину сравниваем с табличным значением ПР(Mg(OH)2)= 5,2•10-12 . Очевидно, что рассчитанное произведение концентраций превышает табличное значение ПР(Mg(OH)2), следовательно, раствор пересыщен, и осадок должен выпадать.
Пример 4. При каком значении рН начнется выпадение осадка Fe(OH)2 из 0,1 М раствора FeSO4 при добавлении раствора NaOH?
Решение: Образование осадка описывается уравнением:
Fe2+ + 2OH- «Fe(OH)2 ,
для которого выполняется условие
ПР(Fe (OH)2)=[ Fe 2+] •[ OH-]2 =1,1•10-15.
Принимая, что соль FeSO4, как сильный электролит, в растворе диссоциирует полностью, равновесная концентрация ионов [Fe2+]=0,1 моль/л.Исходя из выражени я П P (Fe (OH)2) по лучаем: 10-1]•[ОН-]2= 1,1•10-15; [ОН-]= 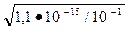 =10-7 моль/л.
=10-7 моль/л.
Учитывая, что рН=-lg [Н+],а [H+]•ОH-]=10-14, найдем, что концентрация ионов водорода равна 10-14/10-7моль/л и рН соответственно равно -lg•10-7=7
Таким образом, при pH=7 начинается выпадение осадка Fe(OH)2 из 0,1 М раствора FeSO4 при добавлении NaOH.
К О Н Т P О Л Ь Н Ы Е ВОПРОСЫ
1. Каким образом произведение растворимости труднорастворимого
соединения связано с его растворимостью?
2. Условия выпадения осадков.
3. Как рассчитать концентрацию иона-осадителя с помощью ПР?
4. Условия растворения труднорастворимых соединений.
ЗАДАЧИ
Примеры решения типовых задач.
Пример 1. Какой должна быть навеска чугуна с массовой долей 2% для ее гравиметрического определения ввиде сульфата бария, чтобы при анализе можно было получить 0,5 г осадка?
Решение. Находим фактор пересчета:
F=M(S) / M(BaS04) = 32 / 233,4 =0,1373.
Умножив фактор пересчета на массу весовой формы (масса осадка), получим массу серы; 0,5•0,1337=0,0687 г. Затем вычисляем необходимую массу чугуна для анализа, учитывая массовую долю серы: (0,0687•100) / 2 =3,435 г.
Пример 2. Вычислить объем раствора серной кислоты с массовой долей 4 %, необходимой для осаждения бария из навески 0,3025 г BaCl2 •2H20.
Решение. Записываем уравнение реакции осаждения сульфат бария:
ВaСl2 + H2SO4 → BaS04 + 2НСl;
Определяем массу кислоты, необходимую для осаждения 0,3021 BaCl2 • 2H20.
по пропорции:
244г ВaСl2 •2H20 - 98 г H2SO4
0,3025 г ВaСl2 •2H20 - х г H2SO4
------------------------------------------------------------------------------------- _________________х = (0,3025-98) / 244 =0,1215 (г);
Учитывая массовую концентрацию раствора кислоты, получаем:(0,1225•100) / 4=3,04 г или 3,04 см3 раствора, т.к. плотность раствора с малой концентрацией кислоты близка к 1 г/см3. На практике берут 50% избытка осадителя, т.е. в 1,5 раза больше.
Пример 3. Рассчитать объем осадителя в виде 0,05 М раствора Na2 HPO4 для осаждения магния в виде MgNH4P04 из 100 см3 0,02М paствора MgCl2 с использованием избытка осадителя до 120%.
Решение. Записываем уравнение реакции осаждения:
MgCl2 + Na2НPQ4 + NH4OH → MgNH4PO4 + 2NaCl + H2O
Из уравнения видно, на 1 моль MgCl2 расходуется 1 моль Na2НPQ4. Вычисляем количество MgCl2 в растворе: 0,02•100=0,002 моль. Находим объем раствора Nа2HP04, в котором содержится 0,002 моль этой соли:
V - 0,002 / 0,05 = 0,04 дм3 = 40 см3. С учетом 120% избытка получаем окончательный результат:
V=40•120 /100 = 48 см3.
Пример 4. Для промывания осадка сульфата бария массой 0,5 использовали 250 мл волы. Вычислить массовую долю потерь осадка за счет промывания. 
Решение. Допустим, что при промывании образуется насыщенный раствор ВаSO4. Вычисляем растворимость осадка, исходя из ПР. Принимаем, что [Ва2+]=[SO2-4] = 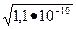 = 1,5•10-5 моль/л, тогда масса осадка, растворившегося в 250 см3 (0,25 дм3) промывной воды, составит: m=1,05•10-5 •0,25•233,4=0,0006г (здесь 233,4- мольная масса ВаSO4 , г/моль).
= 1,5•10-5 моль/л, тогда масса осадка, растворившегося в 250 см3 (0,25 дм3) промывной воды, составит: m=1,05•10-5 •0,25•233,4=0,0006г (здесь 233,4- мольная масса ВаSO4 , г/моль).
Массовая доля потерь осадка составит:
W=(mпотери / mосадка) •100%=0,006•100/0,5=0,12%.
Пример 11. Рассчитать фактор пересчета «F» весовой формы Al2 O3 на Al.
Решение. Находим отношение молярных (атомных) масс определяемого компонента в весовой форме, получаемой в результате анализа. Оно равно:
F=2М(Al)/ М(Al2 O3)=(2•27)/102=0,5197, где М(Al) и М(Al2 O3) -
соответствующие молярные массы.
Пример 12. При гравиметрическом определении свинца из 2,0 г олова получено 0,6048 г PbSQ4. Вычислить массовую долю свинца в сплаве.
Решение. Рассчитаем фактор пересчета F(PbS04) на РЬ:
F = 208 / 304 = 0,6842.
Определим содержание свинца в 0,6048 г PbS04:
m(Pb) - 0,6048-0,6842 - 0,4138 г.
Определим массовую долю свинца в навеске:
W = 0,4138•100 / 2,00 - 20,69%.
Пример 13. Рассчитать массовую долю карбонатов кальция и магния в известняке, если навеска его 0,9866 г. В результате анализаполучено 0,3755 г СаО и 0,4105 г Mg2P2О7.
Решение. Вычислим фактор пересчета СаО на СаCO3:
F = М(CaCO3) / М(СaO)= 100/56 =1,7847.
Находим массу CaCO3, умножая F на СаО:
1,7847•0,3755 =0,6701 Г.
Определяем массовую долю СаСОз в известняке:
W(СаСОз) = 0,6701•100 / 0,9866 = 67,94%.
Аналогично вычисляем массовую долю MgСОз, используя фактор пересчета Mg2P2О7 на MgСОз, массу осадка дифосфата (пирофосфата) магния и навеску известняка, взятую для анализа:
W(MgСОз) =(2•84,03•0,4105•100)/(224,06•0,9866)=31,48%
где: 84, 03 и 224,06 - молярные массы MgСОз и Mg2P2О7 - соответственног/моль; коэффициент, 2- уравнивающий соотношение по магнию для этих двух веществ.
Пример 14. Вычислить число молекул воды в кристаллогидрате ацетата свинца при гравиметрическом анализе, если из его навески 0,3243 г получено 0,2593 сульфата свинца.
Решение. Обозначим молярную массу кристаллогидрата РЬ(СН3 СOO)2•хH2O через М(х). Запишем значения молекулярных масс ацетата свинца, сульфата свинца и воды:
М[РЬ(СН3 СOO)2]=325 г/моль;М (РЬSO4)=303,2 г/моль;
М(H2O)=18 г/моль.
Составим пропорцию и вычислим М(х):
0,2593 г - 0,3243 г 303,2 г
303,2г - М(х)
 М(х) = (302,2-0,3243) / 0,2593=379 г/моль.
М(х) = (302,2-0,3243) / 0,2593=379 г/моль.
Так как М(х) = М[РЬ(СНзСО0)2] + х•М(Н20), находим "х":
х = (379 - 325) /18 = 3.
Таким образом, формула кристаллогидрата - РЬ(СНзСОО)2•ЗН2О.
Пример 15. Для гравиметрического определения хлорида в ка
менной соли пробу в 100 мг растворили в 100 см3 раствора. Расс
читать, какое количество 0,1 М раствора AgNО3 следует добавить к
раствору, чтобы потери вследствие неполноты осаждения хлорида
серебра не превысили 0,001%. Солевой эффект не учитывать.
Решение. Допустим, что соль состоит полностью из NaCl. Определим, сколько миллимолей хлорида натрия содержится в пробе:
n(NaCl) = m(NaCl)/M(NaCl) = 100 мг/(58,44 мг/моль) =1,7 ммоль.
Потери хлорида не должны превышать 0,001 %, т.е.: n(NaCl) = 1,7 ммоль-10-3 % / 100% = 1,7•10-5 ммоль.
Определим эквивалентное количество осадителя AgNO3:
n(NaCl) = n(AgNО3) = C(AgNО3) •V(AgNО3), отсюда
V(AgN03) = n(NaCl)/C(AgN03)=1,7ммоль/(0,1 ммоль/см3)=17смэ .
Таким образом, после добавления эквивалентного количества осадителя об щий объем составил: V=100 см3 + 17 см3= 117 см3.
Допустим, что при добавлении избыточного количества осадителя объем раствора практически не изменится. Тогда максимальное значение концентрации хлорид-иона в растворе не превысит значения: С(Cl-)= n(NaCl)потери / V= 1,7•10-5 ммоль/117 см3 =1,410-5 ммоль/см3 .
Исходя из значения ПР (AgCl)=1,78•10-10, находим концентрацию иона серебра в растворе:
C(Ag+) =ПP(AgCl) / [Сl-] =1,78•10-10 / 1,4•10-7 =
1,3•10-3 ммоль/см3.
Находим избыточное количество раствора нитрата серебра из соотношения: C(Ag NО3) •V(AgNО3) =C(Ag+)•V, отсюда V(AgNО3)изб = (1,3•10-3 ммоль/см3 •117см3)/(0,1ммоль/см3)=1,5 см3
Находим общее количество осадителя:
V = 17 см3 + 1,5 см3 =18,5 см3.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое осаждаемая форма? Какие основные требования
предъявляются к осаждаемой форме?
2. Что такое практически полное осаждение? Какие потери
осадка допустимы в количественном анализе?
3. В виде какого соединения - ВаСОз, BaC2O4 иди BaS04 - болee целесообразно осаждать ионы бария с целью количественного
гравиметрического определения?
4. Каким требованиям должна удовлетворять гравиметрическая
форма осадка?
5. Каким осадителем - раствором NaOH или NH4OH - более
предпочтительно осаждать гидроксиды железа и алюминия и почему?
6. Как влияет соотношение скоростей агрегации и ориентации
на форму и структуру осадка?
7. Какие процессы происходят при созревании кристаллического осадка?
8. Охарактеризуйте условия осаждения кристаллического осадка.
9. Охарактеризуйте адсорбционные свойства аморфных осадков.
10. Что такое коагуляция, пептизация? Какие условия обеспечивают получение хорошо фильтруемого аморфного осадка?
11. Каким требованиям должны удовлетворять реакции, используемые в гравиметрическом анализе?
12. Адсорбция, ее причины. Сравнительная оценка адсорбционных свойств кристаллических и аморфных осадков.
13. Какие факторы влияют на количество адсорбированных примесей в осадке?
14. Как проводится очистка от адсорбированных примесей?
15. Чем руководствуются при выборе промывных жидкостей для промывания осадков в гравиметрическом анализе?
ЗАДАЧИ
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Сущность титриметрического анализа.
2. Закон эквивалентов.
3. Способы выражения концентрации в титриметрическом анализе.
4. Способы приготовления титрованных (стандартных) растворов.
5. Классификация методов титриметрического анализа.
6. Методы титрования.
7. Расчеты в титриметрическом анализе.
А ДАЧИ
УГАЭС
Кафедра Общей химии
Аналитическая химия
(методы химического анализа)
Уфа 2011
УДК 371.385.54
Составители: к.х.н., доцент О.Г.Горлевских
Методические указания: «Аналитическая химия. Методы химического анализа».- Уфа,УГАЭС 2011. 24 с.
Предназначены для студентов заочной формы обучения всех специальностей.
Рецензент:
Методические указания для студентов заочной формы обучения
Ó Издательский центр УГАЭС 2011
Аналитическая химия - наука о методах изучения химического состава вещества. Аналитическая химия включает качественный и количественный анализ. Качественный анализ позволяет определять и идентифицировать состав вещества. Количественный анализ - определять содержание различных компонентов в анализируемой системе.
В качественном и количественном анализе используют химические, физические и физико-химические методы исследования. Химические методы анализа основаны на способности веществ вступать в химические взаимодействия. Физические методы основаны на измерении каких-либо физических параметров веществ. Физико-химические методы основаны на наблюдении за изменением физических свойств веществ, которые происходят в результате химической реакции.
В качественном анализе для обнаружения ионов и молекул используют химические и физико-химические методы.
При количественных определениях применяются химические методы (титриметрический и гравиметрический), физические и физико-химические (атомная и молекулярная абсорбционная спектроскопия, эмиссионный спектральный анализ, флуориметрия, поляриметрия,рефрактометрия, кондуктометрия, потенциометрия; полярография, кулонометрия, хроматография и т.д.). Несмотря на преимущества, которые имеют физические и физико-химические методы по сравнению с химическими методами количественного анализа, последний широко используются в практике научно-исследовательских и заводских лабораторий. Это объясняется простотой методики эксперимента и сочетанием правильности и воспроизводимости результатов анализа.
В настоящем пособии основное внимание уделено химическим методам количественного анализа, имеющим наибольшее значение для работников пищевых предприятий.
Пособие состоит из трех разделов:
1) равновесия в растворах труднорастворимых соединений;
2) гравиметрический анализ;
3) титриметрический анализ.
В начале каждого раздела кратко изложена теория, даны примеры решения задач. В конце каждого раздела приведены контрольные вопросы и задачи для выполнения контрольной работы. Варианты контрольных работ и справочные таблицы помещены в конце пособия.
1. Равновесия в растворах малорастворимых соединений. Растворимость и произведение растворимости.
Ионные равновесия, связанные с образованием осадков, являются обратимыми, подчиняются закону действующих масс и характеризуются константой равновесия, которую принято называть произведением растворимости (ПР). Произведение растворимости - постоянная величина. Она равна произведению активностей ионов в насыщенном растворе малорастворимого электролита.
Например, при образовании осадка хлорида серебра имеет место равновесие, которое описывается уравнением:
AgCl «А g + + С l -
Для приближенных раcчетов произведение растворимости AgCl можно записать в виде следующего выражения:
ПР(AgCl)=[ Ag + ] +[ Cl - ],
так как молярные концентрации ионов в данном случае мало отличаются от их активностей. Таким образом, для любой труднорастворимой соли Мp Aq можно записать в общем виде:
ПР (М p А q) =[ M ] p + [ A ] q
По опытным данным о растворимости труднорастворимых электролитов рассчитывают их произведение растворимости или на основании табличных данных о произведении растворимости решают обратную задачу. При этом необходимо, помнить, что растворимость вещества может быть выражена в любых единицах измерения, а ПР рассчитывается только по концентрациям, выраженным в моль/дм3 или в моль/л.
Все вычисления, связанные с образованием и растворением осадков, выполняют по следующей схеме:
- составляют уравнения диссоциации электролитов;
- составляют ионные уравнения образования осадков;
- записывают выражение ПР в соответствии с ионным уравнени-
ем, описывающим образование осадка и находят значение ПР по таб-
лице;
- вычисляют значения равновесных концентраций ионов по за-
данным концентрациям сильных электролитов или с учетом Кдис. для
слабых электролитов;
- сопоставляя заданные концентрации и условия задачи, составляют алгебраическое уравнение, по которому определяют искомую величину.
Пример1. Вычислить ПР (BaSO4), если его растворимость равна 2,33 мг/л.
Решение: Для вычисления ПР (BaS04)= [Ва2+]•[SO 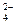 ] необходимо рассчитать концентрацию BaS04 в моль/л. Для этого нужно весовое колическтво соли BaSQ4, равное 2,33 мг, выразить в молях, для чего данное его весовое количество надо разделить на мольную массусульфата бария, т.е. 233,4 г/мол:
] необходимо рассчитать концентрацию BaS04 в моль/л. Для этого нужно весовое колическтво соли BaSQ4, равное 2,33 мг, выразить в молях, для чего данное его весовое количество надо разделить на мольную массусульфата бария, т.е. 233,4 г/мол:
0,00233г: 233,4 г/моль=10-5 моль.
Поскольку концентрация соли BaS04 очень мала, то соль в растворе диссоциирована полностью и тогда концентрация ионов Ba2+ и S0 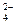 будет равна 10-5 моль/л. Соответственно, произведение
будет равна 10-5 моль/л. Соответственно, произведение
растворимости
ПР(BaSO 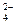 )= [Ва2+]•[SO
)= [Ва2+]•[SO 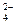 ]= 10-5 • 10-5 = 10-10.
]= 10-5 • 10-5 = 10-10.
Пример 2. Вычислить растворимость СаСО3 в граммах на 100 г насыщенного раствора, если ПР(СаСОз) =1,7•10 -8.
Решение: Записываем уравнение образования осадка:
Сa2+ + CO 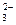 = CaCO3
= CaCO3
Согласно уравнению [Сa 2+]•[ CO 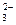 ]= В насыщенном растворе СаСОз равновесные концентрации Са2+ и CO
]= В насыщенном растворе СаСОз равновесные концентрации Са2+ и CO 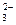 равны; обозначим эту концентрацию "х", т.е. [Сa 2+]•[ CO
равны; обозначим эту концентрацию "х", т.е. [Сa 2+]•[ CO 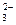 ] =х. Тогда
] =х. Тогда
[Сa 2+]•[ CO 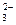 ]=1,7•10 -8 = х2, откуда
]=1,7•10 -8 = х2, откуда
х=  = 1,3•10-4моль/л.
= 1,3•10-4моль/л.
Следовательно, и концентрация СаСОз в насыщенном растворе равна 1,3•10-4 моль/л. Растворимость "а" СаСОз в г получим, умножив мольную концентрацию на молекулярную массу соли:
а=1,3•10-4•100=1,3•10-2 г/л, или 1,3•10-4 /10=1,3•10-3 г/100см3 .
Принимая плотность очень разбавленного раствора равной 1 г/см3, получим, что растворимость СаСОз равна 1,3•10-4г на 100 г раствора.
Радение данной задачи носит приближенный характер.
Условия образования и растворения осадков.
Следствием из определения произведения растворимости является вывод, что осадок выпадает из перенасыщенного раствора, т.е
когда произведение концентраций ионов выше ПР, взятых из справочных таблиц. Если произведение концентраций ионов - меньше ПР, то осадок не выпадает, и при внесении в такой раствор кристалликов твердой фазы этого вещества будет наблюдаться растворение твердого вещества.
Пример 3. Может ли образовываться осадок Mg(OH)2 , если смешать равные объёмы 0,5М раствора MgCl2 и 0,1М раствора NH4 OH?
Решение: За счет увеличения объёма при сливании растворов вдвое следует учитывать уменьшение начальных концентраций также вдвое, т.е. концентрация раствора MgCl2 станет равной 0,5М:2 – 0,25М/л, а концентрация NH4 OH - равной 0,1М:2 – 0,05 М/л.
Уравнения записываются в следующем виде:
Mg+2 + 2OH- «Mg(OH)2
ПР(Mg(OH)2)=[ Mg+2] •[ OH-]2 .
Для ответа на вопрос, выпадает ли в осадок Mg(OH)2 , нужно знать концентрацию ионов Mg+2 и OH- . Концентрацию ионов магния принимаем равной 0,25 моль/л, учитывая, что хлорид магния является сильным электролитом и диссоциирует полностью.
Для вычисления концентрации ионов OH- используют выражение константы диссоциации:
NH4 OH«NH4 + + OH-
К=[ NH4 +]•[ OH-]/[ NH4 OH]=1,8•10-5
Принимаем равновесные концентрации [ NH4 +]=[ OH-]=х и
[ NH4 OH]=0,05-х. Тогда х2 / (0,05-х)= 1,8•10-5 .
Решим уравнение в упрощенном виде, т.е. примем, что 0,05-х=0,05М/л. Теперь находим значение «х»:
х = 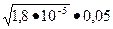 = 9,5•10-4моль/л.
= 9,5•10-4моль/л.
Используя значения концентраций [ Mg+2] =0,25 моль/л и [ OH-]= 9,5•10-4моль/л для вычисления произведения начальных концентраций по выражению для ПР, получим:
[ Mg+2] •[ OH-]2 =0,25•(9,5•10-4)2 =2,25•10-7 .
Полученную величину сравниваем с табличным значением ПР(Mg(OH)2)= 5,2•10-12 . Очевидно, что рассчитанное произведение концентраций превышает табличное значение ПР(Mg(OH)2), следовательно, раствор пересыщен, и осадок должен выпадать.
Пример 4. При каком значении рН начнется выпадение осадка Fe(OH)2 из 0,1 М раствора FeSO4 при добавлении раствора NaOH?
Решение: Образование осадка описывается уравнением:
Fe2+ + 2OH- «Fe(OH)2 ,
для которого выполняется условие
ПР(Fe (OH)2)=[ Fe 2+] •[ OH-]2 =1,1•10-15.
Принимая, что соль FeSO4, как сильный электролит, в растворе диссоциирует полностью, равновесная концентрация ионов [Fe2+]=0,1 моль/л.Исходя из выражени я П P (Fe (OH)2) по лучаем: 10-1]•[ОН-]2= 1,1•10-15; [ОН-]= 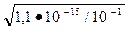 =10-7 моль/л.
=10-7 моль/л.
Учитывая, что рН=-lg [Н+],а [H+]•ОH-]=10-14, найдем, что концентрация ионов водорода равна 10-14/10-7моль/л и рН соответственно равно -lg•10-7=7
Таким образом, при pH=7 начинается выпадение осадка Fe(OH)2 из 0,1 М раствора FeSO4 при добавлении NaOH.
Растворимость в присутствии одноименных ионов.
Пользуясь табличными значениями ПР, можно рассчитать растворимость осадков труднорастворимых соединений в присутствии одноименных ионов. Высокая концентрация этих ионов в растворе может быть обусловлена добавлением избытка осадителя. Как правило, действие одноименного иона выражается в резком понижении растворимости.
Пример 5. Вычислить растворимость осадка BaS04 в 0,1М растворе серной кислоты ПР (BaSO4)=1,1•10-10 .
Решение. В растворе происходят процессы, описываемые уравнениями:
BaS04=Ba2++S0 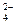 (растворение осадка);
(растворение осадка);
H2SO4=2H++SO 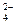 (диссоциация кислоты).
(диссоциация кислоты).
Обозначим молярные концентрации ионов Ва2+ и SO 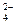 , образующихся при растворении BaSO4 через «х».Кроме того, ионы SO
, образующихся при растворении BaSO4 через «х».Кроме того, ионы SO 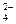 образуются вследствие полной диссоциации кислоты, т.е. 0,1 моль/л. Таким образом, общая концентрация сульфат-ионов равна (х+0,1)моль/л. Концентрация ионов Ba2+ равна х моль/л. Тогда ПР(BaSO4)=х•(х + 0.1)=1,1•10-10, откуда х= 1,1•10-10 /(х + 0,1).
образуются вследствие полной диссоциации кислоты, т.е. 0,1 моль/л. Таким образом, общая концентрация сульфат-ионов равна (х+0,1)моль/л. Концентрация ионов Ba2+ равна х моль/л. Тогда ПР(BaSO4)=х•(х + 0.1)=1,1•10-10, откуда х= 1,1•10-10 /(х + 0,1).
Поскольку х< < 0,1, решение можно упростить:
х=1,1•10-10 / 0,1=1,1•10-9 моль/л.
Концентрация растворенных молекул ВаS04 равна равновесной концентрации ионов бария (1,1•10-9 моль/л) в растворе (это следует из уравнения диссоциации). Тогда растворимость "а " осадка сульфата бария можно определить из уравнения:
а(ВаSО4)= 1,1•10-9 моль/л• 223,4 г/моль = 2,57 •10-7 г/л = 2, 57 •10-4мг/л.
Сравнивая полученное значение с растворимостью сульфата бария (2,33 мг/л), находим, что растворимость сульфата бария снизилась почти в десять тысяч раз.
Последовательность образования осадков малорастворимых соединений.
Очередность выпадения осадков из раствора, в которых находится ряд ионов, способных к образованию труднорастворимых веществ с одним и тем же ионом-осадителем, также связана с их произведением растворимости. Первым выпадает в осадок то вещество, ПР котоpoго достигается раньше, или у которого ПР меньше по величине. Например, для однотипных соединений, таких как AgCl, AgBr, Agl, AgCNS, очередность определяется простым сопоставлением ПР этих соединении, т.е. сравнивают табличные данные ПР:
| Вещество
|
| ПР
|
| AgCl
| 1
| 1,6•10-10
|
| AgBr
| 7
| 7,7•10-13
|
| Agl
| 1
| 1,5•10-16
|
| AgCNS
| 1
| 1,16•10-12
|
Таким образом, ПP(AgCl) >ПР(AgCNS) > ПР (AgBr) > ПP(Agl).
Отсюда ясно, что осаждаться указанные соединения серебра будут в обратной последовательности: сначала йодид, затем - бромид и т.д., если они находятся в одинаковых условиях.
Если концентрации одноименных ионов равны, то задачи такого типа решаются на основании расчетов.
Пример 6. При каких значениях рН и какой из осадков -Fе(ОН)3 или Мn(ОН)2 - будет выпадать первым при постепенном прибавлении раствора NaOH к смеси, содержащей 0,1 моль/л МnСl2 и 0,001 моль/л FeCl3?
Решение. ПР(Мn(ОН)2)= 4•10-14,ПР(Fе(ОН)3) = 3,8•10-38.
Учитывая, что МnСl2 и FeCl3 - сильные электролиты, считаем концентрацию [Mn2+] = 0,01 моль/л и [Fe3+] = 0,001 моль/л. Записываем выражения для ПР:
ПР(Мn(ОН)2) = [Mn2+]•[ОН-]2; ПР(Fе(0Н)з) = [Fe3+]•[ОН-]3.
Подставляем в эти выражения значения концентраций конов [Мn2+] и [Fe3+] и находим концентрацию гидроксильных ионов для каждогоуравнения:
0,1•[OH-] 2 =4,0 •10-14 дл я Mn(OH)2;
[ОН-] = 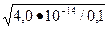 = 6.3•10-7 моль/л;
= 6.3•10-7 моль/л;
0,001•[OH-] 3= 3,8•10-38 для Fe(0H)3;
[OH-]= 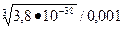 = 3,4•10-12 моль/л.
= 3,4•10-12 моль/л.
Таким образом, для выпадения осадка Fe(OH)3 нужна меньшая концентрация ионов ОН- и Fe(OH)3 будет выпадать в осадок первым.
Для начала осаждения Mn(OН)2 нужна концентрация [OН-] =6,3•10-7 моль/л, при этом рОН = - lg 6,3•10-7 = 6,2, а, соответственно, рН= 14 - 6,2 = 7,8.
Для начала осаждения Fe(0H)3 нужна концентрация [OН-] =3.4•10-12 моль/л, при этом рОН = - lg 3,4•1O-12 = 11,47. Отсюда pH= 14 - 11,47 = 2,53.
К О Н Т P О Л Ь Н Ы Е ВОПРОСЫ
1. Каким образом произведение растворимости труднорастворимого
соединения связано с его растворимостью?
2. Условия выпадения осадков.
3. Как рассчитать концентрацию иона-осадителя с помощью ПР?
4. Условия растворения труднорастворимых соединений.
ЗАДАЧИ



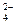 ] необходимо рассчитать концентрацию BaS04 в моль/л. Для этого нужно весовое колическтво соли BaSQ4, равное 2,33 мг, выразить в молях, для чего данное его весовое количество надо разделить на мольную массусульфата бария, т.е. 233,4 г/мол:
] необходимо рассчитать концентрацию BaS04 в моль/л. Для этого нужно весовое колическтво соли BaSQ4, равное 2,33 мг, выразить в молях, для чего данное его весовое количество надо разделить на мольную массусульфата бария, т.е. 233,4 г/мол: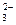 = CaCO3
= CaCO3 = 1,3•10-4моль/л.
= 1,3•10-4моль/л.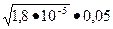 = 9,5•10-4моль/л.
= 9,5•10-4моль/л.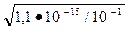 =10-7 моль/л.
=10-7 моль/л.
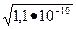 = 1,5•10-5 моль/л, тогда масса осадка, растворившегося в 250 см3 (0,25 дм3) промывной воды, составит: m=1,05•10-5 •0,25•233,4=0,0006г (здесь 233,4- мольная масса ВаSO4 , г/моль).
= 1,5•10-5 моль/л, тогда масса осадка, растворившегося в 250 см3 (0,25 дм3) промывной воды, составит: m=1,05•10-5 •0,25•233,4=0,0006г (здесь 233,4- мольная масса ВаSO4 , г/моль). М(х) = (302,2-0,3243) / 0,2593=379 г/моль.
М(х) = (302,2-0,3243) / 0,2593=379 г/моль. образуются вследствие полной диссоциации кислоты, т.е. 0,1 моль/л. Таким образом, общая концентрация сульфат-ионов равна (х+0,1)моль/л. Концентрация ионов Ba2+ равна х моль/л. Тогда ПР(BaSO4)=х•(х + 0.1)=1,1•10-10, откуда х= 1,1•10-10 /(х + 0,1).
образуются вследствие полной диссоциации кислоты, т.е. 0,1 моль/л. Таким образом, общая концентрация сульфат-ионов равна (х+0,1)моль/л. Концентрация ионов Ba2+ равна х моль/л. Тогда ПР(BaSO4)=х•(х + 0.1)=1,1•10-10, откуда х= 1,1•10-10 /(х + 0,1).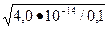 = 6.3•10-7 моль/л;
= 6.3•10-7 моль/л;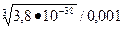 = 3,4•10-12 моль/л.
= 3,4•10-12 моль/л.


