Свойства простых веществ — металлов и неметаллов
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества - металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до 3000°С; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: 1s22s22p63s13p03d0, где 3s,3p,3d — валентные орбитали.
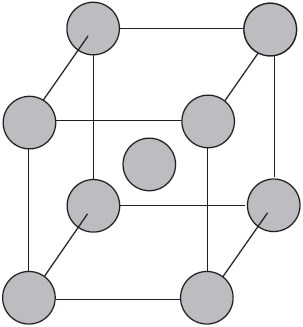
Единственный валентный электрон атома натрия 3s1 может занимать любую из девяти свободных орбиталей — 3s (одна), 3р (три) и 3d (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).

Кальций и его соединения.
| Кальций
| Оксид и гидроксид кальция
| Соли кальция
|
| 1. Серебристо-белый металл. 2. Активный металл, окисляется простыми веществами — неметаллами: 2Ca+O2=2CaO Ca+Cl2=CaCl2 Ca+S=CaS Ca+H2=CaH2 3. Вытесняет водород из воды: Ca+2H2O=Ca(OH)2+H2↑ 4. Вытесняет металлы из их оксидов (кальциотермия): 2Ca+ThO2=Th+2CaO Получение Разложение электрическим током расплава хлорида кальция: CaCl2=Ca+Cl2↑
| 1. Порошки белого цвета. 2. Оксид кальция (негашеная известь) проявляет свойства основного оксида: а) взаимодействует с водой с образованием основания: CaO+H2O=Ca(OH)2 б) взаимодействует с кислотными оксидами: CaO+SiO2=CaSiO3 3. Гидроксид кальция проявляет свойства сильного основания: Ca(OH)2=Ca2++2OH– Ca(OH)2+CO2=CaCO3↓+H2O; Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O$ Получение 1. Оксида — обжиг известняка: CaCO3=CaO+CO2↑ 2. Гидроксида — гашение негашеной извести: CaO+H2O=Ca(OH)2
| 1. Образует нерастворимый карбонат: Ca2++CO32−=CaCO3↓ и растворимый гидрокарбонат: CaCO3(кр)+CO2+H2O=Ca(HCO3)2(р−р) 2. Образует нерастворимый фосфат: 3Сa2++2PO43−=Ca3(PO4)2↓ и растворимый дигидрофосфат: Ca3(PO4)2(кр)+4H3PO4=3Ca(H2PO4)2(р−р) 3. Гидрокарбонат разлагается при кипячении или испарении раствора: Ca(HCO3)2=CaCO3↓+CO2↑+H2O 4. Обожженный природный гипс: CaSO4·2H2O=CaSO4·0,5H2O+1,5H2O затвердевает при взаимодействии с водой, снова образуя кристаллогидрат: CaSO4·0,5H2O+1,5H2O=CaSO4·2H2O
|
Алюминий и его соединения.
| Алюминий
| Соединения алюминия
|
| Оксид алюминия
| Гидроксид алюминия
|
| 1. Серебристо-белый легкий металл. 2. Окисляется на воздухе с образованием защитной пленки: 4Al+3O2=2Al2O3 3. Вытесняет водород из воды: 2Al+6H2O=2Al(OH)3↓+3H2↑ 4. Взаимодействует с кислотами: 2Al0+6H+=2Al3++3H20↑ 5. Взаимодействует с водным раствором щелочи: 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ 6. Вытесняет металлы из их оксидов (алюминотермия): 8Al+3Fe3O4=9Fe+4Al2O3+Q Получение Разложение электрическим током расплава оксида алюминия (в криолите): 2Al2O3=4Al+3O2↑–3352кДж
| 1. Очень твердый порошок белого цвета 2. Амфотерный оксид, взаимодействует: а) с кислотами: Al2O3+6H+=2Al3++3H2O б) со щелочами: Al2O3+2OH–=2AlO2−+H2O Образуется: а) при окислении или горении алюминия на воздухе: 4Al+3O2=2Al2O3 б) в реакции алюминотермии: 2Al+Fe2O3=Al2O3+2Fe; в) при термическом разложении гидроксида алюминия: 2Al(OH)3=Al2O3+3H2O
| 1. Белый нерастворимый в воде порошок. 2. Проявляет амфотерные свойства, взаимодействует: а) с кислотами: Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O б) со щелочами: Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH–=AlO2−+2H2O 3. Разлагается при нагревании: 2Al(OH)3=Al2O3+3H2O Образуется при: а) взаимодействии растворов солей алюминия с растворами щелочей (без избытка): Al3++3OH–=Al(OH)3↓ б) взаимодействии алюминатов с кислотами (без избытка): AlO2−+H++H2O=Al(OH)3↓ Соли алюминия в водных растворах гидролизуются: Al3++H2O⇄AlOH2++H+ AlOH2++H2O⇄Al(OH)2++H+ Al(OH)2++H2O⇄Al(OH)3+H+
|
Химические свойства меди
Медь (Cu) — элемент побочной подгруппы первой группы. Электронная формула: (...3d104s1). Десятый d-электрон атома меди подвижный, т. к. переместился с 4s-подуровня. Медь в соединениях проявляет степени окисления +1(Cu2O) и +2(CuO).
Медь — мягкий, блестящий металл, имеющий красную окраску, ковкий и обладает хорошими литейными качествами, хороший тепло- и электропроводник. Температура плавления 1083°С.
Как и другие металлы побочной подгруппы I группы Периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями:
Cu+2H2SO4(конц.)=CuSO4+SO2↑+2H2O;
Cu+4HNO3(конц.)=Cu(NO3)2+2NO2↑+2H2O.
Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид CuO черного цвета и воду:
Cu2++2OH–=Cu(OH)2↓;Cu(OH)2
CuO+H2O
Химические свойства цинка
Цинк (Zn) — элемент побочной подгруппы II группы. Его электронная формула следующая: (...3d104s2). Так как в атомах цинка предпоследний d−подуровень полностью завершен, то цинк в соединениях проявляет степень окисления +2.
Цинк — металл серебристо-белого цвета, практически не изменяющийся на воздухе. Обладает коррозионной стойкостью, что объясняется наличием на его поверхности оксидной пленки.
Цинк — один из активнейших металлов, при повышенной температуре реагирует с простыми веществами:
Zn+Cl2
ZnCl2,
2Zn+O2
2ZnO,
Zn+S
ZnS.
Цинк вытесняет водород из кислот:
Zn+2Н+=Zn2++H2↑
Гидроксид цинка амфотерен, т. е. проявляет свойства и кислоты, и основания. При постепенном приливании раствора щелочи к раствору соли цинка выпавший вначале осадок растворяется (то же происходит и с алюминием):
ZnSO4+2NaOH=
↓+Na2SO4,
Zn(OH)2+2NaOH=
| Na2[Zn(OH)4]
|
| тетрагидроксоцинкатнатрия
|
Химические свойства хрома
На примере хрома (Cr) можно показать, что свойства переходных элементов меняются вдоль периода не принципиально: происходит количественное изменение, связанное с изменением числа электронов на валентных орбиталях. Максимальная степень окисления хрома +6. Металл в ряду активности стоит левее водорода и вытесняет его из кислот:
Cr+2H+=Cr2++H2↑.
При добавлении раствора щелочи к такому раствору образуется осадок Me(OH)2, который быстро окисляется кислородом воздуха:
4Cr(OH)2+O2+2H2O=4Cr(OH)3.
Ему соответствует амфотерный оксид Cr2O3. Оксид и гидроксид хрома (в высшей степени окисления) проявляют свойства кислотных оксидов и кислот соответственно. Соли хромовой кислоты (H2CrO4) в кислой среде превращаются в дихроматы — соли дихромовой кислоты (H2Cr2O7). Окисление сопровождается изменением окраски, т.к. соли хроматы желтого цвета, а дихроматы — оранжевого.
2CrO42−+H+⇄Cr2O72−+H2O
Соединения хрома обладают высокой окислительной способностью.
Химические свойства железа
Железо (Fe) — элемент побочной подгруппы VIII группы и 4-го периода Периодической системы. Как и положено металлу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. Распределение электронов таково: 2
;8
;14
;2
. Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но и электрон с предпоследнего уровня, при этом степень окисления повышается до +3.
Железо — металл со всеми характерными свойствами металлов: высокими тепло- и электропроводностью, ковкостью, металлическим блеском, высокой t°пл=1540°С и плотностью ρ=7,85
. Железо образует сплавы с неметаллами (углеродом) и другими металлами. Железо может намагничиваться, оно обладает ферромагнетизмом. Для железа характерны два ряда соединений: соединения железа (II) и железа (III). Химические свойства железа и его соединений приведены в таблице. Железо входит в состав крови человека (гемоглобин), содержится оно и в некоторых растениях: шпинате, салате, капусте.
Роль железа в жизни человека общеизвестна, об этом можно не говорить. Железо — это основа всей современной цивилизации.
Железо и его соединения.
| Железо
| Оксиды железа (II) и (III)
| Гидроксиды железа (II) и (III)
|
| 1. Серебристо-белый металл. 2. Взаимодействует с простыми веществами: а) горит в кислороде: 3Fe+2O2=Fe3O4 б) реагирует с хлором: 2Fe+3Cl2=2FeCl3 в) взаимодействует с серой: Fe+S=FeS 3. Реагирует с растворами кислот: Fe+2H+=Fe2++H2↑ 4. Вытесняет водород из воды при сильном нагревании: Fe+H2O=FeO+H2↑ 5. Окисляется в присутствии воды и кислорода воздуха (с образованием ржавчины): 4Fe+6H2O+3O2=4Fe(OH)3 6. Замещает менее активный металл в растворе его соли: Fe+Cu2+=Fe2++Cu Получение Восстановление оксидов железа оксидом углерода (II), водородом или алюминием: Fe3O4+4CO=3Fe+4CO2 FeO+H2=Fe+H2O Fe2O3+2Al=2Fe+Al2O3
| 1. Проявляют основные свойства, взаимодействуя с кислотами: FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: MnO+Fe2O3=Mn(FeO2)2
| 1. Проявляют свойства нерастворимых в воде оснований: а) взаимодействуют с кислотами: Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O б) разлагаются при нагревании: Fe(OH)2=FeO+H2O 2Fe(OH)3=Fe2O3+3H2O 2. Гидроксид железа (III) проявляет слабые амфотерные свойства, реагируя с горячими концентрированными растворами щелочей: Fe(OH)3+NaOH=NaFeO2+2H2O 3. Гидроксид железа (II) на воздухе окисляется в гидроксид железа (III): 4Fe(OH)2+O2+2H2O=4Fe(OH)3 4. Соли железа (II) и (III) гидролизуются: Fe2++H2O⇄FeOH++H+; Fe3++H2O⇄FeOH2++H+
|
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне 6
, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления +2,+4,+6. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления –2.
Сера (S) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера S8 — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с t°пл=112,8°С. Моноклинная сера имеет игольчатые кристаллы с t°пл=119,3°С, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при 160°С серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
Сера
Соединения серы
| | Оксиды серы
| Серная кислота
|
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: S+O2=SO2 (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: Fe+S=FeS H2+S=H2S (проявляет окислительные свойства) В природе самородная сера S, сульфиды: FeS2(пирит), CuS; сульфаты: CaSO4·2H2O (гипс), Na2SO4
| 1. При обычных условиях SO2 — газ, SO3 — жидкое вещество (t°пл=16,8°С). 2. Проявляют свойства кислотных оксидов, взаимодействуя: - с водой: SO2+H2O⇄H2SO3 SO3+H2O=H2SO4 - со щелочами: SO2+2NaOH=Na2SO3+H2O SO3+2NaOH=Na2SO4+H2O - с основными оксидами: SO3+CaO=CaSO4 Получение: 1) оксида серы (IV) а) в промышленности: - горение серы S+O2=SO2 - обжиг пирита 4FeS2+11O2=2Fe2O3+8SO2 б) в лаборатории: Na2SO3+H2SO4=Na2SO4+SO2↑+H2O; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): 2SO2+O2=2SO3
| 1. При обычных условиях — бесцветная тяжелая жидкость (ρ≈2
м3), неограниченно растворимая в воде.
2. Сильная двухосновная кислота:
H2SO4=H++HSO4−⇄2H++SO42−
3. Взаимодействует с металлами:
Zn+H2SO4=ZnSO4+H2↑
В концентрированной кислоте пассивируются Al и Fe.
4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами:
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+Cа(OH)2=CаSO4+2H2O
3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O
5. Взаимодействует с основными и амфотерными оксидами:
H2SO4+CuO=CuSO4+H2O
H2SO4+ZnO=ZnSO4+H2O
6. Концентрированная кислота гигроскопична:

Получение в промышленности в соответствии со схемой:
FeS2(илиS)
SO2
SO3
H2SO4
|
Химические свойства азота.
Азот (N) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления –3 в соединениях с водородом (аммиак NH3) и с металлами (нитриды Li3N,Mg3N2).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления +3 и +5. Атомы азота проявляют восстановительные свойства в степенях окисления +1,+2,+4.
Азот существует в свободном состоянии в виде молекулы N2, атомы связаны прочной ковалентной связью N≡N. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится 78%. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли (NH4NO3,KNO3) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
Азот
Соединения азота
| | Аммиак
| Оксиды азота
| Азотная кислота
|
1. Очень прочная и поэтому малореакционноспособная молекула.
2. Проявляет окислительные свойства (в реакциях с водородом и металлами):
N2+3H2⇄2NH3
$N_2+3Mg=Mg_3N_2
3. Проявляет восстановительные свойства (в реакции с кислородом):
N2+O2=2NO
Получение
1. В промышленности ректификацией жидкого воздуха.
2. В лаборатории термическим разложением нитрита аммония:
NH4NO2
N2+2H2O
| 1. При н.у. бесцветный, резко пахнущий газ.
2. Взаимодействует с водой, образуя раствор слабого основания:
NH3+H2O⇄NH4++OH–
3. Схема электронного строения иона аммония:

4. Взаимодействует с кислотами:
NH3+H+=NH4+
5. Проявляет восстановительные свой ства:
2NH3+3CuO
3Cu+3H2O+N2
4NH3+3O2=2N2+6H2O
4NH3+5O2
4NO+6H2O
Получение
1. В промышленности:
N2+3H2⇄2NH3+92кДж
2. В лаборатории:
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
| 1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
2NO+O2=2NO2
2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода:
4NO2+O2+2H2O=4HNO3
Образуются при взаимодействии:
1) азота с кислородом при высокой температуре или в условиях электрического разряда:
N2+O2=2NO
2) аммиака с кислородом в присутствии катализатора:
4NH3+5O2
4NO+6H2O;
3) меди с азотной кислотой:
а) концентрированной:
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
б) разбавленной:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
| 1. Неустойчива, разлагается под действием света:
4HNO3=2H2O+4NO2↑+O2↑
2. Является сильной кислотой, диссоциирует необратимо в водном растворе:
HNO3+H2O=H3O++NO3−
3. Взаимодействует с основными оксидами:
CаO+2HNO3=Cа(NO3)2+H2O
CаO+2H+=Cа2++H2O
4. Взаимодействует с основаниями:
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O
Fe(OH)3+3H+=Fe3++3H2O
5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла.
Получение
1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом:
4NO2+O2+2H2O=4HNO3
2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании:
2NaNO3,кр+H2SO4=2HNO3+Na2SO4
|
Фосфор и его соединения.
Фосфор
Соединения фосфора
| | Оксид фосфора (V)
| Фосфорная кислота
|
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде:
4P+5O2=2P2O5
(проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре:
P4+3O2=2P2O3
Получение
2Ca3(PO4)2+10C+6SiO2=P4↑+10CO↑+6CaSiO3–Q
| 1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя
- с водой:
P2O5+3H2O=2H3PO4
- со щелочами:
P2O5+6NaOH=2Na3PO4+3H2O
- с основными оксидами:
P2O5+3CaO=Ca3(PO4)2
Получение
Сжигание фосфора в избытке воздуха:
4P+5O2=2P2O5
| 1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота:
H3PO4⇄H++H2PO4−⇄2H++HPO42−⇄3H+PO43−
3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком:
H3PO4+3NaOH=Na3PO4+3H2O
H3PO4+2NaOH=Na2HPO4+2H2O
H3PO4+NH3=NH4H2PO4
H3PO4+2NH3=(NH4)2HPO4
4. Взаимодействует с основными оксидами:
2H3PO4+3CaO=Ca3(PO4)2+3H2O
5. Взаимодействует с фосфатом кальция, образуя дигидрофосфат (двойной суперфосфат):
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
Получение в промышленности:
1) по реакции оксида фосфора (V) с водой:
P2O5+3H2O=2H3PO4;
2) по реакции фосфата кальция с серной кислотой при нагревании:
Ca3(PO4)2+3H2SO4
3CaSO4+2H3PO4
|
Углерод и его соединения.
Углерод
Соединения углерода
| | Оксид углерода (IV)
| Угольная кислота
|
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: C+O2=CO2+Q неполное сгорание: 2C+O2=2CO+Q; б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: C+CO2=2CO; в) восстанавливает металлы из их оксидов: C+2CuO=CO2+2Cu Получение Неполное сжигание метана: CH4+O2=C+2H2O
| 1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: CO2+H2O⇄H2CO3 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): CO2+Ca(OH)2=CaCO3↓+H2O 5. Реагирует с основными оксидами: CO2+CaO=CaCO3 6. Образуется в реакциях: - горения углерода в кислороде: C+O2=CO2 - окисления оксида углерода (II): 2CO+O2=2CO2 - сгорания метана: CH4+2O2=CO2+2H2O - взаимодействия кислот с карбонатами: CaCO3+2HCl=CaCl2+CO2↑+H2O - термического разложения карбонатов и гидрокарбонатов: CaCO3=CaO+CO2↑ 2NaHCO3=Na2CO3+CO2↑+H2O - окислительных биохимических процессов дыхания, гниения
| 1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: CO2+H2O⇄H2CO3⇄H++HCO3−⇄2H++CO32− 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: CO2+NaOH=NaHCO3 CO2+2NaOH=Na2CO3+H2O 3. Вытесняется из солей более сильными кислотами: CaCO3+2HCl=CaCl2+CO2↑+H2O 4. Соли угольной кислоты подвергаются гидролизу: 2Na++CO32−+H2O⇄2Na++HCO3−+OH– CO32−+H2O⇄HCO3−+OH–
|
Кремний и его соединения.
Кремний
Соединения кремния
| | Оксид кремния (IV)
| Кремниевая кислота
|
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: Si+O2=SiO2+Q Получение - Восстановление оксида кремния (IV) углеродом (в промышленности): SiO2+2C=Si+2CO - порошком магния (в лаборатории): SiO2+2Mg=Si+2MgO
| 1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: SiO2+2NaOH=Na2SiO3+H2O; б) основными оксидами: SiO2+CaO=CaSiO3 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): SiO2+Na2CO3=Na2SiO3+CO2↑ SiO2+CaCO3=CaSiO3+CO2↑
| 1. Очень слабая двухосновная не растворимая в воде кислота состава mSiO2·nH2O(H2SiO3) 2. Разлагается уже при несильном нагревании: H2SiO3=SiO2+H2O 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: 4Na++2SiO32−+2H2O⇄4Na++Si2O52−+2OH– 2SiO32−+2H2O⇄Si2O52−+2OH– Получение Действие кислот на растворимые силикаты: Na2SiO3+2HCl=2NaCl+H2SiO3↓
|
·
·
·
·
·
Свойства простых веществ — металлов и неметаллов










