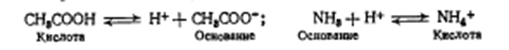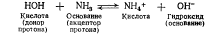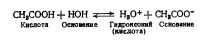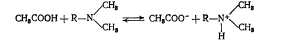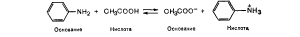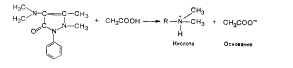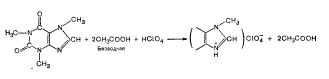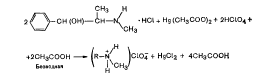Метод нитритометрии основан на реакциях диазотирования и окисления — восстановления. Этот метод применяется для количественного определения соединений, содержащих открытые или блокированные первичные ароматические аминогруппы в ароматических или гетероциклических ядрах. Соединения, содержащие блокированные аминогруппы, предварительно подвергают гидролизу, а затем определяют по общей методике нитрометрического титрования.
Методом нитритометрии определяют также препараты, содержащие нитрогруппу, которую переводят в аминогруппу путем восстановления.
Этот метод используется в анализе лекарственных препаратов стрептоцида, норсульфазола, сульфадимезина, левомицетина, фолиевой кислоты, дикаина, фтивзида, изониазида, новокаина и др.
Рабочим раствором в методе нитритометрии является нитрит натрия.
Для установки титра нитрита натрия вначале к определенному количеству раствора нитрита натрия прибавляют точно отмеренный объем титрованного раствора перманганата калия. Этот объем должен быть значительно больше, чем нужно для полного окисления нитрит-ионов.
Методика. Если не указано иначе, точную навеску образца лекарственного средства, указанную в фармакопейной статье, растворяют в смеси 10 мл воды и 10 мл хлористоводородной кислоты разведенной 8,3 %. Прибавляют воду до общего объема 80 мл, 1 г калия бромида и при постоянном перемешивании титруют натрия нитрита раствором 0,1 М. В начале титрования прибавляют раствор натрия нитрита со скоростью 2 мл/мин, а в конце (за 0,5 мл до эквивалентного количества) – 0,05 мл/мин.
Титрование проводят при температуре раствора 15 — 20 ºС, однако в некоторых случаях требуется охлаждение до 0 — 5 ºС.
При потенциометрическом титровании в качестве индикаторного применяют платиновый электрод, в качестве электродов сравнения используют хлорсеребряный или насыщенный каломельный электрод.
При амперометрическом титровании на электроды накладывают разность потенциалов 0,3 — 0,4 В, если не указано иначе в фармакопейной статье.
Точку эквивалентности определяют электрометрическими методами (потенциометрическое титрование, титрование «до полного прекращения тока») или с помощью внутренних индикаторов и внешнего индикатора (йодкрахмальная бумага).
В качестве внутренних индикаторов используют тропеолин ОО (4 капли раствора), тропеолин ОО в смеси с метиленовым синим (4 капли раствора тропеолина ОО и две капли раствора метиленового синего), нейтральный красный (две капли в начале и две капли в конце титрования).
Титрование с тропеолином ОО проводят до перехода окраски от красной к желтой, со смесью тропеолина ОО с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин.
Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления натрия нитрита раствора 0,1 М, не будет немедленно вызывать синее окрашивание на бумаге. В некоторых случаях выдержка может быть увеличена, о чем должно быть указано в фармакопейной статье.
Параллельно проводят контрольный опыт.
96Метод количественного определения веществ в неводных средах. Титрование в среде ледяной уксусной кислоты. Особенности.
Метод кислотно-основного титрования в неводных средах.
Этот метод имеет определенные преимущества перед титрованием в водных средах и поэтому включен в ГФ X.
Основное преимущество этого метода заключается прежде всего в том, что он позволяет титровать с достаточной четкостью не только сильные кислоты и основания, но также слабые, очень слабые кислоты, основания, их соли и многокомпонентные смеси часто без их предварительного разделения. Так, этот метод позволяет определять физиологически активную часть в солях алкалоидов. Кроме того, методом неводного титрования можно определять вещества, плохо растворимые в воде. Нахождение точки конца титрования в неводных средах может осуществляться индикаторным, потенциометрическим, «кондуктометрическим, амперометрическим и другим методами.
Титрование можно проводить как бесцветных, так и окрашенных растворов. Метод неводного титрования дает более точные результаты по сравнению с точностью титрования водных растворов, так как вследствие небольшого, как правило, поверхностного натяжения органических растворителей размеры капель неводных жидкостей меньше размеров капель водных растворов.
В теории неводного титрования большое значение имеет влияние характера растворителя и природы растворенного вещества на взаимодействие между ионами и молекулами растворителя и растворенного в нем вещества.
Характер растворителя особенно сказывается на кислотно-основных свойствах растворенного вещества.
В течение длительного времени придерживались теории электролитической диссоциации Аррениуса, согласно которой «кислота» определялась, как водородсодержащее соединение, которое в водном растворе образует ионы водорода Н+, а «основание»- гидроксидсодержащее вещество, которое в водном растворе •образует ион гидроксида ОН-. Однако эта теория оказалась не-•состоятельной, поскольку многие органические соединения проявляют в реакциях основные свойства, но гидроксида в молекуле не имеют (например, пиридин, амидопирин, основания алкалоидов). Аналогично, есть вещества, не содержащие в молекуле водорода, например хлорид алюминия, но в эфире это вещество реагирует с основаниями и, следовательно, проявляет кислотные свойства. Это явление не могло быть объяснено с позиций теории электролитической диссоциации Аррениуса, поэтому появились новые теории кислот и оснований, из которых наиболее приемлемой оказалась протонная (протолитическая) теория Бренстеда - Лоури.
Согласно этой теории «кислота» определяется, как соединение, стремящееся отдать 'Протон Н+ (донор протона), а «основание» - соединение, стремящееся присоединить протон (акцептор протона). Например::
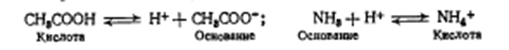
Отдача протона кислотой или присоединение протона основанием является обратимым процессом.
8-оксихинолин может рассматриваться как кислота:
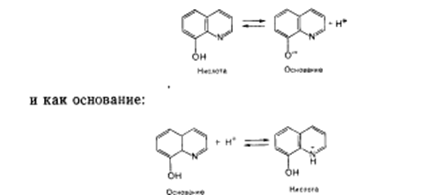
Но свободные протоны в растворах существовать не могут,. они только переходят от кислоты к какому-либо основанию, способному эти протоны принять.
Поэтому в растворе всегда протекает два процесса:
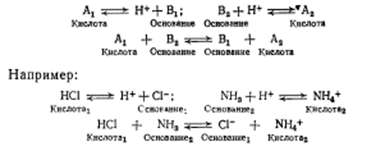
Кислота! Основание^ Основание! Кислота
Таким образом, каждая кислота имеет сопряженное с нею основание и каждое основание сопряженную с ним кислоту.
Иногда некоторые вещества (или ионы) в присутствии одного растворителя проявляют свойства кислот, в присутствии другого - свойства оснований. Такой двойственный (амфотер-ный, или амфипротный) характер проявляет, например, вода.. В присутствии жидкого аммиака она является кислотой, так: как в реакции есть вещество (NH3), которое может приняты протон, и вода его отщепляет.
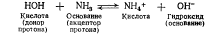
Та же вода в реакции с уксусной кислотой СНзСООН играет роль основания, так как уксусная кислота отщепляет протон Н+, который присоединяет вода, превращаясь в гидроксоний (кислоту).
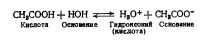
Следовательно, кислотность и основность определенного вещества изменяется в зависимости от основности и кислотности среды, в которую оно помещено.
Согласно протолитической теории Бренстеда - Лоури реакция нейтрализации рассматривается как переход протона от кислоты к основанию.
Такие реакции принято называть реакциями протолиза. Они имеют особенно большое значение для понимания процессов, происходящих в неводных средах.
Растворители как органические, так и неорганические также обладают свойством диссоциировать на ионы, аналогичные ионам воды. При этом ионы водорода (протоны) соединяются с молекулами растворителя, образуя комплексные ионы гидрок-сония, аммония, ацетония и т. п.
Например:
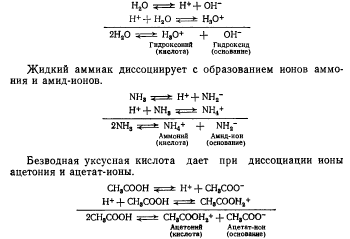
Следовательно, кислотность обусловливается: в водном растворе- ионами гидроксония Н30+, в жидком аммиаке - ионами аммония NH4+, в безводной уксусной кислоте - ионами ацетония СН3СООН2+.
Щелочность обусловливается: в водном растворе - гидрок сид-ионами ОН-, в жидком аммиаке - амид-ионами NH2-, i безводной уксусной кислоте - ацетат-ионами СНзСОО-.
Таким образом, протонная теория изменила старые пред ставления о кислотах и основаниях.
К кислотам, согласно этой теории, стали относить (помимс кислот в собственном смысле слова) целый ряд ионов, обла дающих свойством отдавать протоны (НзО+, NH4+ СН3СООН2+идр.).
Расширился и круг веществ, относимых к основаниям. Поми мо веществ, содержащих гидроксид-ионы ОН-, основаниями i настоящее время считают многие вещества и ионы, способны! присоединять протоны (NH3, C1-, СН3СОО~ и др.).
Поведение каждого растворенного вещества в неводном рас творителе зависит прежде всего от его свойств. Как было ука зано выше, некоторые соединения в одной среде ведут себя Kai основания, в другой - как кислоты. Одновременно, поведен» вещества в растворе зависит и от свойств растворителя.
Под влиянием неводных растворителей изменяются, т. с усиливаются кислотность, основность, повышается раствори мость. Это позволяет значительно расширить возможности кис лотно-основного титрования и распространить его на слабы кислоты и основания, которые трудно или вовсе невозможн определить в водной среде.
Теорию кислот и оснований для неводных сред разработа Франклин, затем она была развита советскими учеными А. Ша тенштейном, М. Усановичем, Н. А. Измайловым, А. П. Крешкс вым.
Для неводного титрования могут применяться различны растворители - кислого, основного характера и др.

В среде основных растворителей легко титруются слабые кислоты, енолы, кислые формы барбитуратов и сульфаниламидов, фенолы. Кислотность этих соединений в среде данных растворителей повышается и тем самым улучшаются процесс и результаты титрования.
Чем сильнее основные свойства растворителя, тем сильнее его влияние на слабые кислоты, т. е. тем сильнее он усиливает кислотные свойства вещества.
2. Кислотные (протогенные) растворители: фтористый водород HF, серная кислота H2SO4, муравьиная кислота НСООН, уксусная кислота СНзСООН (безводная).
Молекулы протогенных растворителей легко отдают протоны и превращаются в основания.
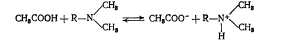
Чем сильнее кислые свойства растворителей, тем сильнее его влияние на слабые основания. Например, анилин, являющийся очень слабым основанием в воде, в среде безводной уксусной кислоты проявляет сильные основные свойства и может определяться методом нейтрализации.
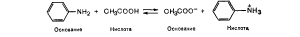
Однако деление растворителей на протофильные и протогенные относительно. Например, в водном растворе уксусная кислота является донором протона, т. е. кислотой.
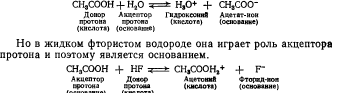
Следовательно, поведение того или другого вещества в растворе определяется величиной его сродства к протону.
Из двух взаимодействующих веществ кислотой является то соединение, которое проявляет меньшее сродство к протону, т. е. менее прочно удерживает протон. Основание - вещество с большим сродством к протону.
3. Амфотерные (амфилротные) растворители: вода Н20, этиловый спирт С2Н5ОН, метиловый спирт СНзОН и др.
Эти растворители играют роль основания по отношению к кислотам и роль кислоты по отношению к основаниям, т. е. их молекулы способны отдавать свои и принимать чужие протоны (от кислот). Это было показано ранее на примере воды. В ам-фипротных растворителях хорошо титруются смесн различных кислот.
4. Индифферентные (апротные или апротонные) растворители: углеводороды - бензол и его производные, галогенопроиз-водные углеводородов (например, хлороформ, четыреххлори-
стыи углерод и др.). Молекулы этих растворителей не способны ни отдавать, ни присоединять протоны. В этих растворителях хорошо титруются смеси оснований.
Большинство фармацевтических препаратов являются слабыми кислотами, основаниями, либо их солями, которые в водной среде определить трудно. Для подобных препаратов ГФ X и ввела метод кислотно-основного титрования в неводных средах.
Титрование слабых оснований. Амидопирин. В данном случае в качестве растворителя применяется безводная уксусная кислота. Титрантом служит хлорная кислота НС104, индикаторами - кристаллический фиолетовый, метилоранж или тро-пеолин-00. В среде протогенного растворителя (СНзСООН) усиливаются основные свойства амидопирина1, и он количественно титруется хлорной кислотой (R--остаток молекулы амидопирина).
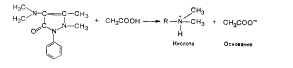
Одновременно титрант реагирует с безводной уксусной кислотой, и так как сродство к протону у хлорной кислоты меньше, чем у уксусной, реакция между ними проходит по следующему уравнению:

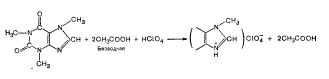
Титрование солей азотсодержащих оснований и галогеново-дородных кислот. К этой группе относится большинство солей алкалоидов (папаверина гидрохлорид, морфина гидрохлорид, гоматропина гидробромид и др.), а также соли азотсодержащих гетероциклических оснований (димедрол, совкаин, хиноцид и др.). Указанные соли не могут быть оттитрованы непосредственно хлорной кислотой, так как галогеноводородные кислоты сильно ионизированы и могут влиять на переход цвета индикатора в эквивалентной точке.
Для устранения мешающего действия ионизированного галогена кислоты (С1~, Вг~), титрование солей галогеноводород-ных кислот проводят в присутствии ацетата окисной ртути, в результате чего галоген-ион связывается в виде малодиссоцииро-ванного соединения-дихлорида или дибромида ртути HgCl2, HgBr2 и титрование идет с хорошими результатами (R - остаток молекулы эфедрина).
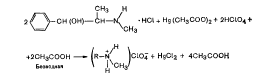
Титрование слабых кислот (кислые формы барбитуратов сульфаниламидов и др.). Титрование лекарственных веществ относящихся к слабым кислотам, проводится в среде прото фильных (основных) растворителей, которые усиливают кислот ные свойства слабых кислот. Чаще всего для этой цели исполь зуется диметилформамид (ДМФ), так как в нем хорошо рас творяется большинство органических лекарственных вещестЕ Поэтому этот растворитель принят ГФ X при титровании ела бых кислот.
Барбитал. Неводным растворителем является диметил формамид, титрантом - 0,1 н. раствор гидроксида натрия в сме си метилового спирта и бензола или 0,1 н. раствор метилат;
натрия CH3ONa в смеси бензола и метанола. Индикатором слу«жит тимоловый синий.
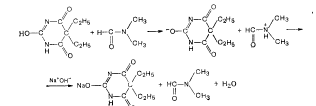
Аналогично определяются и другие барбитураты-кислоты (фенобарбитал, гексобарбитал, бензонал и др.).