

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ПРЯМОЕ ГАЛОГЕНИРОВАНИЕ
К реакциям прямого галогенирования относится замещение водорода на атом галогена в алканах, бензоле и его гомологах, циклоалканах, алкенах по аллильному углеродному атому. К числу реакций прямого галогенирования можно отнести также реакции присоединения галогенов и галогенводородов по двойной связи.
1.1. ЗАМЕЩЕНИЕ ВОДОРОДА ГАЛОГЕНАМИ У SP3 -ГИБРИДИЗОВАННОГО АТОМА УГЛЕРОДА 1.1.1. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ
Галогенирование алканов протекает в основном по радикальному механизму. При галогенировании алканов свободными галогенами скорость реакции образования алкилгалогенидов зависит не только от устойчивости алкильного радикала, но и от реакционной способности реагентов (галогена). Реакционная способность галогенов уменьшается в ряду
F2 > Cl2 > Br2 > I2
СН4 + 4 F2 → CF4 + 4 HF.
Хлорирование протекает как цепной радикальный процесс:
 В отличие от описанного выше хлорирования алканов, бромирование является более селективной реакцией. Так, атом брома настолько мало активен, что если в субстрате имеются только первичные атомы водорода, то реакция протекает очень медленно или вообще не идет.
В отличие от описанного выше хлорирования алканов, бромирование является более селективной реакцией. Так, атом брома настолько мало активен, что если в субстрате имеются только первичные атомы водорода, то реакция протекает очень медленно или вообще не идет.
В то же время 2- метилпропан (изобутан) можно селективно бромировать до третбутилбромида с высоким выходом. H3C CH CH3 CH3 + Br2 hv H3C C CH3 CH3 + HBr.
Галогенирование йодом можно осуществить, используя активирующее облучение УФ-светом. Йод легко диссоциирует на атомы, но реакция протекает с трудом из-за низкой активности атомов йода, кроме того, образующийся HI восстанавливает алкилйодид. Поэтому при проведении реакции йодирования образующийся HI связывают окислителями (HNO3, H2O2).
CH3 CH3 + I2 hv CH3 CH2 I + HI 5 HI + HIO3 3 I2 + 3 H2O.
|
|
1.1.2. АЛЛИЛЬНОЕ ГАЛОГЕНИРОВАНИЕ АЛКЕНОВ
Взаимодействие гомологов этилена с галогенами (Cl2, Br2) при высоких температурах (>400°С) ведет к замещению атома водорода в аллильном положении на галоген и называется аллильным замещением. Двойная связь при этом сохраняется.
CH2 CH CH3 Cl + 2 CH2 CH CH2Cl HCl >400 oС + пропен 3-хлорпропен CH2 CH CH2 CH3 Cl2 HCl- CH2 CH CHC CH2Cl CH CH CH3 + l CH3 >400 oС + 3-хлор-1-бутен 1-хлор-2-бутен
Замещению водорода в аллильном положении способствует высокая устойчивость аллильного радикала, стабилизированного резонансом:

При бромировании циклогексена N-бромсукцинимидом (NBS) в ССl4 образуется 3-бромциклогексен:

Бромирование алкенов NBS представляет собой цепной радикальный процесс с участием атома брома.
Атом брома образуется при фотолизе или термической гомолитической диссоциации молекулярного брома, образующегося в очень низкой концентрации из NBS и следов HBr.

ПРЯМОЕ ГАЛОГЕНИРОВАНИЕ
К реакциям прямого галогенирования относится замещение водорода на атом галогена в алканах, бензоле и его гомологах, циклоалканах, алкенах по аллильному углеродному атому. К числу реакций прямого галогенирования можно отнести также реакции присоединения галогенов и галогенводородов по двойной связи.
1.1. ЗАМЕЩЕНИЕ ВОДОРОДА ГАЛОГЕНАМИ У SP3 -ГИБРИДИЗОВАННОГО АТОМА УГЛЕРОДА 1.1.1. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ
Галогенирование алканов протекает в основном по радикальному механизму. При галогенировании алканов свободными галогенами скорость реакции образования алкилгалогенидов зависит не только от устойчивости алкильного радикала, но и от реакционной способности реагентов (галогена). Реакционная способность галогенов уменьшается в ряду
F2 > Cl2 > Br2 > I2
СН4 + 4 F2 → CF4 + 4 HF.
Хлорирование протекает как цепной радикальный процесс:
 В отличие от описанного выше хлорирования алканов, бромирование является более селективной реакцией. Так, атом брома настолько мало активен, что если в субстрате имеются только первичные атомы водорода, то реакция протекает очень медленно или вообще не идет.
В отличие от описанного выше хлорирования алканов, бромирование является более селективной реакцией. Так, атом брома настолько мало активен, что если в субстрате имеются только первичные атомы водорода, то реакция протекает очень медленно или вообще не идет.
|
|
В то же время 2- метилпропан (изобутан) можно селективно бромировать до третбутилбромида с высоким выходом. H3C CH CH3 CH3 + Br2 hv H3C C CH3 CH3 + HBr.
Галогенирование йодом можно осуществить, используя активирующее облучение УФ-светом. Йод легко диссоциирует на атомы, но реакция протекает с трудом из-за низкой активности атомов йода, кроме того, образующийся HI восстанавливает алкилйодид. Поэтому при проведении реакции йодирования образующийся HI связывают окислителями (HNO3, H2O2).
CH3 CH3 + I2 hv CH3 CH2 I + HI 5 HI + HIO3 3 I2 + 3 H2O.
1.1.2. АЛЛИЛЬНОЕ ГАЛОГЕНИРОВАНИЕ АЛКЕНОВ
Взаимодействие гомологов этилена с галогенами (Cl2, Br2) при высоких температурах (>400°С) ведет к замещению атома водорода в аллильном положении на галоген и называется аллильным замещением. Двойная связь при этом сохраняется.
CH2 CH CH3 Cl + 2 CH2 CH CH2Cl HCl >400 oС + пропен 3-хлорпропен CH2 CH CH2 CH3 Cl2 HCl- CH2 CH CHC CH2Cl CH CH CH3 + l CH3 >400 oС + 3-хлор-1-бутен 1-хлор-2-бутен
Замещению водорода в аллильном положении способствует высокая устойчивость аллильного радикала, стабилизированного резонансом:

При бромировании циклогексена N-бромсукцинимидом (NBS) в ССl4 образуется 3-бромциклогексен:

Бромирование алкенов NBS представляет собой цепной радикальный процесс с участием атома брома.
Атом брома образуется при фотолизе или термической гомолитической диссоциации молекулярного брома, образующегося в очень низкой концентрации из NBS и следов HBr.

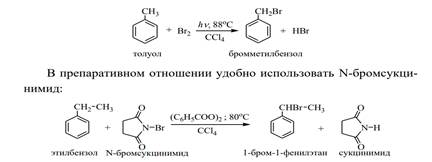
ГАЛОГЕНИРОВАНИЕ БОКОВОЙ ЦЕПИ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Реакция протекает по свободнорадикальному механизму. Так, при хлорировании горячего толуола хлором на свету или в присутствии перекисей происходит последовательное замещение атомов водорода на галоген и образуется смесь хлористого бензила, хлористого бензилидена и бензотрихлорида:
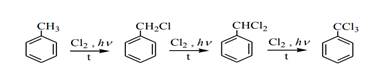
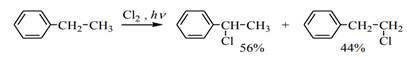
В случае галогенирования толуола на стадии роста цепи образуется бензильный радикал, устойчивость которого объясняется его резонансной стабилизацией:
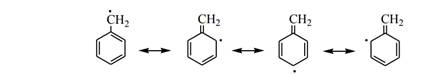
1.2. ЗАМЕЩЕНИЕ ВОДОРОДА ГАЛОГЕНАМИ У АРОМАТИЧЕСКОГО (SP2 -ГИБРИДИЗОВАННОГО) АТОМА УГЛЕРОДА
1.2.1. ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА
Галогенирование ароматических соединений можно осуществлять различными галогенирующими агентами. Свободные галогены, например, Cl2 и Br2, могут легко реагировать с активированными ароматическими системами (амины, фенолы), но не могут реагировать с бензолом. Для поляризации молекулы галогена с целью получения электрофильной атакующей частицы необходимо применение в качестве катализатора кислот Льюиса, таких как AlCl3, FeBr3 и т.д.:
|
|
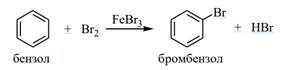
Реакция протекает по механизму электрофильного замещения, включающего ряд стадий:
Стадия 1 – образование электрофильного агента Е+. Молекула брома активируется по схеме кислотно-основной реакции с кислотой Льюиса:
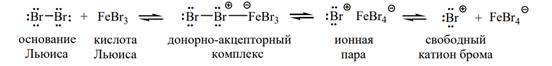
Стадия 2 – свободный катион брома или ион в составе ионной пары является активным электрофильным агентом, способным реагировать с бензолом; при этом сначала образуется π-комплекс – электрофильный агент вакантной орбиталью координируется с πэлектронной системой молекулы бензола:
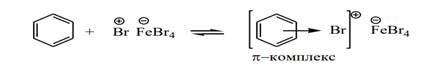
Стадия 3 – образование σ–комплекса. π–Комплекс превращается в карбениевый ион, в котором положительный заряд делокализован между пятью углеродными атомами, находящимися в состоянии sp2 - гибридизации. Один атом, атакованный электрофилом, находится в состоянии sp3 -гибридизации. σ–Комплекс, таким образом, не является ароматической системой. Стадия образования σ–комплекса является медленной и определяет скорость всей реакции.
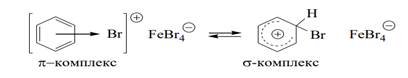
Стадия 4 – на этой стадии σ–комплекс стабилизируется с регенерацией ароматического секстета π–электронов за счет отщепления протона.


Реакционная способность элементарного йода в реакциях электрофильного замещения в ароматическом ядре незначительна, так что прямое йодирование возможно только в случае активированных ароматических систем. Йодирование бензола элементарным йодом проводят только в присутствии окислителя (обычно азотной кислоты, Н2О2, HIO3 и др.)
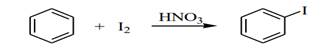
1.2.2. ГАЛОГЕНИРОВАНИЕ ЗАМЕЩЕННЫХ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Катионы галогена могут взаимодействовать и с замещенными ароматическими соединениями. Заместители влияют как на скорость реакции галогенирования, так и на место вступления галогена.
|
|
Так, галогенирование фенола протекает в мягких условиях при действии бромной воды и приводит к образованию 2, 4, 6- трибромфенола:
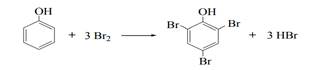


|
|
|

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!