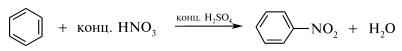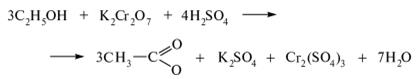В фарфоровую чашку поместить 1 мл бензола и поджечь. Отметить характер пламени.
!!!То же проделать с толуолом.
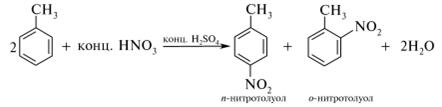
Опыт №2. Нитрование бензола и толуола нитрующей смесью.
В сухую пробирку помещаем 3 капли концентрированной серной кислоты, 2 капли концентрированной азотной кислоты и 2 капли бензола. Содержимое пробирки нагреваем в пламени горелки, а затем выливаем в пробирку с 10 каплями воды, взбалтываем. Отметить изменения, запах полученного раствора.
!!!То же проделать с толуолом.
Определяют наличие нитробензола и продуктов нитрования по запаху. Ощущают запах горького миндаля (характерный запах ароматических мононитросоединений):
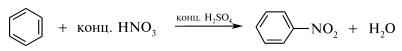
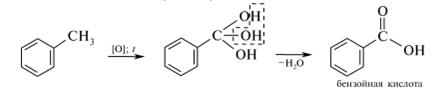
Опыт №3. Окисление бензола и толуола раствором перманганата калия.
В пробирку помещают 1 каплю 1%-ного раствора калия перманганата, 5 капель воды, 1 каплю 5%-ного раствора серной кислоты и 1 каплю бензола. Содержимое пробирки энергично встряхиваем и нагреваем в пламени горелки.
!!!То же проделать с толуолом.
Наблюдается обесцвечивание розово-фиолетовой окраски раствора, что объясняется окислением боковой цепи в молекуле толуола:
Вопросы для самостоятельной работы
- Что такое нитрующая смесь и почему при нитровании аренов целесообразнее использовать именно её? Почему не используют разбавленную азотную кислоту? Подтвердите уравнениями реакций.
- Сравните действие окислителей на бензол и его гомологи. Напишите соответствующие уравнения реакций. Почему бензол, несмотря на высокую степень ненасыщенности не обесцвечивает раствор перманганата калия?
- Какие реакции характерны для аренов? Подтвердите несколькими примерами реакций.
- Перечислите основные способы получения аренов в лаборатории. Напишите соответствующие уравнения реакций (в том числе реакция Вюрца-Фиттинга и алкилирование ароматических углеводородов по Фриделю-Крафтсу).
- В результате нитрования 16,6 г. бензола получили 0,15 моль нитробензола. Вычислите относительный выход продукта реакции.
- Установите формулу углеводорода, при сжигании которого выделилось 0,6 моль углекислого газа и 0,3 моль воды. Относительная плотность углеводорода по воздуху 2,69.
Лабораторная работа №5
Тема: Качественное определение галогенов (проба Бейльштейна)
Цель: определить самостоятельно
Реактивы и оборудование: этилбромид (хлороформ, четыреххлористый углерод и др.), медная проволока, горелка
Ход работы
Конец медной проволоки, свёрнутый в петлю, прокалить в пламени до исчезновения зеленоватого окрашивания (поверхность проволоки при этом покрывается черным налётом). После охлаждения нанести на прокалённую проволоку исследуемое вещество и вновь нагреть в пламени. Отметить цвет пламени и сделать выводы о содержании галогенов.
Теоретические сведения

Вопросы для самостоятельной работы
- При прокаливании медной проволоки в пламени на ней образуется чёрный налёт. Почему? Что это за налёт?
- Возможно ли данной пробой определить качественно какой галоген содержится в соединении? Почему?
- Мешают ли какие-то исходные компоненты или продукты реакции в данном методе идентификации галогенов? Объясните.
- Какими ещё способами (кроме пробы Бейльштейна) можно качественно определить галогены в соединении? Опишите кратко эти способы.
Лабораторная работа №6
Тема: Окисление этилового спирта дихроматом калия в кислой среде (хромовая смесь)
Цель: провести практически окисление этилового спирта хромовой смесью, изучить реакцию, сделать вывод о проведённой реакции как о качественной реакции на этиловый спирт.
Реактивы и оборудование: этиловый спирт, раствор серной кислоты (2н), раствор дихромата калия (0,5н), пипетка, пробирка с держателем, горелка.
Ход работы
В сухую пробирку поместить 2 капли этилового спирта, добавить 1 каплю серной кислоты и 2 капли дихромата калия. Оранжевый раствор ОСТОРОЖНО нагреть в пламени до начала изменения окраски на синевато-зелёную (при перегреве может произойти выброс реакционной массы из-за резкого вскипания образующегося низкокипящего ацетальдегида).
Изменение окраски обусловлено изменением степени окисления хрома:
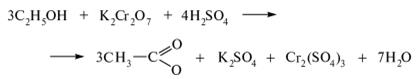
ОБРАТИТЕ ВНИМАНИЕ на появление характерного запаха ацетальдегида (запах прелых, мочёных или антоновских яблок).
Вопросы для самостоятельной работы
- Почему для проведения опыта важно использовать именно сухую пробирку?
- Как меняется в ходе реакции степень окисления хрома? Напишите для данной реакции ОВР методом электронного баланса.
- Что такое контрактация спирта?
- Какими ещё способами можно идентифицировать спирты?