В.А. Попков,С.А. Пузаков «Общая химия».М. «ГЭОТАР-Медиа» 2010г.
2.Н.А. Тюкавкина, Ю.И. Бауков «Биоорганическая химия». М. Медицина, 2012г. 416c. www.studmtdlib.ru.
Руководство к лабораторным занятиям по биоорганической химии»/ под
ред. Н.А. Тюкавкиной, М. Медицина. 2013 г.www.studmtdlib.ru. (практикум)
7.2 Дополнительная литература
Общая химия.Биофизическая химия. Химия биогенных элементов.»М,
«Высшая школа» 2013г.
Биоорганическая химия 2-ое изд. Зубарян С.Э. ГЭОТАР.Медиа 2012г.
3.Наглядная органическая химия н\г Н.А. Тюкавкиной, С.Э.Зубарян, «ГЭОТАР-Медиа.» 2007г. 976с,
Органическая химия под редакцией Н.А. Тюкавкиной, М. Дрофа, 2004 г.
Н.Н. Артемьева, В.Л. Белобородов. Руководство к лабораторным занятиям по органической химии. М. Дрофа. 2003 г.
Общая химия.Биофизическая химия. Химия биогенных элементов. М,
«Высшая школа» 2001г.
7.Методическая литература кафедры.
1.Общая химия. Вопросы и задачи для самостоятельной работы, сост. Ошроева Р.З., Беева Д.А., Нальчик, 2010, С. 33.
2.Металлы и сплавы, применяемые в стоматологии, сост. Ошроева Р.З., Шарафутдинова М.К., Беев А.А., Нальчик, 2006, С. 31.
3.Химия. Неорганические вещества, применяемые в стоматологии, сост. Ошроева Р.З., Беева Д.А., Тхазаплижева М.Т., Нальчик, 2012, С. 19.
4.Ошроева Р.З., Беева Д.А. Кинетика. Катализ. Ферментативный катализ. Учебное пособие. Нальчик, 2013, С. 43
5.Балаева С.М Вопросы и задания для самостоятельной работы. Нальчик 2010г.с.48
6.Балаева С.М.Биоорганическая химия, Нальчик 2008.с.50
7.3 Периодические издания
http://www.rjbc.ru/ - Bioorganicheskaya Khimiya / Russian Journal of Bioorganic Chemistry
Интернет-ресурсы
На сайте КБГУ http:// www. kbsu. ru/ на странице преподавателя размещены
планылабораторно-практическихзанятий,литература,вопросы коллоквиумов,зачетные вопросы.
http://www.chemistry.ssu.samara.ru/ - Интерактивный мультимедиа учебник
http://www.chem.msu.su/rus/teaching/org.html - Учебные материалы
по курсу органической химии Химического факультета МГУ
http://www.ibch.ru/ - Институт биоорганической химии
http://meduniver.com/Medical/Book/ - медицинская электронная библиотека. Раздел: книги по химии
http://www.edudic.ru/hie/859/ - Химическая энциклопедия "Биоорганическая химия"
http://bio-cat.ru/ - биологический каталог
http://www.fptl.ru/Chem%20block_Biblioteka.html – электронная химическая библиотека
http://bartors.ru/books/3075-podborka-knig-po-himii.html - подборка книг по химии
http://Poiskknig.ru - Поиск электронных книг по химии
http://Chaos.dvo.ru/chem.htm - Электронные книги по химии
http://Rushim.ru/books/books.htm - Сотни книг по химии
ЛАБОРАТОРНЫЕ РАБОТЫ
Занятие № 2
Лабораторная работа
Определение общей кислотности
Желудочного сока
Ход работы. Кислотность желудочного сока определяется количеством мл 0,1 н. раствора щелочи, которое необходимо для нейтрализации 100 мл профильтрованного желудочного содержимого. Обычно определяют общую кислотность и свободную HCI. Под общей кислотностью понимают все кисло реагирующие вещества желудочного содержимого, а под свободной HCI – свободную минеральную кислоту.
В коническую колбу отмеряют 10 мл отфильтрованного желудочного содержимого и добавляют 1–2 капли 0,5 %-го спиртового раствора индикатора метилового оранжевого. В присутствии свободной соляной кислоты HCI жидкость окрашивается в ярко-красный цвет. Титруют содержимое колбы 0,1 н. раствором NaOH до желтого окрашивания и отмечают объем NaOH (первая точка эквивалентности). Затем в титруемый раствор прибавляют 1–2 капли раствора фенолфталеина и продолжают титрование до появления стойкого розового окрашивания. Отмечают объем NаОН, израсходованный на оба титрования (вторая точка эквивалентности). Объем NaOH, пошедший на титрование до первой точки эквивалентности, умноженный на 10, показывает свободную HCI; объем, пошедший на оба титрования, умноженный на 10, показывает общую кислотность.
Занятие№3
Лабораторная работа
Лабораторная работа
Влияние различных факторов
на положение равновесия химической реакции
Влияние концентрации
К 20 мл воды в небольшом стакане прибавить по 1–2 капли насыщенных растворов FeCl3 и KCSN (или NH4CSN). Полученный раствор разлить в
4 пробирки. В 1-ю добавить несколько капель концентрированного раствора FeCl3, во 2-ю – несколько капель концентрированного раствора KCSN (или NH4CNS), в 3-ю – немного кристаллического КСl (или NH4Cl), 4-ю оставить для сравнения. Пользуясь законом действия масс, объяснить изменение окраски в первых трех пробирках. Результаты записать в таблицу:
| Добавленный
раствор
| Изменение
интенсивности окраски
| Направление
смещения равновесия
|
| FeCl3
|
|
|
| KCNS
|
|
|
| КС1
|
|
|
Уравнение реакции образования роданида железа (Ш):
FeCl3 + 3KCNS ↔ Fe(CNS)3 + 3KCI.
Роданид железа (Ш) окрашен в красный цвет, FeCl3 – в желтый, а KCNS и КCl – бесцветны.
Влияние температуры
При взаимодействии йода с крахмалом образуется синее вещество сложного состава (соединение включения):
йод + крахмал ↔ соединения включения
В две пробирки налить по 4–5 мл крахмала и добавить 3–4 капли 0,1 н. раствора I2. Нагреть одну из пробирок, а затем снова охладить. Вторую оставить для сравнения. Что происходит? Экзо- или эндотермической является реакция образования йодкрахмала?
Каталитические реакции
1. Сравнение каталитического эффекта фермента каталазы крови, ионов I- и Fe3+ на реакцию разложения перекиси водорода
В четыре пробирки налить по 0,5 мл раствора Н2O2. Затем в каждую пробирку с интервалом 3 мин внести катализаторы. В одну из пробирок добавить 0,2 мл крови (0,1 мл крови разводят в 50 раз).
В остальные две пробирки внести по одной капле поверхностно-активного вещества (сыворотку крови, разведенную в 30 раз) и по 0,2 мл 10 % растворов KI и FeCl3. Перекись водорода и растворы катализаторов перемешать, отметить начало реакции и через 1 мин определить высоту столба пены.
На основании полученных данных сравнить скорость разложения перекиси водорода под действием каталазы и ионов Fe3+ и I-.
Занятие №5
ТЕМА:Кислотно-основные свойства химических соединений
Лабораторная работа
Образование фенолята натрия и разложение его кислотой
В пробирку с 3 каплями воды поместите несколько кристалликов фенола и встряхните, к образующей мутной эмульсии добавляйте по каплям 10% раствор гидроксида натрия до образования прозрачного раствора. Подкислите этот раствор несколькими каплями 10% раствора HCl.
Лабораторная работа
ЛАБОРАТОРНАЯ РАБОТА
Буферной Ёмкости растворов
Ход работы. Для определения буферной емкости по кислоте в колбу емкостью 25 мл налить по 5 мл 0,2 М раствора СН3СООН и CH3COONa. В другой колбе приготовить контрольный раствор: смесь 1 мл 0,2 М CH3COONa и 9 мл 0,2 М СН3СООН. В обе колбы внести по 5 капель метилового оранжевого и рассчитать рН полученных растворов по уравнению Гендерсона – Гассельбаха. Исследуемую смесь оттитровать соляной кислотой до получения одинаковой окраски с контрольным раствором. Окраску сравнить на фоне белой бумаги. Буферную емкость Вк рассчитать по формуле:
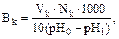
где Vk – объем НСl, мл;
Nk – нормальная концентрация эквивалента HCl, н.;
рН0 – водородный показатель исходного раствора;
pH1 – водородный показатель контрольного раствора
Занятие №7
Лабораторная работа
И их свойства
1. Реакции комплексообразования
В пробирку налить несколько капель раствора СuС12 и приливать по каплям раствор аммиака до образования осадка Сu(ОН)2, затем прилить избыток раствора аммиака до растворения осадка.
Сравнить окраску ионов Сu2+ с окраской полученного раствора. Написать уравнение реакции образования комплексного соединения, учитывая, что координационное число Сu2+ равно четырем. Какое основание является более сильным: гидроксид меди (II) или образовавшееся комплексное основание? Почему?
ЗАНЯТИЕ №8
ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
Занятие № 9
Лабораторная работа
Конденсационные методы
Занятие № 10
Тема: Гетерофункциональные соединения метаболиты и биорегуляторы. Стереоизомерия.
Лабораторная работа № 36
Разложение лимонной кислоты
В сухую пробирку, снабженную газоотводной трубкой, поместите лопаточку лимонной кислоты и 10 капель концентрированной cерной кислоты, нагрейте. Конец газоотводной опустите в 1-ю пробирку с 5 каплями раствора гидроксида бария. После того, как раствор помутнеет, перенесите газоотводную трубку во 2-ю пробирку, содержащую 2 капли раствора йода в йодиде калия, предварительно обесцвеченного добавлением нескольких капель 10% раствора гидроксида натрия. Во 2-й пробирке выпадает бледно-желтый осадок.
Занятие № 1 1
Открытие мочевой кислоты
На предметное стекло с помощью пипетки поместите 1 каплю раствора натриевой соли мочевой кислоты. Добавьте 1 каплю концентрированной азотной кислоты. Как только раствор выпарится и начнется слабое покраснение пятна на месте бывшей капли, прекратите нагревание. Когда стекло остынет, с боку от пятна поместите 1 каплю 10% раствора аммиака. На месте соприкосновения наблюдается появление полоски пурпурно-фиолетового цвета.
Занятие № 1 2
Тема:α-аминокислоты
Лабораторная работа № 45
Образование комплексной соли меди глицина
В пробирку поместите 1 мл 1 % раствора глицина. Добавьте на кончике лопаточки сухой карбонат меди и смесь нагрейте. Раствор окрашивается в синий цвет.
Лабораторная работа № 49
Амфотерные свойства α-аланина
В пробирку поместите 5 капель 1% раствора аланина и добавьте по каплям 0,1 % раствор гидроксид натрия подкрашенный индикатором фенолфталином, в начале наблюдаем обесцвечивание раствора, продолжаем добавлять гидроксид натрия до появления розоватой окраски.
Лабораторная работа № 50
Цветная реакция на цистеин
В пробирку поместите 5 капель 1% раствора цистеина. Добавьте 2 капли 10% раствора гидроксида натрия. Нагрейте смесь до кипения, а затем добавьте 2 капли 10% раствора ацетата свинца. Наблюдается выпадение осадка меркаптида свинца серо-черного цвета.
Занятие № 1 3
Тема:Пептиды и белки.
Лабораторная работа № 52
Занятие № 1 4
Тема:Моносахириды
Лабораторная работа № 55
Тема:Дисахариды
Лабораторная работа № 59
Тема:Полисахариды
Лабораторная работа № 61
Кислотный гидролиз крахмала
В пробирку поместите 1 каплю 0,5% клейстера. Добавьте 2 капли 10% серной кислоты и поместите пробирку в кипящую водяную баню. Мутный раствор клейстера становится прозрачным через 20 минут. Пипеткой нанесите 1 каплю гидролизата на предметное стекло и добавьте 1 каплю разбавленного йода.
Если проба не дает положительный йодкрахмальной реакции, добавьте в пробирку 8 капель 10% гидроксида натрия для создания щелочной среды. Затем добавьте 1 каплю 2% сульфата меди (II) CuSO4. Будет ли положительной проба Троммера.
Занятие № 1 8
Тема:Омыляемые липиды
Лабораторная работа № 31
В.А. Попков,С.А. Пузаков «Общая химия».М. «ГЭОТАР-Медиа» 2010г.
2.Н.А. Тюкавкина, Ю.И. Бауков «Биоорганическая химия». М. Медицина, 2012г. 416c. www.studmtdlib.ru.