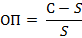Методы количественного анализа. Особенности фармацевтического анализа. Требования, предъявляемые к фармацевтическому анализу. Формы контроля качества лекарств. Задачи фармакопейного анализа. критерии фармацевтического анализа.
Количественный анализ — раздел аналитической химии, в задачу которого входит определение количества (содержания) элементов (ионов), радикалов, функциональных групп, соединений или фаз в анализируемом объекте. Количественный анализ вещества – это экспериментальное определение (измерение) концентрации (количества) химических элементов (соединений) или их форм в анализируемом веществе, выраженное в виде в виде границ доверительного интервала или числа с указанием стандартного отклонения.
Количественный анализ позволяет установить элементный и молекулярный состав исследуемого объекта или содержание отдельных его компонентов. В зависимости от объекта исследования различают неорганический анализ и органический анализ. В свою очередь их разделяют на элементный анализ, задача которого - установить, в каком количестве содержатся элементы (ионы) в анализируемом объекте, и на молекулярный и функциональный анализы, дающие ответ о количественном содержании радикалов, соединений, а также функциональных групп атомов в анализируемом объекте.
Методы количественного анализа можно также разделить на физические, физико-химические, химические и биологические. Химические методы базируются на химических (в том числе электрохимических) реакциях. Физические методы основаны на физических свойствах исследуемого вещества, физических явлениях и процессах (обычно это взаимодействие вещества с потоком энергии). Биологические методы основаны на реакциях тканей, органов, целых организмов или даже популяций на химические воздействия. Инструментальные (физические и физико-химические) методы анализа – методы, основанные на использовании зависимостей между измеряемыми физическими свойствами веществ и их качественным и количественным составом. К инструментальным методам анализа можно отнести следующие группы методов:оптические, электрохимические, хроматографические.
Классическими химическими методами количественного анализа являются гравиметрический (весовой) и титриметрический (объемный) анализ. В химических лабораториях эти методы анализа, хотя и являются в настоящее время основными при анализе макрокомпонентов, во многих случаях не отвечают возросшим требованиям к анализу, таким как высокая чувствительность, экспрессность, селективность, автоматизация и др. Этих недостатков лишены инструментальные методы анализа.
Особенности фармацевтического анализа.
Фармацевтический анализ - это наука о химической характеристике и измерении биологически активных веществ на всех этапах производства: от контроля сырья до оценки качества полученного лекарственного вещества, изучения его стабильности, установления сроков годности и стандартизации готовой лекарственной формы. Фармацевтический анализ имеет свои специфические особенности, отличающие его от других видов анализа.
1) анализу подвергаются вещества различной химической природы (неорганические, элементорганические, радиоактивные, органические соединения) - от простых алифатических УВ до сложных природных биологически активных веществ;
2) чрезвычайно широк диапазон концентраций анализируемых веществ;
3) объектами фармацевтического анализа являются не только индивидуальные лекарственные вещества, но и смеси, содержащие различное число компонентов;
4) количество лекарственных средств с каждым годом увеличивается. Это вызывает необходимость разработки новых способов анализа.
К фармацевтическому анализу предъявляют высокие требования:
1. Он должен быть достаточно специфичен и чувствителен,
2. Точен по отношению к нормативам, обусловленным ГФ XI, ВФС, ФС и другой НТД.
3. Должен выполняться в короткие промежутки времени с использованием минимальных количеств испытуемых лекарственных препаратов и реактивов.
Фармацевтический анализ в зависимости от поставленных задач включает различные формы контроля качества лекарств:
1. фармакопейный анализ,
2. постадийный контроль производства лекарственных средств,
3. анализ лекарственных форм индивидуального изготовления, экспресс-анализ в условиях аптеки.
4. биофармацевтический анализ.
Составной частью фармацевтического анализа является фармакопейный анализ. Он представляет собой совокупность способов исследования лекарственных препаратов и лекарственных форм, изложенных в ГФ или другой нормативно-технической документации (ВФС, ФС). На основании результатов, полученных при выполнении фармакопейного анализа, делается заключение о соответствии лекарственного средства требованиям ГФ или другой нормативно-технической документации и решается вопрос о возможности его применения в медицинской практике. При отклонении от этих требований лекарство к применению не допускают.
Выполнение фармакопейного анализа позволяет установить:
а) подлинность лекарственного средства,
б) его чистоту,
в) определить количественное содержание фармакологически активного вещества или ингредиентов, входящих в состав лекарственной формы.
Критерии фармацевтического анализа
На различных этапах фармацевтического анализа в зависимости от поставленных задач имеют значение такие критерии, как избирательность, чувствительность, точность, время, затраченное на выполнение анализа, израсходованное количество анализируемого ЛВ или ЛФ.
Избирательность метода очень важна при проведении анализа смесей веществ, поскольку дает возможность получать истинные значения каждого из компонентов. Только избирательные методики анализа позволяют определять содержание основного компонента в присутствии продуктов разложения и других примесей.
Требования к то ч н ости и чувствительности фармацевтического анализа зависят от объекта и цели исследования. При испытании степени чистоты ЛВ используют методики, отличающиеся высокой чувствительностью, позволяющие устанавливать минимальное содержание примесей.
При выполнении постадийного контроля производства, а также при проведении экспресс-анализа в условиях аптеки важную роль имеет фактор времени, которое затрачивается на выполнение анализа. Для этого выбирают методы, позволяющие провести анализ в наиболее короткие промежутки времени и вместе с тем с достаточной точностью.
При количественном определении ЛВ используют метод, отличающийся избирательностью и высокой точностью. Чувствительностью метода пренебрегают, учитывая возможность выполнения анализа с большой навеской ЛВ. Мерой чувствительности реакции является предел обнаружения. Эта характеристика показывает наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной доверительной вероятностью.
На чувствительность качественных реакций оказывают влияние такие факторы, как объемы растворов реагирующих компонентов, концентрации реактивов, рН среды, температура продолжительность опыта. Это следует учитывать при разработке методик качественного фармацевтического анализа. Для установления чувствительности реакций все шире используют показатель поглощения (удельный или молярный), устанавливаемый спектрофотометрическим методом.
Термин «точность анализа» включает одновременно два понятия: воспроизводимость и правильность полученных результатов. Воспроизводимость характеризует рассеяние результатов анализа по сравнению со средним значением. Правильность отражает разность между действительным и найденным содержанием вещества. Точность анализа у каждого метода различна и зависит от многих факторов: калибровки измерительных приборов; точности взвешивания или отмеривания необходимого количества реагентов; опытности аналитика и др. Точность результата анализа не может быть выше, чем точность наименее точного измерения.
2) Отбор и подготовка пробы к анализу
Заключение о качестве лекарственного средства можно сделать только на основании анализа пробы. Порядок ее отбора указан либо в частной статье, либо в общей статье ГФ. Отбор пробы производят только из неповрежденных укупоренных и упакованных в соответствии с требованиями НТПА (нормативный технический правовой акт) упаковочных единиц. Для испытания лекарственного препарата на соответствие требованиям НТПА проводится, как правило, многоступенчатый отбор проб.
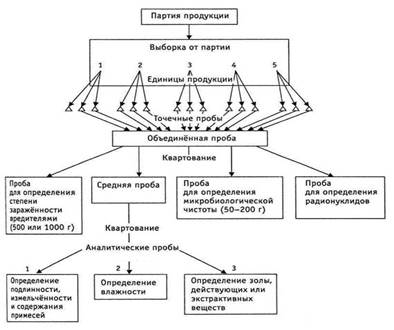
Число ступеней зависит от вида упаковки. На последней ступени (после контроля по внешнему виду) берут пробу в количестве, необходимом для четырех полных физико-химических анализов (если проба отбирается для контролирующих организаций, то на шесть таких анализов). Из упаковки берут точечные пробы, взятые в равных количествах из верхнего, среднего и нижнего слоев каждой упаковочной единицы. После установления однородности все эти пробы смешивают. Сыпучие и вязкие лекарственные средства отбирают пробоотборником, изготовленным из инертного материала. Жидкие лекарственные средства перед отбором проб тщательно перемешивают. Если это делать затруднительно, то отбирают точечные пробы из разных слоев. Отбор выборок готовых лекарственных средств осуществляют в соответствии с требованиями частных статей или инструкций по контролю, утвержденных Министерством здравоохранения.
Все химические вещества, применяемые как лекарственные средства, должны отвечать требованиям Государственной фармакопеи (ГФ) по внешнему виду (раздел «Описание»), растворимости (раздел «Растворимость»), химическому составу (раздел «Испытания на подлинность»), чистоте (раздел «Испытания на чистоту»), а также по таким показателям его качества как: величина рН, «удельный показатель поглощения», «удельное вращение», температура плавления и др. Количественное содержание действующего вещества или нескольких веществ должно находиться в пределах, указанных в разделе «Количественное определение».
Гравиметрический анализ. Методы грав. анализа. Требования к реакциям в гравиметрии. Методы отгонки. В-ва, определяемые методом отгонки. Прямые и косвенные методы отгонки.
Гравиметрический(весовой) метод анализа - количественное определение вещества, основанное на точном измерении массы компонента пробы, выделенного либо в элементарном виде, либо в виде соединения определенного и постоянного состава. В основе метода лежат законы сохранения массы и постоянства состава вещества. Гравиметрия является одним из немногих представителей безэталонных методов анализа. Гравиметрия – фармакопейный метод анализа.
Основным недостатком гравиметрического метода является длительность определений, что соотвественно исключает применение этого метода для текущего технологического контроля производства и при проведении экспресс-анализа.
Методы гравиметрического анализа Различают три группы методов проведения гравиметрического анализа – методы выделения, отгонки и методы осаждения.
Методы выделения. Эти методы основаны на количественном выделении определяемого вещества из анализируемого раствора путем химической реакции в твердую фазу в элементарном виде с последующим определением массы выделенного вещества.
Методы отгонки. Эти методы основаны на отгонке определяемого компонента в виде летучего соединения с последующим определением массы отогнанного вещества (прямое определение) или массы остатка (косвенное определение). Методы отгонки применяются в нескольких вариантах.
-Косвенные методы: а) определяемое вещество отгоняют из точной навески исследуемого образца и по уменьшению ее массы судят о содержании летучего компонента;
б) определяемое вещество переводят химическим путем в летучее состояние и отгоняют.
- Прямые методы: Определяемое вещество переводят в летучее состояние, отгоняют и поглощают каким-либо поглотителем, по увеличению массы которого рассчитывают содержание компонента. Пример: выделение CO2 при определении карбоната кальция в известняке(действием на карбонат кальция кислотой или прокаливанием).
Вещества, определяемые методом отгонки:
1) карбонаты и углекислый газ в карбонатных породах;
2) кристаллизационная вода в гидратах солей;
3) бор в виде летучих эфиров борной кислоты, например, B(OCH3)3; 2) мышьяк в видеAsCl3; 3) германий в видеGeCl4;
4) железо в виде FeCl3;
5) ртуть в виде Hgи т.д.
Метод отгонки также применяют при определении ванадия, вольфрама, молибдена, олова, сурьмы, иода, фтора, осмия, серы, селена, теллура, кремния и других элементов. Отгонка SiF4– отделение кремниевой кислоты от других примесей (соединений титана, железа, щелочных и щелочноземельных металлов и др.).
Методы осаждения - навеску анализируемого образца (mнав), содержащего определяемое вещество (В), переводят в раствор и добавляют избыток реагента-осадителя (А). Образовавшийся осадок (осажденная форма В b А a) отфильтровывают, промывают, высушивают (прокаливают) до постоянной массы (гравиметрическая (весовая) форма С) и взвешивают на аналитических весах:
b B+ a A → B b A a ↓→ c C
Зная точную массу и состав весовой формы можно вычислить массу и массовую долю определяемого вещества в анализируемом образце.
Гравиметрический анализ методом осаждения включает в себя следующие основные этапы:
- взятие навески анализируемого образца и перевод её в раствор;
- перевод определяемого вещества в осажденную форму (осаждение);
- отделение осадка от раствора (фильтрование) и удаление примесей (промывание);
- перевод осажденной формы в весовую (гравиметрическую) форму;
- взвешивание гравиметрической формы на аналитических весах;
- расчет результатов анализа.
Химические аналитические реакции, применяемые в количественном анализе, должны отвечать определенным требованиям, важнейшими из которых являются следующие.
а) Реакции должны протекать быстро, до конца, по возможности, — проходить при комнатной температуре.
б) Исходные вещества, вступающие в реакцию, должны реагировать в строго определенных количественных соотношениях (стехиометрически) и без побочных процессов.
в) Примеси не должны мешать проведению количественного анализа.
Эти общие требования конкретизируются, дополняются и уточняются при использовании различных методов и конкретных методик химического количественного анализа.
6) Этапы гравиметрического определения. Требования к осадителю, осаждаемой и гравиметрической формам. Органические осадители, их преимущества. Гравиметрический фактор.
Основные этапы гравиметрического определения
К основным этапам гравиметрического анализа в методе осаждения в общем случае относятся следующие:
• расчет массы навески анализируемой пробы и объема (или массы) осадителя;
• взвешивание (взятие) навески анализируемого образца;
• растворение навески анализируемого образца;
• осаждение, т. е. получениеосаждаемой формыопределяемого компонента;
• фильтрование (отделение осадка от маточного раствора);
• промывание осадка;
• высушивание и (при необходимости) прокаливание осадка до постоянной массы, т.е. получениегравиметрической формы,взвешивание гравиметрической формы;
• расчет результатов анализа, их статистическая обработка и представление. Рассмотрим кратко каждую из этих операций.
Для получения точных результатов в гравиметрических методах осаждаемая и гравиметрическая формы осадка должны соответствовать определенным требованиям.
Требования к осаждаемой форме:
1. Осадок должен быть практически нерастворим.
2. малая величина растворимости, около 1*10- 6 моль/л,
3. осаждаемая форма должна легко и полно превращаться в гравиметрическую форму.
Требования, предъявляемые к гравиметрической форме:
1. Состав гравиметрической формы должен точно соответствовать определенной стехиометрической формуле.
2. Она не должна менять своей массы на воздухе из-за поглощения паров H2O и CO2 или частичного разложения.
3. Содержание определяемого элемента в гравиметрической форме должно быть как можно меньше, т. к. в таком случае погрешности взвешивания в меньшей степени сказываются на результате.
Требования к осадителям:
1. Осадитель должен образовывать с исследуемым компонентом осадок, обладающий наименьшей растворимостью.
2. Осадитель должен быть летуч, чтобы примеси его можно было удалить при прокаливании.
3. Осадитель должен быть специфичным, т. е. осаждать избирательно.
Преимущества органических осадителей. В количественном анализе для осаждения и разделения многих катионов применяют дитизон, купферон, пиридин, оксихинолин. Органические осадители отличаются рядом преимуществ по сравнению с обычными неорганическими осадителями.
1. Пользуясь органическими осадителями, можно осаждать и разделять различные элементы из очень сложных смесей. Например, при помощи диметилглиоксима возможно количественное осаждение катионов никеля в присутствии многих других катионов.
2. Осадки, получающиеся с органическими осадителями, хорошо отфильтровываются и промываются (например, осадки комплексных соединений катионов, содержащих в качестве лигандов пиридин или другие органические соединения). Это дает возможность легко отмывать от осадков примеси, содержащиеся в анализируемом растворе.
3. Осадки, получающиеся при действии на катионы или анионы органических осадителей, отличаются большим молекулярным весом. Вследствие этого точность анализа повышается. Например, определение магния, алюминия и других катионов проводится с большой точностью осаждением их в виде оксихинолятов, обладающих большим молекулярным весом.
4. В составе осадков, являющихся соединениями неорганических веществ с органическими компонентами, обычно содержится мало соосаждающихся иримесей.
Гравиметрический фактор (F) – отношение молекулярной массы определяемого вещества к молярной массе гравиметрической формы с коэффициентами a и b, на которые нужно умножить это отношение, чтобы молекулярные массы были эквивалентны друг другу:
F = а М(опр.в-ва) / bМ(г.ф.).
а, b – стехиометрические коэффициенты; М(опр.в-ва) – молекулярная масса определяемого вещества, г; М(г.ф.). – молекулярная масса гравиметрической формы. Фактор отражает содержание определяемого компонента в гравиметрической форме.
7) Механизм образования осадка. Основные стадии осаждения. Относительное пересыщение.
Образование осадка происходит в две стадии:
1) образование центров кристаллизации - процесс объединения некоторого минимального числа ионов или молекул с образованием устойчивой второй фазы,
2) рост частиц - увеличение размера сформировавшихся зародышей кристаллов.
Дальнейшее осаждение может осуществляться путем образования новых центров или путем роста частиц. Размеры частиц осаждаемого вещества определяются тем, какая из двух стадий является доминирующей. Если осаждение преимущественно идет по первому пути, получается осадок, состоящий из большого числа мелких частиц; если доминирует второй процесс, образуется меньшее число, но крупных частиц. Размеры частиц связаны с относительным пересыщением (С - s)/s, где С? концентрация растворенного вещества в данный момент времени, s - концентрация насыщенного раствора. В процессе образования малорастворимого осадка добавление каждой порции осадителя приводит к мгновенному пересыщению раствора, т.е. С>s. Скорость образования центров кристаллизации возрастает с увеличением относительного пересыщения по степенному закону: V1 = k1 • (С?s)n/ sn. Скорость роста частиц связана линейным состношением с относительным пересыщением: V2 = k2 • (С?s) / s. Обычно k2>k1, поэтому при низком относительном пересыщении доминирует рост кристаллов. Если пересыщение велико, процесс образования центров кристаллизации может практически подавить линейный рост кристаллов с формированием при низких Кs аморфных осадков и золей.
Понятие о механизме образования осадка
В процессе образования осадка различают три основных параллельно протекающих процесса:
1. образование зародышей кристаллов (центров кристаллизации);
2. рост кристаллов;
3. объединение (агрегация) хаотично ориентированных мелких кристаллов.
В начальный момент смешивания реагирующих компонентов раствор, содержащий эти компоненты, пересыщается (если ПКИ реагирующих компонентов больше, чем ПР малорастворимого продукта их реакции) и образуется мельчайшие частицы – зародыши. Зародыш кристалла – наименьший агрегат атомов, молекул или ионов, который образуется в виде твердой фазы при осаждении и способен к самопроизвольному росту. Образование зародышей в пересыщенном растворе может происходить как самопроизвольно, так и при введении в раствор твердых частиц осадка (или частиц другой природы), которые и могут служить центром образования зародышей (рис. 1).
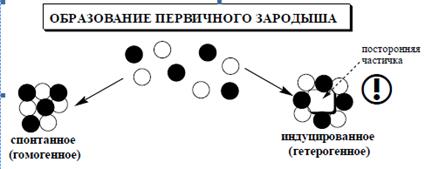
Рис. 1. Образование первичных зародышей.
Нерастворимые частицы, содержащиеся в реактивах и растворителе, также являются центром образования зародышей.
Время с момента смешивания растворов реагирующих веществ до появления зародышей называется индукционным периодом. Его величина зависит от химической природы образующегося осадка, концентрации реагентов, методики проведения эксперимента, чистоты реактивов и т.д. Например, при осаждении творожистого осадка AgCl индукционный период – незначителен, а при осаждении кристаллических осадков – достаточно велик.
Рост кристаллов происходит за счет диффузии ионов к поверхности растущего кристалла и осаждения этих ионов на его поверхности и определяется не только диффузионными, но и структурой растущих кристаллов, дефектами кристаллической решетки, внедрением в нее различных ионов и т.д.
Характер осадка (число и размер частиц осадка) зависит от соотношения скорости образования зародышей кристаллов и скорости роста кристаллов. Если скорость образования зародышей кристаллов мала по сравнению со скоростью роста кристаллов, образуется небольшое число крупных частиц – осадок крупнокристаллический. При обратном соотношении скоростей получается мелкодисперсный осадок, состоящий из большого числа мелких частиц. Скорости обоих процессов зависят от относительного пересыщения (ОП) раствора, которое определяется выражением:
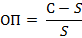
Где С – концентрация осаждаемого вещества в растворе;
S – растворимость осадка при достижении состояния равновесия.
Установлено, что с увеличением относительного пересыщения скорость образования зародышей кристаллов возрастает по экспоненциальному закону, а скорость роста кристаллов – прямо пропорционально относительному пересышению. Примерная зависимость скорости процесса образования первичных зародышей и роста образовавшихся кристаллов от относительного пересыщения приведена на рис. 2.
| 1 – рост кристаллов
2 – образовыание зародышей
V 1 = K 1 ·(ОП);
V2 = K2·(ОП)n;
n≈ 4 и K1 < K2
| |
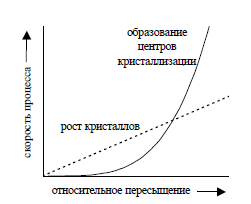
Рис. 2. Зависимость скоростей процессов образования первичных центров кристаллизации и роста кристаллов от величины ОП
Как видно из рисунка, при низком относительном пересыщении преимущественно происходит рост кристаллов. С увеличением пересыщения раствора (уменьшением растворимости осаждаемого вещества) процесс зародышеобразования практически подавляет процесс роста кристаллов, образуется мелкодисперсный осадок, а в случае осаждения веществ с малыми значениями ПР образуются аморфные осадки и коллоидные растворы (коллоиды), состоящие из диспергированных в растворе твердых частиц осаждаемого вещества размером 10-5 – 10-7 см.
Из формулы (8) следует, что ОП тем больше, чем больше концентрация осаждаемого вещества и меньше растворимость осадка. Таким образом, регулировать число и размеры частиц осадка (характер осадка) можно, изменяя эти величины. Для получения, например, крупнокристаллических осадков необходимо увеличить S или уменьшить С. Увеличить S можно, повысив температуру или увеличить ионную силу раствора. Уменьшить концентрацию можно, разбавив раствор или медленно добавляя осадитель по каплям при перемешивании (рис. 3).
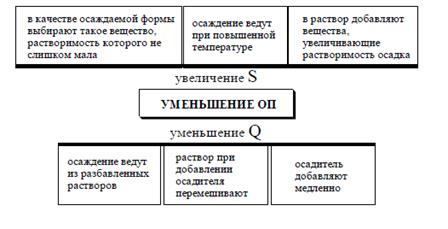
Рис. 3. Условия осаждения кристаллических осадков.
При стоянии (или нагревании) кристаллического осадка в контакте с маточным раствором происходит процесс «старения» (созревания) осадка, в результате которого происходит совершенствование кристаллической структуры осадка и уменьшение его удельной поверхности, вследствие чего десорбируются и переходят в раствор примеси адсорбированные на поверхности осадка, а также высвобождаются окклюдированные капельки маточного раствора. «Созревание» заключается в растворении мелких кристаллов и упорядочении роста больших кристаллов. В результате процесса старения образуется более чистый, крупнокристаллический, лучше фильтрующийся осадок с кристаллами более правильной формы.
Характер осадка зависит и от условий осаждения. Так, BaSO4 при осаждении из водных растворов осаждается в виде белых кристаллов. Если же его осаждать из водно-спиртовой смеси 30-60 % спирта, который сильно понижает растворимость BaSO4, то образуется коллоидный раствор или аморфный осадок.
Рассмотренная зависимость в формуле (8) объясняет, почему в одних случаях образуются аморфные осадки, а в других – кристаллические.
Для избежания локальных пересыщений в практике гравиметрического анализа, наряду с перемешиванием, применяют метод возникающих реагентов (осаждение из гомогенного раствора). В этом случае реагент-осадитель не добавляется извне, а медленно и равномерно образуется по всему объёму реакционной массы в результате какой-либо химической реакции. Например, при осаждении кальция в виде оксалата к подкисленному раствору соли кальция добавляют щавелевую кислоту, мочевину и полученную реакционную смесь нагревают. В результате гидролиза мочевины в растворе образуется аммиак, при взаимодействии которого со щавелевой кислотой возникают оксалат-ионы, осаждающие кальций:
(NH2)2CO + H2O → CO2 + 2NH3 (медленно)
2NH3 + H2C2O4 → 2NH4+ + C2O42-
Ca2+ + C2O42-→ CaC2O4↓
Поскольку лимитирующей стадией является реакция гидролиза мочевины и аммиак выделяется медленно и равномерно во всем объёме раствора, то достигается равномерное незначительное пересыщение, что способствует постепенному образованию крупных кристаллов оксалата кальция.
В то же время растворимость (S) многих осадков столь незначительна, что не удается получить достаточно малую разность Q- S, то есть величина ОП велика, в растворе появляется много центров кристаллизации, осадок образуется быстро и получается аморфным. Так, при определении железа(III) или алюминия получают объёмистые аморфные, сильно гидратированные осадки гидроксидов железа(III) или алюминия, величины KS которых равны 6・10-38 и 1・10-32 соответственно. В этом случае осаждение производят при энергичном перемешивании и нагревании, из концентрированных растворов, концентрированным раствором осадителя, с добавлением электролита (обычно соли аммония), что вызывает коагуляцию первоначально образующегося коллоидного раствора и, следовательно, уплотнение осадка. Аморфные осадки немедленно фильтруют, так как длительное выдерживание с маточным раствором приводит к необратимому изменению свойств аморфных осадков, вследствие чего они плохо фильтруются.
Метод «возникающих реагентов» позволяет получать кристаллические осадки таких веществ, которые при обычном осаждении образуют лишь аморфные осадки.
ВОПРОС НОМЕР 8
Коллоидная стадия образования осадка
Коллоидные растворы — это высокодисперсные двухфазные системы, состоящие из жидкой фазы (дисперсионной среды) и твердой фазы (дисперсной фазы), причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм (10-5 – 10-7 см). Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
В отличие от истинных растворов для золей характерен эффект Тиндаля, т. е. рассеяние света коллоидными частицами. При пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении. Так можно распознать, является данный раствор коллоидным или истинным.
Коллоидные растворы бывают:
1. Гидрофобные (лиофобные) – золи; они имеют незначительное сродство к воде (например, золи серы, золота, сульфидов металлов).
2. Гидрофильные (лиофильные) – имеют большое сродство к воде; обладают большой вязкостью – гели (например, белки, крахмал, желатин).
С чем связана устойчивость коллоидных систем. В растворе двухфазной системы находятся взвешенные частицы размером 10-5 – 10-7 см. На поверхности частиц находится некомпенсированный заряд, поэтому на разделе фаз возникает потенциальная энергия большой величины. Существование некомпенсированного силового поля ведет к адсорбции из раствора молекул и ионов. У внутренних ионов силы взаимодействия скомпенсированы.
По мере адсорбции на первичных зародышах всё большего и большего количества ионов размер частиц осадка увеличивается. Образование коллоидных частиц неблагоприятно отражается на результатах гравиметрического анализа, поскольку такие частицы вследствие достаточно малого размера не задерживаются обычными фильтрами. Это ведёт к потере осаждаемого вещества. Коллоидные системы являются устойчивыми. Частицы дисперсной фазы в них могут сколь угодно долго находиться во взвешенном состоянии. Главной причиной устойчивости является наличие у коллоидных частиц электрического заряда, который не позволяет им объединяться друг с другом, превращаясь в более крупные образования, оседающие под действием силы тяжести. Рассмотрим строение коллоидной частицы AgI (рис. 4), образованной по реакции:
AgNO 3 (изб.) + KI → AgI ↓ + KNO 3

Рис. 4. Строение коллоидной частицы иодида серебра, образованной при добавлении к избытку раствору AgNO3 раствора KI (показаны потенциалопределяющие ионы и соответствующие им противоионы)
В соответствии с правилом адсорбции на поверхности коллоидной частицы в процессе ее образования в первую очередь адсорбируются ионы, которые будут достраивать кристаллическую решетку (которые входят в состав малорастворимого соединения) – ионы Ag+. Слой адсорбированных ионов называется внутренним слоем (первично адсорбционный слой). А ионы Ag+ - потенциалопределяющие ионы. Под действием электростатических сил вокруг заряженных частиц образуется слой противоионов – это NO3- ионы. Потенциалопределяющие ионы (Ag+) и соответствующие им противоионы (NO3-), остающиеся в растворе, образуют двойной электрический слой (ДЭС) - тонкий электрический слой, образующийся из пространственно разделённых зарядов противоположного знака на границе раздела агрегата и раствора. ДЭС обуславливает высокую устойчивость коллоидных систем. Благодаря наличию двойного электрического слоя коллоидные системы не слипаются друг с другом (отталкиваются друг от друга). Часть ионов NO3- - [(n -х)· NO 3 - ] прочно связаны с первичным адсорбционным слоем (кулоновские связи) и образуют плотный слой (адсорбционный слой), а часть NO3- ионов - х· NO3- связаны с ионами Ag+ слабо и они образуют диффузный слой. Внешний слой состоит из плотного и диффузного слоя.
Процесс объединения коллоидных частиц дисперсной фазы в более крупные агрегаты, которые можно осадить, называется коагуляцией (агломерацией, седиментацией).Коагуляцию можно вызвать нагреванием, перемешиванием или добавлением к коллоидной системе сильного электролита.
Чем выше концентрация и заряд ионов добавленного электролита (ионная сила раствора), тем меньше радиус диффузного слоя противоионов (заряд уменьшается, уплотнение диффузного слоя) и тем менее устойчива коллоидная частица. Поэтому добавление электролитов-коагулянтов, ионы которых являются противоионами по отношению к заряженной коллоидной частице способствует процессу коагуляции. В качестве таких электролитов обычно используют соли аммония или летучие кислоты, которые разрушаются в дальнейшем при переводе осадка в гравиметрическую форму и не загрязняют ее. При коагуляции гидрофобных коллоидов образуются творожистые осадки, например, AgCl. При коагуляции гидрофильных коллоидов образуются студенистые аморфные осадки, например, Fe(OH)3, Al(OH)3.
Процесс обратный коагуляции называется пептизацией. В результате протекания данного процесса скоагулированный осадок возвращается в исходное коллоидно-дисперсное состояние. Пептизация может происходить при промывании осадка водой. По этой причине осадок вещества, склонного к образованию коллоидных растворов, следует отмывать от адсорбированных на нём примесей не чистой водой, а раствором сильного электролита.
Вопрос номер 9
Их устранения
Осадок, образующийся в процессе гравиметрического определения, всегда содержит то или иное количество посторонних примесей. Примеси могут попадать в осадок по различным причинам. Вид примесей, загрязняющих осадок, и их количество зависят от условий выполнения анализа и характера образующегося осадка.
Загрязнение осадка веществами (посторонними примесями), которые в условиях осаждения должны полностью оставаться в растворе, называется соосаждением. К явлениям соосаждения относят также переход в осадок сравнительно малорастворимых веществ, находящихся в растворе в таких малых концентрациях, при которых ПК соответствующих соосаждающихся ионов значительно меньше ПР. Иными словами в отсутствии основного осадка эти вещества должны были бы оставаться в растворе. Например, малые количества Sr2+ в растворе при добавлении SO42- ионов могут не образовать твердой фазы вследствие того, что [Sr2+]·[ SO42-] ≤ ПР (SrSO4). Тем не менее они захватываются осадком BaSO4 и соосаждаются.
Соосаждение происходит в процессе образования осадка, но не после его образования. Так, осаждая BaSO4 из раствора, содержащие ионы MnO4-, получают осадок розового или фиолетового цвета из-за соосаждения этих ионов. Однако если взять готовый препарат BaSO4 и взбалтывать его с раствором KMnO4, то соосаждение не происходит, осадок остается неокрашенным.
Примеры соосаждения
1. При осаждении BaSO4 осадок захватывает некоторые количества Ba(NO3)2, хотя последнее соединение достаточно хорошо растворимо.
2. Ионы Fe3+ от ионов Cu2+ отделяют аммиак