(Воздух. Продолжительность коррозионных испытаний -2 часа.
Неподвижный электрод.)
| Параметр,
| Концентрация CuC12, моль/л
|
| А/см2
| 0
| 10-4
| 10-3
| 10-2
| 5.10-2
| 10-1
|
| iкор,общ
| 8,79.10-5
| 9,63.10-5
| 1,00.10-4
| 1,55.10-4
| 1,60.10-4
| 2,09.10-4
|
| iэх
| 6,90.10-5
| 3,98.10-5
| 6,31.10-5
| 6,31.10-5
| 8,70.10-5
| 8,70.10-5
|
| iпред
| 2,50.10-4
| 2,50.10-4
| 3,61.10-4
| 4,20.10-4
| 5,00.10-4
| 1,00.10-3
|
Анализ поляризационных кривых, полученных в 5М у.б. изопропанольных растворах НС1, показывает, что с ростом концентрации CuС12 закономерно снижается стационарный потенциал, уменьшается скорость анодного процесса и увеличивается предельный ток катодных поляризационных кривых (рис. 1). Последний факт подтверждает литературные данные о деполяризующем действии двухвалентных ионов меди. В таком случае предельный катодный ток (iпред) должен складываться из двух величин - предельного катодного тока по кислороду ( 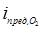 ) и предельного тока по Cu2+ (iпред,С u2+):
) и предельного тока по Cu2+ (iпред,С u2+):
iпред = 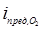 + iпред,С u2+ (42)
+ iпред,С u2+ (42)
На рисунке 2 приведены логарифмические зависимости скорости электрохимической коррозии (iэх), предельного тока катодной поляризационной кривой а также общей скорости коррозии, пересчитанной на токовые единицы с помощью электрохимического эквивалента, равного для меди в хлоридных средах 2,3881 (iкор,общ) от концентрации С uС12. Из рисунка 2 видно, что общая скорость коррозии в 2,5-5 раз ниже iпред во всем интервале концентраций Cu2+,
Таблица 2.
| № п/п
| Параметры
| условно безводный спирт
| смешанный растворитель
|
|
|
|
| концентрационный интервал CuC 12
|
| концентрационный интервал CuC 12
|
| 1
| (¶ lgiэх / ¶ lgCCu2+)
| 0,12
| 10-4 –10-1
| 0
| 10-4 -10-2
|
|
|
|
|
| 0,80
| 10-2 - 10-1
|
| 2
| (¶ lgiкор,общ / ¶ lgCCu2+)
| 0,12
| 10-4 –10-1
| 0
| 10-4 -10-2
|
|
|
|
|
| 0,90
| 10-2 - 10-1
|
| 3
| (¶ lgiпред / ¶ lgCCu2+)
| 0,20
| 10-4 –10-1
| 0
| 10-4 -10-2
|
|
|
|
|
| 1,20
| 10-2 - 10-1
|
| 4
| (¶ lg(iкор,общ- i0) / ¶ lgCCu2+)
| 0,50
| 10-4 –10-1
| 0
| 10-4 -10-2
|
|
|
|
|
| 2,10
| 10-2 - 10-1
|
| 5
| (¶ lgia / ¶ lgCCu2+)
| -0,46
| 10-4 –10-1
| -1,4
| 10-4 -10-2
|
а, следовательно, коррозия протекает не на предельном токе и не связана с транспортными ограничениями окислителя-деполяризатора к поверхности электрода.
Порядок общей скорости коррозии по С uС1 2, представляющий собой тангенс угла наклона соответствующей прямой равен 0,12; iэх и iпред также возрастают с порядками 0,12 и 0,20 соответственно (таб. 2). Поскольку коррозия меди в солянокислых изопропанольных растворах НС1 с добавками Cu2+, с одной стороны, вызвана, кислотностью среды, а с другой - влиянием CuC12, то общая скорость коррозии, очевидно, будет представлять собой сумму:
iкор ,общ = i0 + iCu2+, (43)
где i0 - скорость коррозии меди, обусловленная кислотностью среды, а iCu2+ - влиянием ионов Cu2+ на растворение меди в изопропанольных средах.
В свою очередь, iCu2+ складывается из плотности тока электрохимической коррозии (iэх, Cu2+) и плотности тока неэлектрохимической составляющей (iх):
iCu2+ = iэх, Cu2+ + iх. (44)
Порядок скорости коррозии меди, обусловленной введением ионов CuC12 в раствор (¶ lg(iкор,общ - i0)/ ¶ lgCCu2+) заметно повышается и составляет 0,5 (таб. 2, рис. 2).
Оценим влияние ионов Cu2+ на анодную реакцию ионизации металла. Добавки хлорной меди в 5М у.б. изопропанольный раствор НС1 повышает ионную силу раствора (J).
J = 1/2 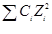 , (45)
, (45)
где С i - концентрация иона; Zi -заряд иона.
Вели чина J в нашем случае представляет собой сумму:
J = 1/2 (CH+ + CC1- + 4CCu2+), (46)
где CH+ = CHC1; С Cu 2+ = 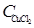 ; С C1 - = CHC1 + 2
; С C1 - = CHC1 + 2 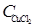
Рис.3. а) Анодные поляризационные кривые на меди в растворах состава 5М НС1 + х М С u С12 в у.б изопропиловом спирте. Неподвижный электрод. Комнатная температура. Воздух.
х: 1-10-4; 2-10-3; 3-5.10-2; 4-10-1.
б) Нахождение порядка реакции анодной ионизации по данным рис. 3 а.
Подставляя концентрации ионов в уравнение (46) получим:
J = CHC1 + 3 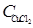 . (47)
. (47)
Так как ионная сила раствора одно-одновалентных электролитов равна концентрации растворенного вещества, то изменение ее за счет введения соли будет составлять величину D J:
D J = J-J0, (48)
где J0 - ионная сила фонового раствора.
Поскольку концентрация фонового электролита достаточно высока (5 моль/л НС1), то введение соли в концентрации 10-4 -10-1 моль/л весьма незначительно повышает величину J, а, следовательно этим изменением можно пренебречь (таб. 3). Последнее допущение дает возможность считать постоянными коэфициенты активности, а, следовательно, и активности ионов электролитов согласно первому приближению Дебая-Гюккеля:
lg f ± = - A 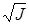 (49)
(49)
Таблица 3.
Влияние изученных концентраций CuС12 на ионную силу раствора
М НС1 в изопропаноле.
| Ошибка измерения ионной силы раствора
| Концентрация CuC12, моль/л
|
|
|
| 10-4
| 10-3
| 10-2
| 5.10-2
| 10-1
|
| Абсолютная
D J = J- J0,
|
| 3.10-4
| 3.10-3
| 3.10-2
| 1,5.10-1
| 3.10-1
|
Относительная
l = 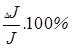 , ,
|
| 6.10-3
| 6.10-2
| 0,6
| 2,9
| 5,76
|
Изменение концентрации хлор-иона за счет добавок CuC12 в 3 раза меньше. Это означает, что на процесс анодной ионизации меди в исследуемых растворах влияют почти исключительно ионы Cu2+. Соответствующие полярзационные кривые в 5М у.б. изопопанольных растворах приведены на рис. 3 а. Тафелевский наклон анодных поляризационных кривых составляет 50 мВ, что находится в соответствии с литературными данными [16] и говорит в пользу ненизменности механизма анодной ионизации в изопропанольных растворах НС1.
Экстраполируя начальные участки анодных кривых, соответствующие активному растворению металла на линию постоянного потенциала (0,04 В) находим значения логарифмов ia, которые наносим на график зависимости lgia от lgСС u2+ (рис. 3 б). Тангенс угла наклона полученной прямой, представляющий собой порядок реакции анодной ионизации меди по Cu2+, составляет -0,46. Отрицательная величина (¶ lgiа / ¶ lgCCu2+) указывает на ингибирующее действие ионов Cu2+ в анодной реакции ионозации меди. Таким образом, положительная величина порядка электрохимической скорости коррозии по CuС12 обусловлена, прежде всего, участием ионов Cu2+ в катодной реакции (12).
Влияние воды в растворителе в количестве 10 мас.% на скорость коррозии, определенную по потерям массы образцов, неоднозначно. В случае небольших добавок CuC12 (10-4 - 10-2) вода оказывает слабый ингибирующий эффект, а для более концентрированых растворах по CuC12 - стимулирует коррозию (рис.4).
В 5М изопропанольных растворах НС1 с 10 мас.% Н2О в растворителе и добавками CuC12 наблюдаются, в основном, те же закономерности, что и в у.б. растворах: коррозия меди протекает не на предельном токе (iкор,об < iпред), а скорость электрохимического растворения ниже общих коррозионных потерь приблизительно в 2 раза во всех исследуемых растворах (таб. 4).
Таблица 4.
Влияние добавки CuС12 на общие коррозионные потери,



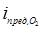 ) и предельного тока по Cu2+ (iпред,С u2+):
) и предельного тока по Cu2+ (iпред,С u2+):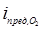 + iпред,С u2+ (42)
+ iпред,С u2+ (42)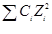 , (45)
, (45)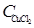 ; С C1 - = CHC1 + 2
; С C1 - = CHC1 + 2 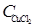
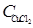 . (47)
. (47)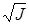 (49)
(49)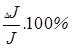 ,
,



