Пространственные (федоровские)[4] группы симметрии получают при взаимодействии элементов симметрии структур с 14-ю ячейками Бравэ. Всего существует 230 пространственных групп симметрии. Это одна из природных констант.
Точечные группы симметрии характеризуют симметрию внешней формы кристалла и их физических свойств. Каждой точечной группе соответствуют несколько пространственных групп симметрии. Пространственные группы симметрии характеризуют симметрию структуры кристалла. Кристалл – твердое тело структура которого описывается одной из 230 пространственных групп симметрии.
Для обозначения пространственных групп используют международные символы или символы Шенфлиса. Принципы записи пространственной группы приведены в табл.Таблица 2
Таблица 2 – Принципы записи пространственной группы

Международный (интернациональный) символ пространственной группы составлен так, что по его записи можно представить весь набор элементов симметрии. На первом месте всегда указывается буква обозначающая тип ячейки Бравэ, далее порождающие элементы симмтерии, каждый на определенном месте (см. табл.Таблица 2). Нарушение порядка записи меняет смысл символа. При обозначении международными символами необходимо соблюдать ряд правил:
- Если в одном направлении есть и плоскости зеркального отражения, и плоскости скользящего отражения, то в символ группы вводится обозначение плоскости зеркального отражения.
- Если в одном направлении есть и плоскости, и оси, то в символе указывается плоскость.
- Если в одном направлении есть оси различных порядков, то записывается старшая из них.
- Если в каком-то месте нет элемента симметрии, то записывается 1.
Пример: Структура алмаза (рис. Рисунок 16) пространственная группа записывается так: Fd3m, что означает, алмаз кристаллизуется в кубической сингонии (цифра 3 в третьем положении), F-тип ячейки Браве (гранецентрированная), в координатном направлении есть алмазные плоскости скользящего отражения, а в диагональном – зеркальные плоскости.
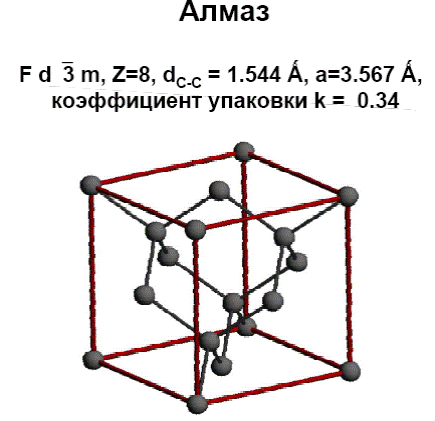
Рисунок 16 – Структура алмаза. Z – число формульных единиц, dс-с – положение алмазной плоскости, а- межатомное расстояние
В приложении Приложение 1 приведены примеры некоторых кристаллических структур.
8 Типы химической связи в кристаллах
Силы, которые связывают вместе атомы (ионы) в кристаллах - это электрические силы. Их тип и величина во многом определяют физические и химические свойства минералов. Используя представления о валентных электронах, принято выделять четыре основных типа химической связи в минералах.
Металлическая связь характерна для элементов первых групп Периодической системы и интерметаллидов. Их атомы, как известно, имеют крупные размеры, а внешние электроны слабо связаны с ядром. В кристаллической решетке металлов внешние электроны свободно перемещаются в пространстве между атомами. Они образуют своеобразный "электронный газ" и обусловливают основные свойства металлов: высокую пластичность, ковкость, высокую теплопроводимость, высокую электропроводность, малую твердость, невысокие точки плавления и кипения. Связь не направленная. Энергия металлической связи составляет десятки килокалорий на моль.
Ковалентная (гомеополярная) связь осуществляется за счет обобществления электронов на внешних валентных орбиталях двух соседних атомов, таким образом, что оба они приобретают стабильную конфигурацию благородного газа. Ковалентная связь строго направленная, насыщаемая и очень прочная. Энергия связи составляет до 170 ккал/моль. Минералы с таким типом связи характеризуются нерастворимостью, большой устойчивостью, высокой твердостью, высокими точками плавления и кипения, полупроводниковыми свойствами.
Ионная (гетерополярная) связь реализуется между атомами различного сорта за счет электростатического взаимодействия положительно заряженных катионов и отрицательно заряженных анионов, при этом валентные электроны переходят от металла к аниону. Связь ненаправленная и ненасыщенная. Энергия ионной связи тем больше, чем больше разница электроотрицательности между элементами (для NaCl - 180 ккал/моль). Кристаллы с ионным типом связи растворяются в полярных растворах (вода), для них характерны диэлектрические свойства, хрупкость, низкая тепло- и электропроводность, средние плотность и твердость, весьма высокие точки плавления и кипения.
Ван-дер-ваальсова (остаточная) связь соединяет нейтральные молекулы или структурные единицы с помощью малых остаточных зарядов на их поверхности, образующихся за счет мгновенных дипольных моментов "ядро-электрон", между которыми начинают действовать силы притяжения. Это явление носит название дисперсионного эффекта и служит главной причиной возникновения ван-дер-ваальсовой связи. Кроме того могут возникать и другие эффекты (ориентационный, индукционный). В разных соединениях сила каждого эффекта различна. Ван-дер-ваальсова связь одна из самых слабых химических связей и, присутствуя в минералах в качестве добавочной, определяет зоны хорошей спайности и низкой твердости (графит).
Среди ван-дер-ваальсовых связей особое место занимает так называемая водородная связь, рассматриваемая часто как самостоятельный тип связи. Она возникает за счет коллективного использования протона двумя атомами, например, кислорода, входящего в состав воды, и кислорода стенок каркаса, в котором эта молекула воды находится. Водородная связь слабее ионной или ковалентной, но сильнее обычной ван-дер-ваальсовой. Энергия водородной связи колеблется от 5 до 10 ккал/моль.
- Гомодесмическими называются структуры кристаллов, в которых связь между всеми атомами одинакова.
- Гетеродесмическими называются структуры кристаллов, в которых сосуществуют несколько типов химической связи.







