В однокомпонентных или многокомпонентных системах могут реализоваться состояния, когда в равновесии находятся несколько фаз. Такое состояние называется гетерогенным равновесием.
Гетерогенное равновесие в системе, состоящей из Ф -фаз и К -компонентов реализуется при следующих условиях:
Ф столбцов

 Т 1= Т 2= Т 3=…= Т ф
Т 1= Т 2= Т 3=…= Т ф
Р 1= Р 2= Р 3…= Р ф
 µ11=µ12=µ13=…=µ1ф (К+2) - строки (3.2)
µ11=µ12=µ13=…=µ1ф (К+2) - строки (3.2)
µ21=µ22=µ23=…=µ2
К – строк
µк1=µк2=µк3=…=µкф
где верхний индекс К - обозначает номер компоненты, нижний Ф - номер фазы, µкф – химический потенциал К - компонента в Ф -фазе. Представление о химическом потенциале является центральным в фазовом равновесии.
Система уравнений (3.2) состоит из (К +2) строк и Ф и столбцов. В первых двух строках записано условие, что температура каждой фазы и давление надкаждой фазой одинаковы во всей системе. В следующих К строках зафиксировано положение, что химический потенциал µi данного компонента во всех фазах одинаков.
Химическим потенциалом i -того компонента называется работа, затраченная на увеличение числа частиц i -того сорта в системе на единицу при постоянстве всех остальных переменных, от которых зависит термодинамический потенциал (под частицами подразумевают атомы, молекулы).
В зависимости от условий, в которых находятся фазы, для их описания применяют следующие термодинамические потенциалы:
G – изобарно-изотермический потенциал (потенциал Гиббса),
F – свободная энергия (энергия Гельмгольца) или изохорно-изотермный потенциал,
U – внутренняя энергия системы,
H – энтальпия системы (теплота плавления, кристаллизации).
G = H – TS или G = PV – TS, (3.3)
где S – энтропия.
Химический потенциал представляет собой частную производную одного из термодинамических потенциалов по числу частиц i -того компонента в фазе:
μ=  (3.4)
(3.4)
где N – число частиц в однокомпонентной фазе.
При анализе гетерогенного равновесия важно знать: сколько фаз должно находиться в равновесии, и какое число параметров системы можно изменить независимо, не изменяя числа фаз, находящихся в равновесии. Ответ на это вопрос дает закон, открытый в 1876 году Гиббсом и известный под названием «правило фаз».
В качестве параметров системы в однокомпонентных системах выступают температура (Т) и давление (Р), в многокомпонентных системах – Т, Р и концентрация компонентов в каждой фазе – Х. В каждой фазе, состоящей из К -компонент, число переменных концентраций равно: 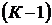 , так как
, так как 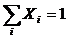 . Пример: двухкомпонентная система ХА+ ХВ=1, ХА= 1–ХВ.
. Пример: двухкомпонентная система ХА+ ХВ=1, ХА= 1–ХВ.
Такие внешние параметры, как характеристики полей, в которых находятся фазы, при анализе физико-химических равновесий обычно не учитываются в предположении, что они остаются постоянными.
Число степеней свободы или вариантность системы – С – число параметров системы, которые можно изменять, не изменяя числа фаз, находящихся в равновесии. Величина С равна числу независимых переменных, т.е. минимальному числу переменных параметров, выбор которых однозначно устанавливает и все остальные параметры. Таким образом, величина С равна разности между общим числом переменных параметров системы и числом уравнений связи. Общее число переменных параметров в системе (3.2): Ф (К –1)+2.
Вариантность системы, состоящей из К – компонентов и F – фаз, когда в качестве внешних параметров выступают только Р и Т равна:
С = [(К -1) Ф + 2] – [ К (Ф – 1)]
Правило фаз (или закон Гиббса) дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов:
C = K – F + 2 (3.5)
математическая запись правила фаз или закона Гиббса, где C – число степеней свободы, т.е. число внешних (температура и давление) и внутренних (концентрация) факторов, которые можно изменить без изменения числа фаз;
K – число компонентов в системе;
F – число фаз.
В тех случаях, когда число внешних параметров уменьшается на единицу (Р=const или Т= const), правило фаз записывается следующим образом:
C = K – F + 1 (3.6)
В тех случаях, когда число внешних параметров равно нулю, то есть давление Р или температура Т - постоянны (Р=const и Т= const), правило фаз записывается:
C = K – F (3.7)
Пример: если С = 0, то любое изменение температуры вызывает изменение числа фаз; если С = 1, то возможно изменение температуры без изменения числа фаз.
В жидком состоянии:
F = 1 – одна фаза;
К = 1 – один компонент (чистый металл);
С = 1 – 1 + 1 = 1 – можно изменять температуру без изменения агрегатного состояния.
Степень свободы для сплава в момент кристаллизации:
F = 2 – две фазы (жидкость + кристаллы);
K = 1 – один компонент (чистый металл);
C = 1 – 2 + 1 = 0 – равновесие при строго определенной температуре (Тпл).
Число уравнений связи между переменными (между концентрациями компонентов в фазе) получают, исходя из требований одинаковости химического потенциала данного компонента во всех фазах системы (при равновесии), т.к. химический потенциал компонента в фазе зависит от концентрации компонента. Эта зависимость выражается уравнением:
µ=µ0+ kТ ln(γХ) (3.8)
где µо – химический потенциал компонента в стандартном состоянии (при нормальных условиях), γ – коэффициент активности компонента в фазе, k – постоянная Больцмана, Х – концентрация компонента в фазе.
Следовательно, в условиях фазового равновесия происходит равновесное перераспределение компонентов между фазами.
Рассмотрим пример: в системе, состоящей из 2-х компонент (К =2), в условиях двухфазного равновесия (Ф =2) для любого из компонентов, (например, для компонента 1) реализуется равенство:
 =
=  (3.9)
(3.9)
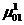 + kTln(
+ kTln(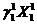 ) =
) = 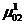 + kTln(
+ kTln(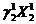 ) (3.10)
) (3.10)
ln[  ] = (
] = (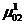 –
– 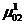 )/kT(3.11)
)/kT(3.11)
k 0 =  (3.12)
(3.12)
где k 0 =  – равновесный коэффициент распределения. В рассматриваемом случае коэффициент распределения компонента 1 между фазами 1 и 2 (например,
– равновесный коэффициент распределения. В рассматриваемом случае коэффициент распределения компонента 1 между фазами 1 и 2 (например,  – отношение концентрации в фазе 1 и фазе 2 компонента 1, (отношение концентраций компонента 1 в твердой и в жидкой фазе). Таким образом, распределение компонентов (точнее распределение концентраций компонентов) между фазами характеризуется равновесным коэффициентом распределения, величины которых получают из уравнений связи типа (3.12).
– отношение концентрации в фазе 1 и фазе 2 компонента 1, (отношение концентраций компонента 1 в твердой и в жидкой фазе). Таким образом, распределение компонентов (точнее распределение концентраций компонентов) между фазами характеризуется равновесным коэффициентом распределения, величины которых получают из уравнений связи типа (3.12).
В общем случае число уравнений связи для гетерогенного равновесия в многофазной системе получают из к нижних строк системы (3.2) и оно равно: К (Ф – 1).
Для анализа фазовых равновесий правило фаз применяют в виде (3.5; 3.6; 3.7) в зависимости от условий, в которых находится система.




 Т 1= Т 2= Т 3=…= Т ф
Т 1= Т 2= Т 3=…= Т ф µ11=µ12=µ13=…=µ1ф (К+2) - строки (3.2)
µ11=µ12=µ13=…=µ1ф (К+2) - строки (3.2) (3.4)
(3.4)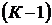 , так как
, так как 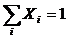 . Пример: двухкомпонентная система ХА+ ХВ=1, ХА= 1–ХВ.
. Пример: двухкомпонентная система ХА+ ХВ=1, ХА= 1–ХВ. =
=  (3.9)
(3.9)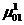 + kTln(
+ kTln(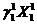 ) =
) = 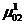 + kTln(
+ kTln(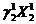 ) (3.10)
) (3.10) ] = (
] = ( (3.12)
(3.12) – равновесный коэффициент распределения. В рассматриваемом случае коэффициент распределения компонента 1 между фазами 1 и 2 (например,
– равновесный коэффициент распределения. В рассматриваемом случае коэффициент распределения компонента 1 между фазами 1 и 2 (например, 


