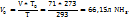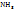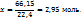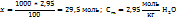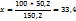1. Найдем массу 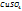 приходящуюся на 1000г
приходящуюся на 1000г 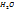
Т.к. раствор имеет ω 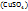 = 4,0%, то:
= 4,0%, то:
На 4 г 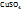 приходится (100-4) г
приходится (100-4) г 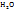
xr 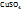 -----‘’----- 1000г
-----‘’----- 1000г 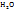

2. Рассчитаем число моль 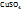 , приходящихся на 1000г
, приходящихся на 1000г 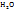
1 моль 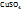 – 160 г
– 160 г
y моль 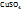 – 41,67 г
– 41,67 г
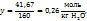
Таким образом, моляльная концентрация раствора 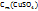 = 0,26 моль/кг
= 0,26 моль/кг 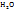
Определение молярной концентрации раствора
1. Найдем массу литра раствора с ω 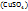 =4%
=4%
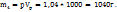
2. Найдем массу 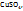 содержащуюся в 1л раствора с ω
содержащуюся в 1л раствора с ω 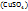 =4%:
=4%:
в 100г раствора – 4 г 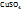
в 1040г раствора – х г 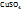
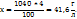
3. Найдем число моль 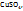 содержащихся в 1л раствора:
содержащихся в 1л раствора:
1 моль 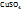 -160г
-160г
Y моль 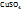 - 41,6г
- 41,6г
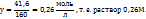
Определение титра раствора
1. Зная, что в 1л (1000мл) раствора с ω 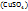 =4% содержится 41,6г
=4% содержится 41,6г 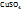 (см. выше), определим:
(см. выше), определим:
41,6г 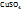 – 1000мл раствора
– 1000мл раствора
xг 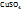 - 1мл раствора
- 1мл раствора

Пример 3.2. Какой объем раствора KOH с ω(KOH)=5%, плотность которого 1,04г/мл, требуется для реакции полного осаждения Fe из 50мл раствора с ω 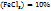 .
.
Решение.
1. Определим массу 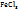 , содержащуюся в 50 мл 10%-го раствора:
, содержащуюся в 50 мл 10%-го раствора:
в 100г раствора содержится 10г 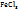
в (50-1,09)г раствора ----‘’---- mr 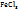
m(
2. По уравнения реакции:
3KOH + 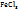 = Fe
= Fe 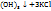
3,56г-162,5г
Вычисляем массу KOH, требуемую для реакции с содержащимися в растворе 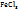
162,5г 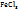 , взаимодействует с 168 г KOH
, взаимодействует с 168 г KOH
5,45г 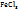 -----‘’----- m г KOH
-----‘’----- m г KOH
m(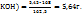
3. По массе KOH, концентрации раствора и плотности его вычисляем объем раствора KOH
в 100г 5%-го раствора KOH - 5г KOH
в 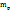 г -----‘’----- - 5,64 г KOH
г -----‘’----- - 5,64 г KOH
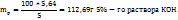
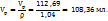
Пример 3.3. Для нейтрализации 70мл раствора соляной кислоты потребовалось 200мл 0,3H раствора NaOH. Какова молярная концентрация эквивалентов HCl?
Решение. Эту задачу следует решать, используя соотношение:
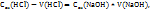
Из которого получаем:
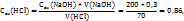
Следовательно, раствор соляной кислоты 0,86 H.
Примечание. Молекулярную концентрацию эквивалентов вещества необходимо рассматривать применительно к реакциям. Так, например, при полной нейтрализации серной кислоты едким натром:
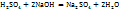
Число эквивалентности Z( =2;
=2;
эквивалент Э(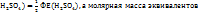
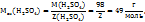
следовательно, в данном случае 1H раствором 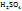 будет раствор, в литре которого содержится 49г
будет раствор, в литре которого содержится 49г 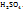
Для реакции частичной нейтрализации и непонятного обмена эквивалентов 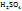 будет определятся реакцией:
будет определятся реакцией:
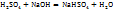
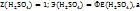
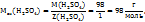
Поэтому в этом случае 1H раствором 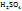 будет раствор, в титре которого содержится 98г
будет раствор, в титре которого содержится 98г 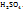
Пример 3.4. Рассчитайте молярную концентрацию эквивалентов растворенного вещества следующих растворах: 0,2М р-р Al 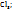 0,6Mp-p
0,6Mp-p 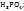 0,7Mp-p
0,7Mp-p  принимая максимальное значение числа эквивалентности.
принимая максимальное значение числа эквивалентности.
Решение. Воспользоваться отношением: 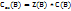 .
.
Чтобы перейти от молярной концентрации вещества к молярной концентрации эквивалентов, нужно молярную концентрацию С(В) умножить на число эквивалентности Z(B).
При обратном переходе молярную концентрацию эквивалентов необходимо разделить на число эквивалентности Z(B).
Для электролитов 1:1 (NaCl, KOH, HI и др.) молярная концентрация вещества равна молярной концентрации эквивалентов вещества, т.к. Z(B)=1.
Для сложных электролитов (Al 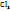 ;
; 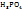 ;
; 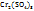 и др.) молярная концентрация эквивалентов
и др.) молярная концентрация эквивалентов 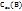 больше, чем молярная концентрация вещества В, т.к. Z(B)>1.
больше, чем молярная концентрация вещества В, т.к. Z(B)>1.
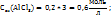
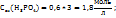
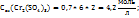
Пример 3.5. Приготовить 70мл раствора с ω(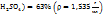 путем смешения раствора ω(
путем смешения раствора ω(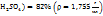 и ω(
и ω(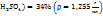 .
.
Решение. Задачу удобней решать по правилу смешения (правилу креста), согласно которому массы смешиваемых растворов обратно пропорциональны разностям концентраций смеси и отдельных е компонентов.
1. Записываем друг под другом массовые доли некоторых растворов, а правее между ними массовую долю раствора, который необходимо приготовить. Затем из большей массовой доли вычитаем заданную и записываем результат справа снизу; из заданной массовой доли вычитаем наименьшую и записываем результат справа вверху


 82 29
82 29

 63
63
 34
34 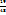
Число 29 и 19 показывают, в каком массовом отношении надо взять растворы ω(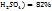 в ω(
в ω(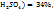 соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(
соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(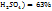 необходимо смешать 29г раствора с ω(
необходимо смешать 29г раствора с ω(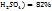 и 19г раствора с ω(
и 19г раствора с ω(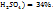
2. Определим массу раствора серной кислоты ω(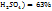 :
:
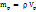 = 1,535*70=107,45г.
= 1,535*70=107,45г.
3. Определим массу в объем раствора с 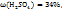 необходимые для искомого раствора.
необходимые для искомого раствора.
Для приготовленных 48г 83%-го р-ра необходимо взять 29г 82%-го р-ра
107,45 ----‘’---- x г
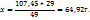
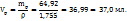
2. Определим массу и объем раствора с ω(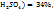 необходимого для приготовления искомого раствора:
необходимого для приготовления искомого раствора:
Для приготовления 48г 63%-го р-ра – 19г 34%-го р-ра
107,45 ----‘’---- y г
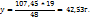
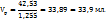
Таким образом для приготовления 70 мл раствора с ω(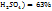 нужно смешать 37,0 мл 82%-го и 33,9 мл 34%-го растворов.
нужно смешать 37,0 мл 82%-го и 33,9 мл 34%-го растворов.
Пример 3.6. Сколько граммов кристаллогидрата Cu 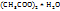 и раствора с ω(Cu
и раствора с ω(Cu 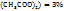 нужно взять для приготовления 580г растворе веществ меди с ω(Cu
нужно взять для приготовления 580г растворе веществ меди с ω(Cu 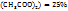 .
.
Решение. Сложность этого примера состоит в том, что кристаллогидрат содержит воду, которая добавляется при приготовлении раствора к воде взятой в качестве растворителя. Имеется несколько способов решения. Приведем один из них.
Кристаллогидрат Cu 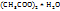 можно рассматривать как твердый водный раствор. Определим
можно рассматривать как твердый водный раствор. Определим 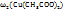 в кристаллогидрате.
в кристаллогидрате.
Cu  Cu
Cu 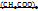
M = 200 г/моль М=182 г/моль
В 200г Cu 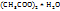 содержится 182г Cu
содержится 182г Cu 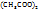
В 100г -----‘’----- xг
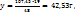 т.е. кристаллогидрат представляет собой раствор с
т.е. кристаллогидрат представляет собой раствор с 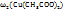 =91%.
=91%.
Теперь сформулируем исходное условие следующим образом: необходимо приготовить 580г раствора ацетата меди с ω(Cu 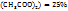 из растворов с
из растворов с 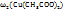 =91% и
=91% и 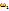 (Cu
(Cu 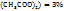 . Найдем их массы, используя правило смешения.
. Найдем их массы, используя правило смешения.


 91 22
91 22

 25
25
 3
3 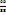
Из схемы видно, что для приготовления 88г (22+66) раствора ацетата меди с ω(Cu 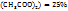 нужно в 66г раствора с
нужно в 66г раствора с 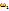 (Cu
(Cu 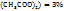 растворить 22г кристаллогидрата меди, а для приготовления 580г 25% раствора массы смешиваемых компонентов определяются из пропорции:
растворить 22г кристаллогидрата меди, а для приготовления 580г 25% раствора массы смешиваемых компонентов определяются из пропорции:
88г 25% р-раCu 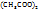 – 66г 3%-го р-ра
– 66г 3%-го р-ра
580г -----‘’-----‘’ 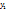 г
г
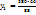 = 435г р-раCu
= 435г р-раCu 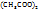 с
с 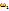 (Cu
(Cu 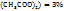 .
.
Аналогично найдем массу кристаллогидрата:
для приготовления 88г 25% р-раCu 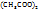 – 22г Cu
– 22г Cu 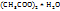
580г -----‘’-----‘’ 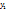 г
г
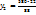 = 145г Cu
= 145г Cu 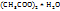 .
.
Пример 3.7. Определить коэффициент растворимости К (масса растворенного вещества (В) в г, приходящаяся на 100г растворителя) и массовую долю растворенного вещества ω(В) в %, если в 84,68 насыщенного раствора содержится 14,56г растворенного вещества
Решение.
1. Определяем ω(В) в %
в 84,68г раствора содержится 14,56г вещества
в 100г -----‘’----- ω(B)
ω(В) =  = 17,2г, т.е.
= 17,2г, т.е. 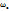 = 17,2%,
= 17,2%,
Пример 3.8. Масса раствора, насыщенного при 343К, равна 401,11г масса воды в этом растворе на 21,11г больше массы соли. Сколько грамм соли выделится из этого раствора, если его охладить до 293К. Какова массовая доля соли в растворе до и после охлаждения, если в 100г воды при 293К растворяется 65,5г соли?
Решение. Массу соли принимаем за m(B). Тогда масса соли равна (m(B)+21,11), а их сумма: m(B)+(m(B)+21,11) =401,11г представляет собой массу раствора. Решаем полученное уравнение относительно m(B): 2m(B)=401,11-21,11=380г; m(B)=190г, следовательно, в 401,11г насыщенного при 343К раствора содержится 190г соли и 211,11г воды. При охлаждении раствора до 293К масса воды не изменяется.
По условию в 100г воды растворяется 65,5 г соли,
В 211,11 ----‘’---- x г
x = 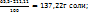
Тогда при охлаждении из раствора выделяется (190,00-137,22) =52,78г соли. Массовая доля соли в растворе при 343К определяется из пропорции:
в 401,11г раствора содержится 190г соли
в 100г ----‘’---- 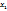 г
г
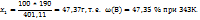
Масса раствора при понижении температуры до 293 уменьшится на 52,78 и будет 401,11-52.78=348,33г.
Массовая доля соли в растворе при 293К вычисляется из пропорции:
в 348,33г раствора содержится 137,22г соли
в 100г ----‘’---- 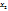

Пример 3.9. При выпаривании 1 кг раствора с массовой долей NaOH=16% удалено 100г воды. Какова массовая доля, %, NaOHв растворе после выпаривания?
Решение. В 1 кг раствора с ω(NaOH)=16% содержится 160г едкого титра. После выпаривания 100г воды из раствора масса его стала 900г (104-100), а масса NaOH осталась прежней, т.е. 160г. Найдем концентрацию раствора после выпаривания воды.
В 900г раствора содержится 160г NaOH
В 100г ----‘’---- x
X= 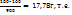 ω (NaOH)=17,78 %.
ω (NaOH)=17,78 %.
Пример 3.10. При температуре 293К и давлении Р-760мм Hg в 100г воды растворяется 71л аммиака. Определить моляльную концентрацию в массовую долю аммиака, %, в растворе.
Решение.
1. Поскольку объем аммиака зафиксирован при Т=293К, необходимо привести его к нормальным условиям, используя соотношение  = const:
= const:
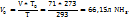
2. В соответствии с законом Авогадро:
22,4л (н.у.) – 1 моль 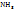
66,15 - x моль
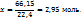
3. 2,95 моль аммиака имеют массу 2,95*17=50,2г, масса полученного по условию раствора составит 100+50.2=150,2г. Теперь моляльную и процентную концентрацию раствора аммиака рассчитывают на основе следующих пропорций:
На 100г воды в растворе приходится 2,95 моль 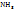
На 1000г ----‘’---- x моль 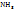
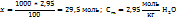
В 150,2г раствора содержится 50,2г 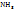
В 100г ----‘’---- x г
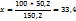
ω (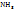 )=33,4%
)=33,4%



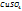 приходящуюся на 1000г
приходящуюся на 1000г 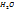
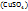 = 4,0%, то:
= 4,0%, то: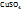 приходится (100-4) г
приходится (100-4) г 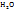

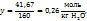
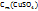 = 0,26 моль/кг
= 0,26 моль/кг 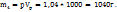
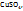 содержащуюся в 1л раствора с ω
содержащуюся в 1л раствора с ω 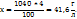
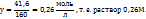

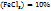 .
.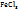 , содержащуюся в 50 мл 10%-го раствора:
, содержащуюся в 50 мл 10%-го раствора:
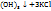
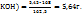
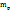 г -----‘’----- - 5,64 г KOH
г -----‘’----- - 5,64 г KOH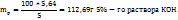
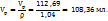
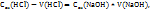
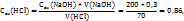
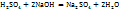
 =2;
=2;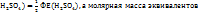
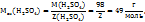
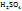 будет раствор, в литре которого содержится 49г
будет раствор, в литре которого содержится 49г 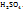
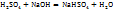
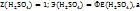
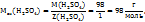
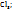 0,6Mp-p
0,6Mp-p 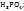 0,7Mp-p
0,7Mp-p  принимая максимальное значение числа эквивалентности.
принимая максимальное значение числа эквивалентности.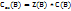 .
.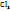 ;
; 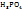 ;
; 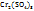 и др.) молярная концентрация эквивалентов
и др.) молярная концентрация эквивалентов 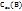 больше, чем молярная концентрация вещества В, т.к. Z(B)>1.
больше, чем молярная концентрация вещества В, т.к. Z(B)>1.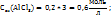
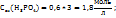
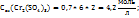
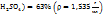 путем смешения раствора ω(
путем смешения раствора ω(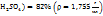 и ω(
и ω(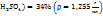 .
.

 82 29
82 29
 63
63 34
34 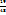
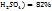 в ω(
в ω(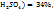 соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(
соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(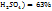 необходимо смешать 29г раствора с ω(
необходимо смешать 29г раствора с ω(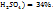
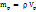 = 1,535*70=107,45г.
= 1,535*70=107,45г.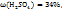 необходимые для искомого раствора.
необходимые для искомого раствора.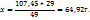
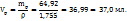
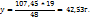
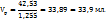
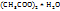 и раствора с ω(Cu
и раствора с ω(Cu 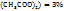 нужно взять для приготовления 580г растворе веществ меди с ω(Cu
нужно взять для приготовления 580г растворе веществ меди с ω(Cu 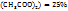 .
.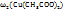 в кристаллогидрате.
в кристаллогидрате. Cu
Cu 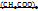
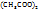
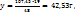 т.е. кристаллогидрат представляет собой раствор с
т.е. кристаллогидрат представляет собой раствор с  (Cu
(Cu 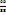
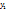 г
г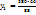 = 435г р-раCu
= 435г р-раCu 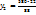 = 145г Cu
= 145г Cu  = 17,2г, т.е.
= 17,2г, т.е. 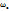 = 17,2%,
= 17,2%,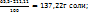
 г
г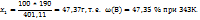

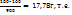 ω (NaOH)=17,78 %.
ω (NaOH)=17,78 %. = const:
= const: