

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
Полиакриламидный гель (ПААГ) обладает многими качествами идеального носителя. Имея свойства молекулярного сита, он обеспечивает электрофоретическое разделение белковых смесей не только по заряду, но и по размеру и форме частиц. При электрофорезе в ПААГ крупные молекулы, размеры которых соизмеримы с диаметром пор геля, движутся медленнее, а мелкие молекулы свободно и быстро проходят через поры геля. ПААГ формируют путем сополимеризации акриламида, создающего линейную основу, и N,N′-метиленбисакриламида (BIS), служащего для поперечных «сшивок» линейных цепей.
В результате сополимеризации образуется трехмерная сетка геля. Каждый второй углеродный атом линейной цепи содержит кислотную амидную группу (рис. 3), что обеспечивает гидрофильность полимера. В то же время ПААГ не содержит ионизируемых групп. Для сополимеризации нужны инициаторы и катализаторы (окислительно-восстановительные системы – и сточники свободных радикалов). Чаще всего используют систему из двух компонентов:
- персульфат аммония (ПСА, APS). Синоним - надсернокислый аммоний. Функция: инициатор полимеризации
- N,N,N’,N’-тетраметилэтилендиамин (ТЕМЕД, TEMED). Функция: катализатор образования ПААГ
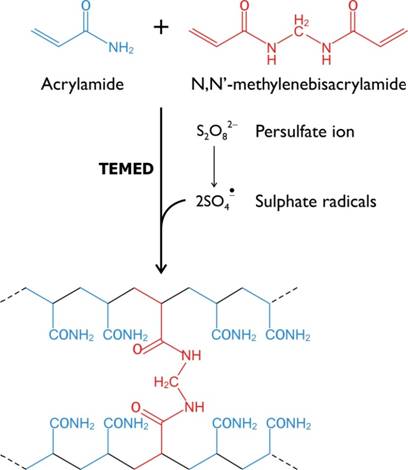
Рис.3. Реакция полимеризации полиакриламидного геля.
Меняя концентрацию акриламида от 2 до 50% можно задать определенную пористость геля. Например, диаметр пор в геле, содержащем 7.5% акриламида, равен 5 нм, а 30% акриламида - 2 нм. При выборе концентрации геля учитывают среднюю молекулярную массу (Mr) разделяемых веществ и форму их молекул. Отнеситесь к этому факту внимательно! Если плотность геля не будет соответствовать молекулярной массе исследуемого белка, то он, либо не войдет в гель, либо будет мигрировать с очень высокой скоростью и, как следствие, выйдет из геля раньше времени. Также в качестве параметров, влияющих на эффективность разделения, в особенности белков с приблизительно равной молекулярной массой, можно отметить время проведения электрофореза, длину разгоночной дистанции (чем больше гель, тем выше разрешение), температура процесса (при пониженной температуре белковые зоны меньше размываются за счет диффузии).
Таблица 2. Выбор концентрации акриламида для оптимального разрешения смеси белков[2]
| Концентрация акриламида, % | Линейный диапазон распределения, кДа |
| 12 – 43 | |
| 16 – 68 | |
| 7.5 | 36 – 94 |
| 57 – 212 |
В случае, когда требуется фракционировать белки исключительно по молекулярной массе, применяют ПААГ-электрофорез в денатурирующих условиях. Такая система была разработана в1970 годуЛэммли (англ. Laemmli) для изучения процесса сборки капсида четного бактериофага Т4. Для этого перед нанесением на гель образцы кипятили в присутствии додецилсульфата натрия (ДСН, SDS) и 2-меркаптоэтанола. Под воздействием 2-меркаптоэтанола происходило восстановление дисульфидных связей, что предотвращало выпетливание денатурированных полипептидов и повышение их подвижности. SDS является сильным детергентом, его молекула состоит из двенадцатичленной алифатической неразветвленной цепи и ковалентно связанного с ним сульфат-иона, имеющего в растворе отрицательный заряд.
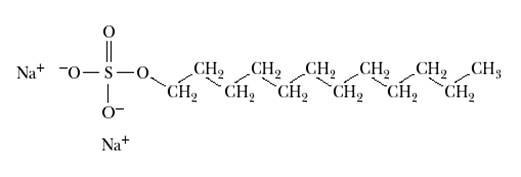
Рис.4. Структура SDS.
При использовании данного метода исходят из следующих допущений:
· белки после обработки SDS находятся в полностью денатурированном состоянии;
· количество молекул SDS, связанных с полипептидом, пропорционально его длине, и, следовательно, молекулярной массе;
· собственный заряд полипептида несущественен по сравнению с суммарным отрицательным зарядом связанных с ним молекул SDS;
· все полипептиды имеют одинаковый удельный заряд и разделяются обратно пропорционально логарифму их молекулярной массы.
При более реалистичном рассмотрении вопроса, эффективность разделения зависит не от молекулярной массы белка, а от его молекулярного радиуса, так называемого радиуса Стокса. Действительно, многие белки имеют аномальную подвижность при проведении электрофореза, что зависит от множества факторов, в результате которых меняется удельный заряд, размер и форма комплексов «белок-SDS». Тем не менее, практика подтверждает верность данных допущений в подавляющем большинстве случаев.
Для проведения денатурирующего электрофореза в ПААГ используются различные буферные системы. Наиболее распространённая система, которая подразумевается по умолчанию — это буферная система Лэммли. Кроме того, в подавляющем числе работ используют, так называемый, disc-электрофорез (от англ. discontinous — разрывный) то есть используют гель, состоящий из двух частей:
1) Формирующий (концентрирующий) гель имеет pH 6.8 и концентрацию полиакриламида от 2 до 8 %. Крупнопористый гель. Размер его пор ограничивает диффузию, но не обеспечивает гелю свойства молекулярного сита по отношению к большинству разделяемых белков. Этот гель нужен для электрохимического концентрирования белков пробы. Таким образом, концентрирующий гель собирает смесь белков перед переходом в разделяющий гель в одну узкую полосу.
2) Разделяющий гель имеет рН в районе 8.5 – 9 и концентрацию полиакриламида от 5 до 20 %. Это мелкопористый гель, в котором, собственно, и происходит электрофоретическое и молекулярно-ситовое разделение компонентов пробы.
Выбор плотности геля зависит от молекулярных масс исследуемых белков. Все буферы не содержат неорганических солей, основным переносчиком тока в них является глицин. При рН 6.8 суммарный заряд молекулы глицина близок к нулю. Вследствие этого для переноса определенного заряда (который определяется силой тока в электрофоретической ячейке), отрицательно заряженные комплексы полипептидов с SDS должны двигаться с большой скоростью. При рН 8.8 глицин приобретает отрицательный заряд, вследствие чего на границе концентрирующего и разделяющего гелей белки резко тормозятся. В переносе одинакового заряда через единицу площади теперь участвует гораздо больше заряженных молекул, следовательно, они двигаются с меньшей скоростью. Результатом этого является концентрирование белков на границе гелей, что очень сильно повышает разрешающую способность метода. В разделяющем геле белки мигрируют в зависимости от длины полипептидной цепи, то есть обратно пропорционально молекулярной массе.
1.5. Способы визуализации результатов (электрофореграмм).
Зоны разделившихся белков удобно анализировать, если их проявить, то есть, сделать видимыми невооруженным глазом. Проявление осуществляют либо с целью обнаружения всех белков, либо только белков с определенной ферментативной активностью. В последнем случае получают зимограммы (энзимограммы). Иногда делят белки, заранее меченые хромофором (например, флуорескамином), и обнаруживают их по флуоресценции в УФ-области спектра с помощью специального оборудования. Используют также и радиоактивную метку (радиоактивным углеродом или йодом). Регистрацию полос в этом случае проводят методом авторадиографии с помощью рентгеновской пленки.
Для окрашивания белковых зон на ПААГ-электрофореграмме используют несколько универсальных методов. Для этого разделившиеся зоны белков фиксируют раствором уксусной кислоты (1 – 10%), смесью уксусной кислоты и этанола (реже – метанола), раствором ТХУ, насыщенным раствором сульфата аммония и окрашивают, используя раствор красителя. Фиксация предотвращает размывание зон из-за диффузии белковых молекул в геле. Используют такие красители, как амидочерный (амидошварц), кумасси ярко-синий (марок G250, R250), Zn/имидазол, нитрат серебра. Окраска полос происходит пропорционально количеству белка в зоне. Окраска и количество полос, соответствующих белкам, также зависят от чувствительности того или иного красителя. Так, нитрат серебра выявляет зоны с меньшим содержанием белка, чем кумасси.
Чрезвычайно высокой чувствительностью отличаются методы окраски белковых полос при помощи Zn/имидазола и солей серебра. Проявление с помощью Zn/имидазола состоит в последовательной обработке геля растворами 0.2 М имидазола и 0.3 М ZnCl2 в очень чистой дистиллированной воде, полученной с применением ионообменной хроматографии и очистки на мембранных фильтрах (дистиллят milliQ). Сочетание этих реактивов позволяет выявить 30 – 100 нг белка на полосу. Окрашивание с использованием нитрата серебра приближается по чувствительности к авторадиографии.
В настоящее время самым удобным и широко используемым является краситель кумасси ярко-синий, или бриллиантовый синий («Coomassiebrilliantblue», он же ксилоловый яркий цианин), выпускаемый в двух модификациях: R-250 и G-250. Обе модификации кумасси плохо растворимы в воде и разбавленных кислотах, причем G-250 растворяется еще хуже, чем R-250. Более полному растворению способствует добавление в раствор кумасси метанола, изопропанола или других спиртов. Не растворившиеся примеси следует отфильтровать. По сравнению с другими красителями кумассиярко-синий имеет следующие преимущества:
- его чувствительность выше, чем у амидочерного и в большинстве случаев вполне подходит исследователям, - зависимость интенсивности окраски от концентрации белка остается линейной в более широком диапазоне концентраций,
- кумасси значительно дешевле и проще в использовании, чем нитрат серебра и не требует особо чистой дистиллированной воды, как Zn/имидазол
- в отличие от гелей, окрашенных Zn/имидазолом, гели при использовании кумасси можно хранить (либо высушить, либо поместить в 5%-ную уксусную кислоту, где существенного снижения интенсивности окраски полос не произойдет в течение 8-11 недель).
К недостаткам метода относится более низкая чувствительность, а также длительность процедуры отмывки геля от избытка связавшегося красителя. Для этих целей существуют модифицированные протоколы, например, окрашивание полиакриламидных гелей «коллоидным раствором кумасси». Также кумассиG250 используется для спектрофотометрического определения концентрации белков по методу Бредфорд[3].

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!