Цель работы: расчет активности компонентов в металлургических шлаках известного состава.
Свободная анергия одного моля смеси из К компонентов определяется уравнением
 (5.1)
(5.1)
где Fi – свободная энергия чистого компонента i;
Qij – энергия смешения компонентов i и j;
xi – ионная доля катиона компонента шлака
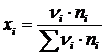 (5.2)
(5.2)
 – число молей i-го компонента;
– число молей i-го компонента;
Mi – молекулярная масса i -го компонента;
(i) – содержание i -го компонента в шлаке, % (по массе);
n i – число катионов в молекуле компонента (например, для Р 2 О 5 n i = 2).
Для определения коэффициента активности je –компонента используют приближение теории регулярных растворов Кожеурова.
 (5.3)
(5.3)
Рассмотрим, какой вид имеет уравнение (5.3) для шести компонентов шлака:

где xi – ионные доли компонента.
Основываясь на диаграммах состояния бинарных систем, получаем следующие данные по энергиям смешения:
Q 25 = –41,9 кДж; Q 36 = –201 кДж;
Q 35 = Q 45 = Q = –113 кДж; остальные Qij = 0.
Таким образом, преобразуя (4.8.3) и подставляя значения энергий смешения, получим следующие уравнения для оценки активности:
 (5.4)
(5.4)
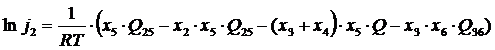 (5.5)
(5.5)
Аналогично можно определить j 3, j 4, j 5, j 6.
Активность компонентов шлака определяется как
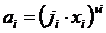 (5.6).
(5.6).
5.1. Пример расчета активности компонентов шлака (практ. задание №5)
Постановка задачи 1. Определить активность компонентов шлака заданного состава 30 % Р 2 О 5 +30 % СuО +40 % SiO2.
Решение. Определим молекулярные массы компонентов в шлаках


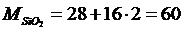
Число молей каждого компонента определится по отношению
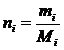
где mi – концентрации компонентов;
Mi – молекулярный вес компонентов.



Ионная доля катионов определяется по формуле (5.2) с учетом числа катионов –  ;
;  ;
; 

Постановка задачи 2. Определить содержание кислорода в жидком железе, равновесном со шлаком заданного состава.
Коэффициент распределения кислорода между металлом и шлаком определяется как
 (5.7)
(5.7)
где  – активность кислорода в металле;
– активность кислорода в металле;
 – активность FeO в шлаке.
– активность FeO в шлаке.
Предполагая, что в разбавленных растворах  , можно определить концентрацию кислороде как
, можно определить концентрацию кислороде как
 (5.8)
(5.8)
где  – концентрация кислорода в металле (жидком железе).
– концентрация кислорода в металле (жидком железе).
Из (5.7) с учетом (5.8) можно записать уравнениедля определения содержания кислорода в металле
 (5.9)
(5.9)
где  – температурная зависимость [2].
– температурная зависимость [2].


Для определения активности используем уравнение (5.3).
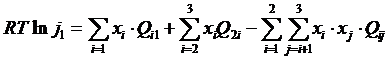

Считаем, что Q 13 = – 113 кДж, Q 12 = – 201 кДж,
остальные Q ij = 0.


Определим активность Р2О5 no формуле (5.6).

Аналогично можно определить  и
и  .
.
Значение а [ FeO ] определяетсz пo методологии, изложенной выше (задача 1). Таким образом, задавая температуру, мы можем построить зависимость [ O ] = j(Т) для различных составов шлака.
5.2. Пример расчета энергии смешения компонентов (практ. задание №5)
Одной из основных задач, возникающих при расчетах активности компонентов шлаковых систем, является задача оценки энергии смешения. Для определения энергии смешения двух компонентов 1 и 2 предложено использовать формулу
 (5.10)
(5.10)
где D Нп – теплота плавления оксида 1; Тп – температура плавдения оксида 1; Т, х 1, х 2 – температура и состав любой точки, выбранной на линии ликвидус; n1 – число катионов в молекуле компонента 1.
Пример определения энергии смешения системы СаО– TiО 2

Рис.5.I. Диаграмма, состояния оксидных систем СаО– TiО 2 и S iО2–Al2О3
Постановка задачи 3. Рассчитать энергию смешения системы СаО– TiО 2. Из диаграммы состояния системы (рис. 4.8.1) и по справочным данным определяем параметры системы со стороны СаО:
а) температуру плавления СаО – 2860 К;
б) теплоту плавления  – 75,36 кДж;
– 75,36 кДж;
в) температуру плавления эвтектики – 1968 К;
г) состав эвтектической точки (%по массе) – А = 63; В = 37;
д) молекулярную массу –  и
и  ;
;
е) число молей –  и
и 
ж)  ,
,
где n1 и n2 – число катионов в молекулах СаО и TiO 2.
з) ионные доли компонентов –  и
и 
Подставим в (5.10) значения вышеопределенных параметров (R =8,314×10–3 кДж/моль×град):

Аналогично находим параметры системы СаО– TiО 2 со стороны TiО 2.
а) температуру плавления TiО 2 – 2103 К;
б) теплоту плавления  – 66,99 кДж;
– 66,99 кДж;
в) температуру плавления эвтектики – 1733 К;
г) состав эвтектической точки (%по массе) – А = 81; В = 18,5;
д) молекулярную массу – 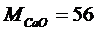 и
и  ;
;
е) число молей –  и
и 
ж)  ,
,
где n1 и n2 – число катионов в молекулах TiO 2 и СаО.
з) ионные доли компонентов –  и
и 

В данном случае усредненная энергия смешения будет равна

5.3. Расчет активности компонентов в кислых шлаках (практ. задание №5)
Основной структурной особенностью кислых силикатных расплавов является полимеризация кремнекислородных тетраэдров, обусломвленная недостатком ионов кислорода для насыщения валентности кремния. В этом случае в «кислом расплаве» имеется избыточное количество связей Si – О – Si.
По теории Кожеурова В.А. активность FeO в чатырехкомпонентном «кислом» шлаке FeO–СаО–SiО 2 –Al 2 O 3 определяется как
 (5.11)
(5.11)
Причем последнее слагаемое учитывается в случае х 3>  .
.
Для g 1 = 9600 Дж и g 2 =26300 Дж (g – параметр полимеризации). При вычислении (4.8.11) используют следующие энергии смешения:



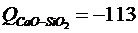


Пoправка, связанная с тем, что шлак является кислым, имеет вид:

где К – число компонентов шлака; xi – ионные доли компонентов, x3 – ионная доля SiO2.
Пример для расчета активности компонентов кислого шлака для заданной температуры
Постановка задачи 4. Определить активность шлака состава
8,15 % FeO +29,4 % СаО + 51 % SiО 2 + 11,45 % Al 2 O 3
для температуры Т = 1570 К.
Решение:
а) определяем молекулярную массу оксидов




б) определяем число молей компонентов


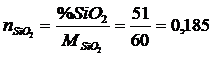

в) определяем ионные доли компонентов


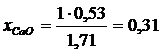
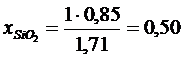

г) расчет 1-го члена активности (5.11)

д) расчет 2-го члена активности (5.11)


е) так как х 3>  , то учитываем последний член уравнения (5.11):
, то учитываем последний член уравнения (5.11):

 ;
; 
Список литературы
1. Рузинов Л.П., Гуляницкий Б.С. Равновесные превращения металлургических реакций.– М.; Металлургия, 1975. – 416 с.
2. Киреев В.А. Методы практических расчетов в термодинамике химических реакций. – M.: Химия, 1970. – 619 с.
3. Герасимов Я.И., Крестовников А.Н., Шахов А.С. Химическая термодинамика в цветной металлургии: в 2 т. – Металлургия, 1960, Т.1. – 230 с.
4. Кожеуров В.А. Термодинамика металлургических шлаков». – Свердловск: Металлургиздат, 1956, – 163 с.
5. Физико-химические свойства окислов / Под ред. Г.В. Самсонова. – М.: Металлургия, 1978, – 472 с.
6. Рыжонков Д.И., Падерин С.Н., Серов Г.В. Расчеты металлургических процессов на ЭВМ. – М.: Металлургия, 1987. – 231 с.



 (5.1)
(5.1)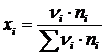 (5.2)
(5.2) – число молей i-го компонента;
– число молей i-го компонента; (5.3)
(5.3)
 (5.4)
(5.4)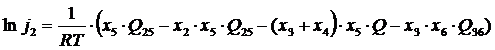 (5.5)
(5.5)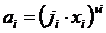 (5.6).
(5.6).

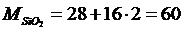
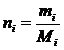



 ;
;  ;
; 

 (5.7)
(5.7) – активность кислорода в металле;
– активность кислорода в металле; – активность FeO в шлаке.
– активность FeO в шлаке. , можно определить концентрацию кислороде как
, можно определить концентрацию кислороде как (5.8)
(5.8) – концентрация кислорода в металле (жидком железе).
– концентрация кислорода в металле (жидком железе). (5.9)
(5.9) – температурная зависимость [2].
– температурная зависимость [2].

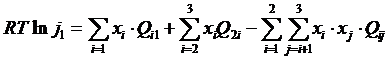




 и
и  .
. (5.10)
(5.10)
 – 75,36 кДж;
– 75,36 кДж; и
и 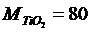 ;
; и
и 
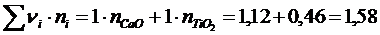 ,
, и
и 

 – 66,99 кДж;
– 66,99 кДж;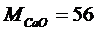 и
и  ;
; и
и 
 ,
, и
и 


 (5.11)
(5.11) .
.


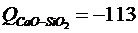









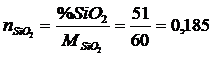



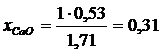
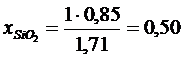





 ;
; 


