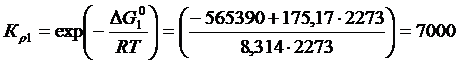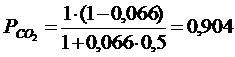РАСЧЕТ ИЗМЕНЕНИЯ ИЗОБАРНОГО ПОТЕНЦИАЛА
МЕТАЛЛУРГИЧЕСКИХ РЕАКЦИЙ
Для заданной металлургической реакции (табл. 2) построить изобарные потенциалы: приближенным методом или методом Темкина-Шварцмана и оценить направление реакции. Построить графики  .
.
Необходимые теплофизические параметры веществ представлены в [1] или взять из Интернета.
Таблица 2
Металлургические реакции
| № вар.
|
| № вар.
|
|
|
| Fe + CO2 = FeO +CO
|
| 3Fe + SO2 = FeS + 2FeO
|
|
| CaCO3 = CaO + CO2
|
| Si +O2 = SiO2
|
|
| 2Fe +O2 = 2FeO
|
| 2C + O2 = 2CO
|
|
| 2Mn + O2 = 2MnO
|
| C +H2O = CO + H2
|
|
| C + CO2 = 2CO
|
| Si + 2CO2 = SiO2 + 2CO
|
|
| Fe + ½ O2= FeO
|
| Mn + CO2 = MnO + CO
|
|
| Si + 2H2O = SiO2 + 2H2
|
| Si + 2FeO = SiO2 + 2Fe
|
|
| Mn + H2O = MnO + H2
|
| C + FeO = CO + Fe
|
|
| Mn + FeO = MnO + Fe
|
| P2O5 + 3FeO = (FeO)3P2O5
|
|
| 2P + 5FeO = P2O5 + 5Fe
|
| MnS + CaO = CaS + MnO
|
|
| FeS + CaO = CaS + FeO
|
| SiO2 + 2C = Si + 2CO
|
|
| 3FeO + 2Al = Al2O3 + 3Fe
|
| SiO2 + 2Fe = Si + 2FeO
|
|
| MnO + C = Mn + CO
|
| 2MnO + Si = 2Mn + SiO2
|
|
| CaO + 3C = CaC2 + CO
|
| 3MnO + CaC2 = 3Mn + CaO + 2CO
|
|
| 3FeO + CaC2 = 3Fe + CaO + 2CO
|
| CaF2 + FeO = CaO + FeF3
|
|
| 2CaF2 + SiO2 = 2CaO + SiF4
|
| 2CaF2 + Ti = 2Ca + TiF4
|
|
| 3CaF2 + 2Al = 3Ca + 2AlF3
|
| 3Fe + Cu2O = FeO + 2Cu
|
|
| 2Ce + 3MgCl2 = 3Mg + 2CeCl3
|
| 3NiO + 2Al= Al2O3 + 3Ni
|
|
| 5NiO + 2Cr = Cr2O5 + 5Ni
|
| NiO + Ti = TiO + Ni
|
|
| 2NiO + Si = SiO2 + 2Ni
|
| Si + 2FeO = 2FeO + SiO2
|
|
| (FeO)3P2O5 + 4CaO = (CaO)4P2O5 + 3FeO
|
|
| 3FeS + CaC2 + 2CaO = 3CaS + 3Fe + 2CO
|
|
| 3MnS + CaC2 + 2CaO = 3CaS + 3Mn + 2CO
|
|
| 2Fe3O4 + 4SiO2 + 4Cu = 3Fe2SiO4 + Cu4SiO4
|
Практическое задание №2
ОЦЕНКА ПРОЦЕССОВ ВОССТАНОВЛЕНИЯ ОКСИДОВ МЕТАЛЛОВ
НА ОСНОВЕ ТЕРМОДИНАМИЧЕСКИХ РАСЧЕТОВ
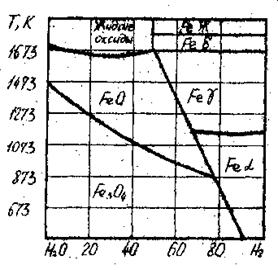
Для заданных температур рассчитать равновесные составы газовых фаз реакций восстановления оксидов железа монооксидом углерода и водорода (табл. 3). Результаты расчетов сравнить сданными диаграмм состояния (рис. 1–2).
Таблица 3
Варианты контрольных задач
| № вар.
| Т, К
| № вар.
| Т, К
| № вар.
| Т, К
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

| 
|
| Рис. 1. Диаграмма равновесия
оксидов железа с атмосферой СО – СО 2
| Рис. 2. Диаграмма равновесия
оксидов железа с атмосферой H 2 – Н2О
|
Практическое задание №3
ОЦЕНКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ
ГАЗОВОЙ ФАЗЫ
1. Определить направление реакций взаимодействия компонентов при различных температурах и составах газовой фазы (табл. 4).
Найти константу равновесия при Р = 1.
Таблица 4
Варианты заданий
| №
| Т, К
| Составы фаз, %
| №
| Т, К
| Составы фаз, %
|
| СО 2
| СО
| О 2
| СО 2
| СО
| О 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Определить равновесные составы газовых фаз, образующихся в результате диссоциации CО2 и Н 2 О при Р = 1.
Определить кислородные потенциалы газовых фаз.
Ответить на вопрос, какая из фаз проявляет более высокую активность.
Температуры для исследования выбрать по формулам:
Т 1 = 500× К + N ×25
Т 2 = 2000× К – N ×25
где N – номер варианта; Т 1 и Т 2 – температуры, для которых проводится исследование.
Практическое задание №4
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ НАЧАЛА ВОССТАНОВЛЕНИЯ ОКСИДОВ ТВЕРДЫМ УГЛЕРОДОМ
Для окислов металлов вычислить температуры восстановления их твердым углеродом (при давлении Р = 1). Проведя расчет для различных давлений, построить зависимости Т = j (P), Р СО= j(Р), формула (4.9).
Таблица 5
Варианты заданий
| № вар.
| Окисел
| 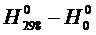 ,
Дж/моль ,
Дж/моль
| 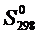 ,
Дж/моль×К ,
Дж/моль×К
| № вар.
| Окисел
| 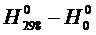 ,
Дж/моль ,
Дж/моль
| 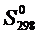 ,
Дж/моль×К ,
Дж/моль×К
|
|
|
|
| 50,95
|
|
|
| 94,865
|
|
|
|
| 70,45
|
|
|
| 38,02
|
|
|
| –
| 77,5
|
|
|
| 66,2
|
|
|
|
| 39,77
|
|
|
| 71,97
|
|
|
|
| 52,8
|
|
|
| 127,3
|
|
|
|
| 73,3
|
|
|
| 125,2
|
|
|
|
| 81,2
|
|
|
| 41,87
|
|
|
|
| 42,66
|
|
|
| 52,3
|
|
|
|
| 92,99
|
|
|
| 34,79
|
|
|
| 264,6
| 60,69
|
|
|
| 50,37
|
|
|
|
| 87,5
|
|
|
| 77,37
|
|
|
|
| 146,29
|
|
|
| 127,15
|
|
|
|
| 94,203
|
|
|
| 33,62
|
|
|
|
| 26,96
|
|
|
| 98,4
|
|
|
|
| 61,55
|
|
|
| 96,7
|
|
|
|
| 53,17
|
|
|
| 131,0
|
|
|
|
| 110,5
|
|
|
| 43,67
|
|
|
|
| 75,090
|
|
|
|
|
Практическое задание №5. ИССЛЕДОВАНИЕ АКТИВНОСТИ КОМПОНЕНТОВ
В МЕТАЛЛУРГИЧЕСКИХ ШЛАКАХ
Задача № 5.1
Определить энергии смешения шлаковых систем, указанных в таблице. Воспользоваться диаграммами состояния окисных систем.
| № вар.
| FeO
| MnO
| CaO
| MgO
| SiO 2
| Al 2 O 3
| TiO 2
| Cr 2 O 3
|
|
| +
|
| +
|
| +
|
|
|
|
|
| +
| +
|
|
|
|
| +
|
|
|
| +
| +
|
|
|
| +
|
|
|
|
|
|
|
| +
| +
| +
|
|
|
|
|
| +
|
|
| +
|
| +
|
|
|
|
| +
| +
| +
|
|
|
|
|
|
| +
| +
|
|
| +
|
|
|
|
|
| +
|
| +
|
|
|
|
| +
|
|
|
| +
|
| +
| +
|
|
|
|
|
| +
|
| +
|
| +
|
|
|
|
|
| +
| +
|
| +
|
|
|
|
|
|
|
|
| +
| +
|
| +
|
|
|
|
|
|
|
|
|
| +
| +
| +
|
|
|
|
| +
|
| +
|
| +
|
|
|
| +
|
|
| +
|
| +
|
|
|
|
| +
|
| +
|
|
| +
|
|
|
|
|
| +
|
|
| +
|
| +
|
|
|
| +
| +
|
| +
|
|
|
|
|
|
| +
|
|
| +
|
|
|
| +
|
|
| +
|
| +
|
|
| +
|
|
|
|
| +
|
|
|
|
|
| +
| +
|
|
|
| +
|
|
|
|
| +
| +
|
|
|
|
| +
|
|
|
| +
| +
|
|
|
|
|
| +
|
|
| +
| +
|
|
|
|
|
|
| +
|
| +
| +
|
|
| +
|
| +
|
|
|
|
| +
|
|
| +
| +
| +
|
|
|
|
|
|
|
|
|
|
|
| +
| +
|
| +
|
|
|
|
|
| +
| +
|
| +
|
|
|
|
|
|
|
| +
| +
| +
|
|
|
|
|
| +
| +
| +
|
|
|
|
|
|
|
| +
|
|
| +
|
| +
|
|
|
|
|
| +
|
| +
|
| +
|
|
|
| +
|
|
|
| +
|
| +
|
|
| +
|
|
|
|
| +
|
| +
|
|
|
|
|
| +
| +
|
|
| +
|
|
|
|
| +
|
| +
|
|
| +
|
|
|
| +
|
|
| +
|
|
| +
|
|
| +
|
|
|
| +
|
|
| +
|
|
|
| +
| +
|
| +
|
|
|
|
Задача № 5.2
Определить активность шлаковых систем заданного состава (предполагая шлак «некислый») и построить зависимость содержания кислорода в железе, равновесном сошлаком от температуры Т = 1600 °С
| № вар.
| Концентрация компонентов
|
| FeO
| MnO
| CaO
| MgO
| SiO 2
| Р 2 О 5
|
|
| 38,45
| 2,45
| 15,0
| 5,0
| 30,0
| 0,1
|
|
| 48,14
| 2,68
| 15,88
| 3,82
| 29,38
| 0,21
|
|
| 48,92
| 3,05
| 16,75
| 2,15
| 28,75
| 0,38
|
|
| 45,9
| 3,25
| 17,63
| 4,60
| 29,01
| 0,61
|
|
| 43,32
| 4,17
| 18,51
| 6,3
| 27,5
| 0,2
|
|
| 43,48
| 4,36
| 19,37
| 5,39
| 26,87
| 0,53
|
|
| 42,44
| 4,44
| 20,25
| 6,0
| 26,25
| 0,62
|
|
| 44,34
| 3,70
| 21,12
| 4,20
| 25,63
| 1,01
|
|
| 44,85
| 3,94
| 21,99
| 3,92
| 25,0
| 0,3
|
|
| 47,73
| 2,78
| 22,87
| 2,03
| 24,36
| 0,23
|
|
| 47,75
| 2,87
| 23,75
| 1,43
| 23,75
| 0,45
|
|
| 45,88
| 3,34
| 24,62
| 2,45
| 23,13
| 0,58
|
|
| 47,20
| 3,46
| 24,92
| 1,52
| 22,5
| 0,4
|
|
| 44,37
| 2,55
| 25,50
| 5,0
| 21,86
| 0,72
|
|
| 47,09
| 2,07
| 26,37
| 2,54
| 21,25
| 0,68
|
|
| 45,48
| 2,52
| 27,25
| 3,62
| 20,63
| 0,50
|
|
| 46,36
| 2,64
| 28,12
| 2,31
| 20,0
| 0,57
|
|
| 45,58
| 2,75
| 28,99
| 2,50
| 19,38
| 0,80
|
|
| 43,78
| 2,83
| 29,87
| 4,15
| 18,75
| 0,62
|
|
| 40,89
| 3,03
| 30,74
| 6,3
| 18,13
| 0,91
|
|
| 44,53
| 3,14
| 31,62
| 5,18
| 17,5
| 0,93
|
|
| 45,13
| 2,46
| 32,49
| 2,31
| 16,88
| 0,73
|
|
| 42,63
| 3,62
| 33,37
| 3,15
| 16,25
| 0,98
|
|
| 41,31
| 3,5
| 34,25
| 4,31
| 15,63
| 1,0
|
|
| 41,84
| 2,31
| 35,12
| 4,92
| 15,0
| 0,81
|
|
| 41,11
| 2,74
| 35,99
| 6,0
| 14,34
| 0,82
|
|
| 41,27
| 3,4
| 36,87
| 3,61
| 13,75
| 1,1
|
|
| 41,19
| 4,01
| 37,75
| 3,82
| 13,12
| 0,11
|
|
| 43,04
| 3,57
| 38,62
| 2,15
| 12,5
| 0,12
|
|
| 40,29
| 3,63
| 39,49
| 4,60
| 11,66
| 0,13
|
|
| 39,9
| 2,95
| 40,37
| 5,39
| 11,25
| 0,14
|
|
| 37,01
| 4,96
| 41,25
| 6,0
| 10,63
| 0,15
|
|
| 36,39
| 5,03
| 42,12
| 6,3
| 10,0
| 0,16
|
|
| 38,01
| 5,26
| 42,99
| 4,2
| 9,37
| 0,17
|
|
| 38,73
| 4,55
| 43,87
| 3,92
| 8,75
| 0,18
|
|
| 41,44
| 3,35
| 44,75
| 2,03
| 8,13
| 0,3
|
|
| 37,68
| 6,15
| 45,62
| 2,45
| 7,5
| 0,6
|
|
| 40,69
| 3,64
| 46,49
| 1,52
| 6,86
| 0,8
|
|
| 40,37
| 2,57
| 47,37
| 2,54
| 6,25
| 0,9
|
|
| 39,23
| 3,58
| 48,25
| 2,31
| 5,63
| 1,0
|
Задача № 5.3
Определить коэффициент активности (j) и активность (Q) FeO в кислом шлаке заданного состава. Воспользоваться формулой (5.11). Температура изменяется от 1406 К до 1800 К. Построить зависимости 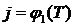 ,
, 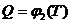 .
.
| № вар.
| Состав шлака, % (по массе)
|
| FeO
| CaO
| SiO 2
| Al 2 O 3
|
|
|
|
| 51,8
| 12,2
|
|
| 8,15
| 36,4
| 45,4
| 10,05
|
|
| 6,5
| 37,0
| 46,3
| 10,3
|
|
| 6,7
| 41,5
| 41,5
| 10,3
|
|
| 5,25
| 45,8
| 38,3
| 10,65
|
|
| 6,9
| 48,2
| 34,4
| 10,5
|
|
| 7,5
| 29,5
| 51,0
| 11,9
|
|
| 6,5
| 29,9
| 51,5
| 12,1
|
|
| 7,15
| 41,3
| 41,3
| 10,25
|
|
| 5,2
| 42,1
| 42,1
| 10,6
|
|
| 4,0
| 50,0
| 35,5
| 10,5
|
|
| 7,0
|
| 41,2
| 11,65
|
|
| 12,05
| 16,8
| 30,3
| 40,85
|
|
| 13,0
| 40,5
| 30,0
| 16,5
|
|
| 8,3
| 23,01
| 50,0
| 18,69
|
|
| 9,1
| 20,3
| 41,08
| 29,52
|
|
| 6,02
| 30,8
| 43,2
| 19,98
|
|
| 10,1
| 42,5
| 32,7
| 14,7
|
|
| 11,8
| 44,8
| 35,8
| 7,6
|
|
| 18,7
| 55,0
| 21,1
| 5,2
|
|
| 15,5
| 48,8
| 28,7
| 7,0
|
|
| 16,01
| 30,1
| 48,7
| 5,19
|
|
| 13,1
| 25,3
| 49,7
| 11,9
|
|
| 18,9
| 20,7
| 45,3
| 15,1
|
|
| 16,0
| 28,1
| 44,1
| 11,8
|
|
| 17,6
| 24,7
| 35,3
| 22,4
|
|
| 10,9
| 17,3
| 40,04
| 31,76
|
|
| 9,8
| 54,2
| 33,8
| 2,2
|
|
| 17,1
| 41,7
| 38,1
| 3,1
|
|
| 15,3
| 39,4
| 44,4
| 0,9
|
|
| 7,8
| 29,03
| 48,8
| 14,37
|
|
| 8,7
| 21,9
| 49,9
| 19,5
|
|
| 6,7
| 50,0
| 31,8
| 11,5
|
|
| 8,5
| 48,1
| 35,04
| 8,36
|
|
| 10,1
| 47,2
| 32,01
| 10,69
|
|
| 7,8
| 33,7
| 44,3
| 14,2
|
|
| 11,3
| 33,8
| 48,7
| 5,83
|
|
| 14,8
| 33,3
| 49,07
| 2,83
|
|
| 18,1
| 22,2
| 48,03
| 11,67
|
|
| 20,0
| 19,5
| 45,1
| 15,4
|
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
МЕТАЛЛУРГИЧЕСКИХ РЕАКЦИЙ
(практическое задание №1)
Основой для разработки высокотемпературных металлургических процессов являются термодинамические процессы, позволяющие оценить вероятность протекания заданной реакции, а также оценить соотношение продуктов реакция. Важнейшим параматром, используемым для оценки металлургических реакций, является изменение изобарного потенциала и константы равновесия. Вычисление этих параметров позволяет выбирать температурные области, наиболее интересные для исследуемых металлургических реакций.
Расчет изобарного потенциала может быть осуществлен по следующему соотношению:
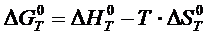 (1.1)
(1.1)
где  (1.2)
(1.2)
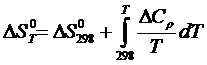 (1.3)
(1.3)
где  ,
,  – изменение энтальпии и энтропии соответственно веществ начального и конечного состояний;
– изменение энтальпии и энтропии соответственно веществ начального и конечного состояний;
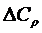 – изменение теплоемкости; Т – температура.
– изменение теплоемкости; Т – температура.
При наличии в изучаемой системе фазовых переходов при расчетах изобарного потенциала учитывают вклад теплоты фазовых переходов:
 (1.4)
(1.4)
где  – теплота фазового перехода;
– теплота фазового перехода;
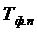 – температура фазового перехода.
– температура фазового перехода.
Конечная формула (4.1.1), с учетом фазовых переходов компонентов металлургических реакций, принимает вид:
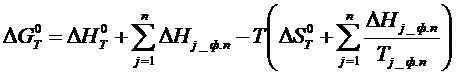 (1.5)
(1.5)
где n – число фазовых переходов, происходящих до температуры Т.
а) Приближенный метод расчета изобарного потенциала
В случае предположения  изобарный потенциал может быть вычислен приближенно с помощью следующей формулы:
изобарный потенциал может быть вычислен приближенно с помощью следующей формулы:
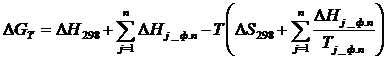 (1.6)
(1.6)
Для вычисления изменения энтальпии  и энтропии
и энтропии 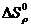 при стандартной температуре пользуются следующими соотношениями:
при стандартной температуре пользуются следующими соотношениями:
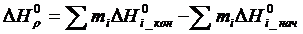 ( 1. 7)
( 1. 7)
 ( 1. 8)
( 1. 8)
где mi – стехиометрический коэффициент продуктов реакции;
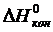 и
и 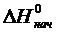 – энтальпии конечных и исходных веществ реакции;
– энтальпии конечных и исходных веществ реакции;
 и
и 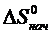 – энтропии конечных и исходных веществ реакции.
– энтропии конечных и исходных веществ реакции.
Однако в ряде случаев степень точности приближенных методов расчета не является удовлетворительной. Поэтому необходимым является учет изменений теплоемкости.
б) Метод Темкина–Шварцмана
Обычно в справочных данных изменение теплоемкости от температуры записывают в виде:
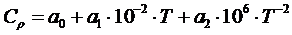 (1.9)
(1.9)
или
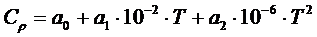 (1.10)
(1.10)
Изменение тегшоемкости  приближенно можно оценить по формулам:
приближенно можно оценить по формулам:
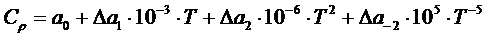 (1.11)
(1.11)
 (1.12)
(1.12)
 (1. 13)
(1. 13)
 (1.14)
(1.14)
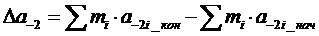 (1.15)
(1.15)
Исходя из уравнения изобары химической реакции
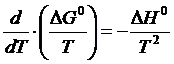 (1.16)
(1.16)
и подставляя уравнение (1.2) в уравнение (1.16), после интегрирования получим:
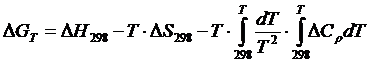 (I.I7)
(I.I7)
Подставив уравнение (1.11) в уравнение (1.17), получим
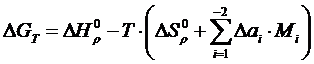 (1.18)
(1.18)
где i – индекс, принимающий значение 0, 1, 2, -2;
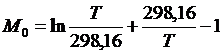


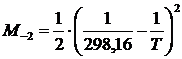
Если в системе происходят фазовые переходы, то в формулу (1.18) вносят поправку DП, добавляющую к правой части (1.18)
 (1.19)
(1.19)
Таким образом, вычисление потенциала методом Темкина-Шварцмана сводится к определению DGТ по формулам (1.18) и (1.19). Следует отметить, что в данном случае учтен вклад в DGТ, связанный q изменением коэффициентов степенного ряда теплоемкости, происходящим в интервале между фазовыми переходами.
Оценка процесса с помощью термодинамических расчетов происходит по следующему критерию:
DGТ < 0 – реакция идет в сторону образования продуктов;
DGТ > 0 – протекание реакции невозможно, и, следовательно, все попытки осуществить процесс лишены смысла.
Пример расчета термодинамического потенциала
(практическое задание №1)
Выполним расчет изменения изобарного потенциала реакции тетрахлорида титана и магния для различных температур, находящихся в интервале 298–1500 К. Реакция имеет вид:
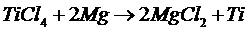
Исходные данные для расчета представлены в табл. 2.1.
Таблица 2.1
Термодинамические характеристики веществ
| Вещество
| Сост.
| DН298
кДж/моль
| S298
кДж/моль×град
| Тпл
К
| DНпл
кДж/моль
| Ткип
К
| DНкип
кДж/моль
|
| TiCl4
| ж
| – 801,7
| 249,4
| –
| –
|
| – 36,2
|
| MgCl2
| тв
| – 641,8
| 89,5
|
| 43,1
| –
| –
|
| Ti
| тв
|
| 30,5
| –
| –
| –
| –
|
| Mg
| тв
|
| 32,5
|
| – 8,8
| –
| –
|
| Mg
| ж
| –
| –
| –
| –
|
| – 127,6
|
а) Приближенный расчет
Рассчитаем 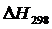 и
и  , воспользовавшись уравнениями (1.7) и (1.8).
, воспользовавшись уравнениями (1.7) и (1.8).
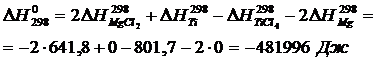
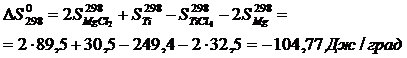
Вычислим изменения изобарного потенциала по формуле (1.6) для Т = 987 К:
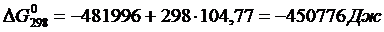
Вычислим изменения изобарного потенциала для Т =410 К:
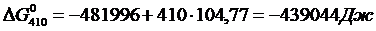
Вычислим изменения потенциала для Т =923 К, учитывая, что при нагреве вещества до этой температуры происходит фазовый переход при Т = 410 К (формула 1.6):

Вычислим изменения потенциала для Т =987 К, учитывая, что при нагреве вещества до этой температуры происходят два фазовых перехода при Т = 410 К и
Т = 923 К (формула 1.6).
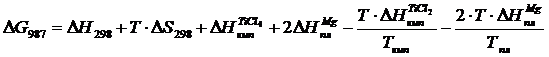
В четвертой и шестом слагаемых присутствует стехиометрический коэффициент 2, взятый из уравнения реакции

Для Т = 1500 К запишем
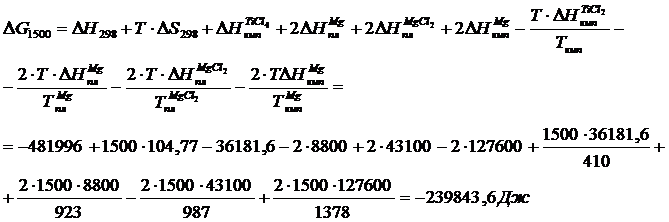
б) Метод Темкина–Шварцмана
В этом случае считаются заданными степенные ряды теплоемкости:
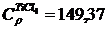
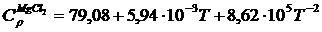
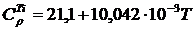

Воспользовавшись этими рядами и формулами (1.12…1.15), найдем:
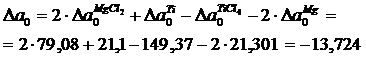
Аналогично находим
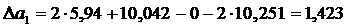

Вычисляем М0, М1, М2, М–2 для Т = 410 К и, подставляя в формулу (1.16) значение 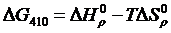 вычисленное ранее, получим
вычисленное ранее, получим
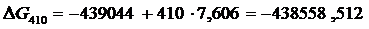
Аналогично можно вычислить потенциалы для любой температуры. Отметим, что уточненный потенциал, полученный методом Темвина-Шварцмана, равен
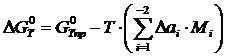
где 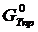 – потенциал, вычисленный приближенно при условии
– потенциал, вычисленный приближенно при условии 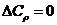 .
.
Пример расчета реакции восстановления
(практическое задание №2)
Постановка задачи.
Рассчитать равновесные составы газовой фазы в реакциях восстановления оксидов железа водородом при температуре Т =1473 К и давлении Р = 1.
Решение. Реакции восстановления оксидов железа водородом представлены выие (2.11…2.14). По приведенным потенциалам (уравнения 2.15…2.18) определим константы равновесия, воспользовавшись соотношением (2.10).
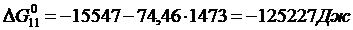
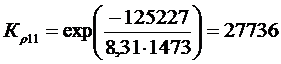

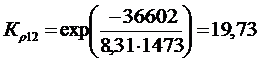
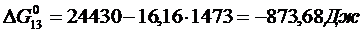
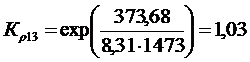
По аналогии с (2.21) для H2запишем
 (2.27)
(2.27)
Подставив константы равновесия в (2.25) и (2.26), получим следующие значения концентрации компонентов:
 (реакция 2.11)
(реакция 2.11)
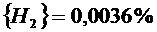
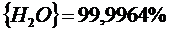
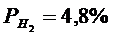

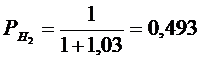 (реакция 2.13)
(реакция 2.13)
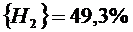
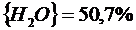
Примеры расчета
(практическое задание №3)
Постановка задачи 1. Определить направление реакции взаимодействия (3.1) при Т = 2273 К при исходном составе газовой фазы 70 % СО2, 20 % СО и 10 % О2. Найти константу равновесия при Р = 1.
Решение.
По уравнению (3.18) определили D G, учитывая (3.3)
 (3.19)
(3.19)

Так как D G < 0, то реакция идет в сторону образования СО 2 с горением СО.
Константа равновесия определятся как
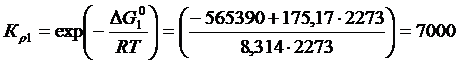
Постановка задачи 2. Определить равновесный состав газовой фазы, образующейся в результате диссоциации СО 2 при Т = 2273 К и Р = 1. Определить кислородный потенциал газовой фазы.
Решение.
Реакция имеет вид (3.1). Задача сводится к определению парциальных давлений (3.9…3.11). Однако предварительно вычислив a (степень диссоциации), воспользовавшись (3.13) и значением константы равновесия, вычисленной из предыдущей задачи, получим:

Подставляя a в(3.9…3.11), получим следующие парциальные давления:
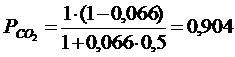


Таким образом, состав газовой фазы будет следующим:
90,4 % СО 2 + 6,4 % СО +3,2 % О 2
Кислородный потенциал газовой фазы рассчитываем с помощью (3.14)

Номера теоретических заданий на контрольную работу
| № вар.
| Номер вопроса
| № вар.
| Номер вопроса
|
|
| 1, 19, 37
|
| 10, 28, 46
|
|
| 2, 20, 38
|
| 11, 29, 47
|
|
| 3, 21, 39
|
| 12, 30, 48
|
|
| 4, 22, 40
|
| 13, 31, 49
|
|
| 5, 23, 41
|
| 14, 32, 50
|
|
| 6, 24, 42
|
| 15, 33, 51
|
|
| 7, 25, 43
|
| 16, 34, 52
|
|
| 8, 26, 44
|
| 17, 35, 53
|
|
| 9, 27, 45
|
| 18, 36, 54
|
Контрольные вопросы
1. Понятие о системе, фазах, процессе; термодинамические параметры как факторы, определяющие состояние системы.
2. Внутреняя энергия и энтальпия как функции состояния; математическое выражение парного закона термодинамики, его формулировки.
3. Работа расширения идеальных газов; изобарный, изотермический, адиабатный, изохорный процессы.
4. Закон Гесса; тепловые эффекты химических реакций и зависимость их от темпераптуры; определение тепловых эффектов методом колориметра.
5. Теплоемкость; зависимость теплоемкости от температуры; уравнение (закон) Кирхгофа.
6. Сущность второго закона термодинамики; его формулировки; возможность и направление самопроизвольного протекания процессов.
7. Формулировки второго закона термодинамики; энтропия как функция состояния системы.
8. Характеристические функции и термодинамические потенциалы: изохорно-изотермический потенциал (энергия Гельмгольца) и изобарно-изотермический потенциал (энергия Гиббса).
9. Равновесное состояние системы; устойчивое или истинное равновесие: влияние внешних условий на равновесие.
10. Общее условие фазовых равновесий; правило фаз.
11. Химический потенциал и активность; условие перехода вещества, содержащегося в система, из одной фазы в другую.
12. Равновесные соотношения при фазовых переходах; уравнение Клаузиуса-Клайперона.
13. Закон действия масс; константы равновесия химических реакций; методы расчета констант равновесия.
14. Принцип подвижного равновесия; влияние внешнего воздействия на направление смещения равновесия.
15. Тепловая теорема Нернста.
16. Уравнение изотермы, изобары, изохоры химической реакции; мера химического сродства.
17. Способы выражения состава растворов; разбавленные растворы; закон Рауля.
18. Температура кипения и кристаллизации разбавленных растворов; Термодинамическая летучесть.
19. Концентрированные растворы; свойства концентрированных растворов.
20. Газы в растворах; зависимость между растворимостью газа и температурой; закон Генри.
21. Кинетика химических реакций; зависимость скорости реакций от концентрации реагирующих веществ.
22. Кинетическая классификация химических реакций; молекулярность реакции, порядок реакции.
23. Влияние температуры на скорость реакций; энергия активации.
24. Классификация металлургических процессов; общие термодинамические особенности процессов плавленая.
25. Характеристика физико-химических процессов, протекающих в плавильных печах при плавке литейных сплавов.
26. Температура, давление и состав газовой атмосферы в печах; изменение условий плавки в разные периоды процесса.
27. Факторы, определяющие взаимодействие металлов друг с другом и с немeталлами (металлохимические свойства элементов).
28. Термодинамика и кинетика реакций в системе.
29. Механизм и кинетика процессов горения в однофазной и многофазной системах.
30. Кинетика горения твердого углерода; стадии процесса; способы интенсификации процессов горения при слоевом сжигании топлива.
31. Диссоциация карбонатов; упругость диссоциации; изменение упругости диссоциай в зависимости от температуры.
32. Диссоциация углеводородов и сульфидов; упругость диссоциации; изменение упругости диссоциации в зависимости от температуры.
33. Механизм и кинетика процессов диссоциации; топохимические превращения.
34. Диссоциация окислов; уравнение Вант-Гоффа; ряд металлов по их сродству к кислороду.
35. Основы теории восстановительной плавки; общая характеристика восстановителько-окислительных реакций.
36. Восстановление окислов железа окисью углерода и водородом.
37. Процессы восстановления в присутствии твердого углерода.
38. Газовое науглероживание в процессе восстановления железа окисью углерода; влияние состава газовой атмосферы на восстановительные процессы при плавке литейных сплавов.
39. Шлаки в металлургических процессах; состав и физико-химические характеристики шлаков и их компонентов.
40. Теории строения шлаковых расплавов.
41. Химические и физические свойстве шлаков.
42. Взаимодействие шлаковых и металлургических расплавов; закон распределения.
43. Окислительные и восстановительные шлаки и их роль в процессах плавки металлов и сплавов.
44. Регулирование состава и свойств шлаков с помощью флюсов; требования, предъявляемые к флюсам.
45. Значение свойств шлаков в процессах плавки металлов и сплавов; взаимодействие шлаков с футеровкой печи.
46. Основы теории окислительной плавки; передача кислорода от газовой фазы к расплаву при плавке стали.
47. Процессы окисления примесей в расплаве металла; упругость диссоциации окислов кремния, марганца и углерода в растворе железа в зависимости от температуры расплава и концентрации примесей.
48. Термодинамика и кинетика окисления кремния, марганца и углерода при плавке стали.
49. Интенсификация окислительных процессов; применение кислорода при плавке металлов и сплавов.
50. Удаление серы и фосфора при плавке чугуна и ст



 .
.

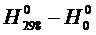 ,
Дж/моль
,
Дж/моль
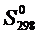 ,
Дж/моль×К
,
Дж/моль×К
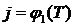 ,
, 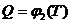 .
.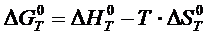 (1.1)
(1.1) (1.2)
(1.2)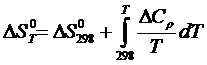 (1.3)
(1.3) ,
,  – изменение энтальпии и энтропии соответственно веществ начального и конечного состояний;
– изменение энтальпии и энтропии соответственно веществ начального и конечного состояний;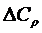 – изменение теплоемкости; Т – температура.
– изменение теплоемкости; Т – температура. (1.4)
(1.4) – теплота фазового перехода;
– теплота фазового перехода;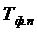 – температура фазового перехода.
– температура фазового перехода.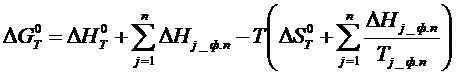 (1.5)
(1.5) изобарный потенциал может быть вычислен приближенно с помощью следующей формулы:
изобарный потенциал может быть вычислен приближенно с помощью следующей формулы: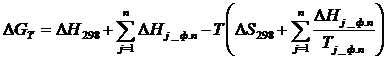 (1.6)
(1.6) и энтропии
и энтропии 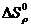 при стандартной температуре пользуются следующими соотношениями:
при стандартной температуре пользуются следующими соотношениями: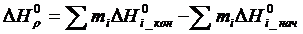 ( 1. 7)
( 1. 7) ( 1. 8)
( 1. 8)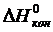 и
и 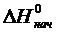 – энтальпии конечных и исходных веществ реакции;
– энтальпии конечных и исходных веществ реакции; и
и 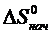 – энтропии конечных и исходных веществ реакции.
– энтропии конечных и исходных веществ реакции.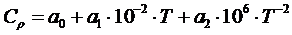 (1.9)
(1.9)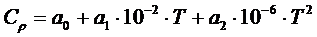 (1.10)
(1.10) приближенно можно оценить по формулам:
приближенно можно оценить по формулам: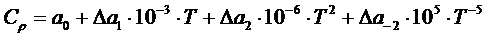 (1.11)
(1.11) (1.12)
(1.12) (1. 13)
(1. 13) (1.14)
(1.14)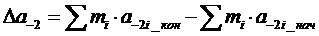 (1.15)
(1.15)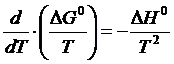 (1.16)
(1.16)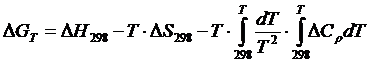 (I.I7)
(I.I7)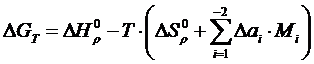 (1.18)
(1.18)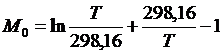


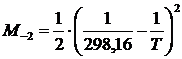
 (1.19)
(1.19)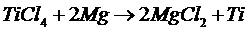
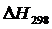 и
и  , воспользовавшись уравнениями (1.7) и (1.8).
, воспользовавшись уравнениями (1.7) и (1.8).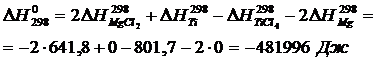
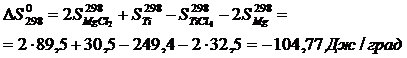
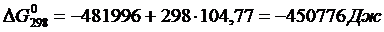
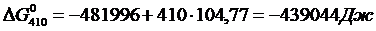

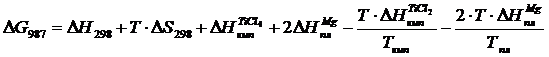

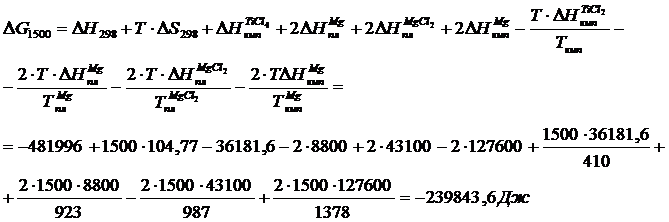
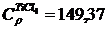
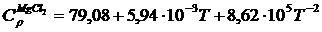
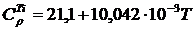

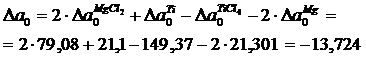
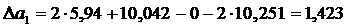

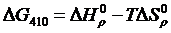 вычисленное ранее, получим
вычисленное ранее, получим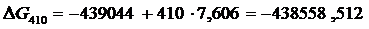
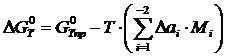
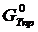 – потенциал, вычисленный приближенно при условии
– потенциал, вычисленный приближенно при условии 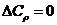 .
.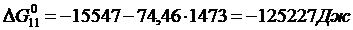
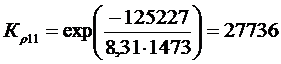

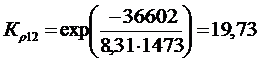
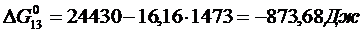
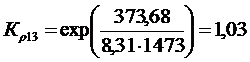
 (2.27)
(2.27) (реакция 2.11)
(реакция 2.11)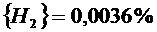
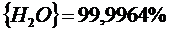
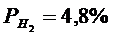

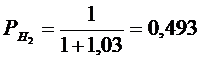 (реакция 2.13)
(реакция 2.13)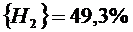
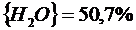
 (3.19)
(3.19)