Внутренняя энергия U и энтальпия H – функции состояния системы, присущие ей с момента образования.
Энтальпия образования – тепловой эффект реакции образования одного моля вещества из простых веществ с учетом агрегатного состояния.
Энтальпия образования вещества, определенная при стандартных условиях (298 К, 101,3 кПа, с = 1 моль/л), называется стандартной энтальпией образования вещества.
Обозначается Δ Н 0f,в-во,298.
Стандартные энтальпии образования веществ являются табличными данными. Единицы измерения: кДж/моль.
Стандартная энтальпия образования простых веществ принята за ноль.
Основной закон термохимии – закон Г. И. Гесса. Пользуясь им, можно вычислить ∆ H любой реакции.
Закон Гесса: тепловой эффект процесса зависит только от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, то есть от числа и характера промежуточных стадий.
Следствие: тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Расчет D H 0 химической реакции (Δ H 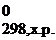 ) проводится по формуле:
) проводится по формуле:
Δ H 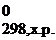 = ∑Δ Н 0f, продуктов реакции − ∑Δ Н 0f, исходных веществ.
= ∑Δ Н 0f, продуктов реакции − ∑Δ Н 0f, исходных веществ.
При этом следует учитывать число молей веществ в уравнении химической реакции.
Для реакции a1A1 + a2A2 +....= b1B1 + b2B2 +...., где а i, b i – стехиометрические коэффициенты, A i – исходные вещества, B i – продукты реакции, тепловой эффект будет определен как:
Δ Н 0298, х.р. = (b1Δ H  + b2Δ H
+ b2Δ H  +...) – (a1Δ H
+...) – (a1Δ H  + a2Δ H
+ a2Δ H 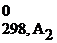 +...).
+...).
Значения термодинамических параметров, приведенные в таблицах, даны для одного моля вещества.
Расчет энтальпии химической реакции согласно закону Гесса рассмотрим на примере реакции сгорания метана:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
Δ Н 0298, х.р. = (Δ H 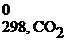 + 2Δ H
+ 2Δ H 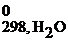 ) – (Δ H
) – (Δ H 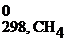 + 2Δ H
+ 2Δ H 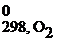 )=
)=
= (-393,5 + 2(-241,8)) – (-74,8 + 2∙0)= -802,3 кДж
Таким образом, тепловой эффект реакции сгорания метана равен -802,3 кДж, эта реакция является экзотермической.
С термохимическими уравнениями, если Δ H в них приводятся при одних и тех же условиях, можно действовать так же, как с алгебраическими (рис. 4.1).
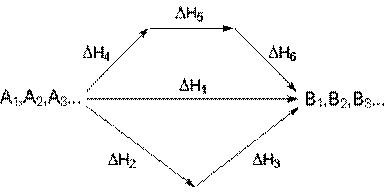
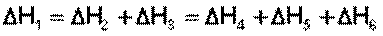
Рис. 4.1. Схема, иллюстрирующая закон Гесса
4.4. Энтропия и её изменения в химических процессах. Стандартная энтропия образования вещества
Энтропия («эн»–энергия, «тропе»–превращение) – функция состояния, ее значение будет определяться состоянием системы, а её изменение зависит лишь от начального и конечного состояний системы, но не от пути процесса.
Энтропия вещества определяет меру беспорядка в системе и представлена значением S  .
.
Единица измерения энтропии: Дж/моль·К.
Под стандартной энтропией образования вещества понимают энтропию реакции образования 1 моля вещества из простых веществ с учетом агрегатного состояния при стандартных условиях. S 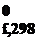 – табличные данные.
– табличные данные.
Расчет энтропии проводится по закону Гесса.
Для реакции в общем виде: a1A1 + a2A2 + …= b1B1 + b2B2 + …
Δ S 0298, х.р. = (b1 S  + b2 S
+ b2 S  +...) – (a1 S
+...) – (a1 S  + a2 S
+ a2 S 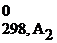 +...).
+...).
Например: С(тв) + СO2(г) = 2СО(г)
Δ S 0298, х.р. =2· S 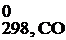 – (S
– (S  + S
+ S 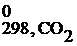 ) = 2·197,5 – (5,7+213,7) = = 175,6 Дж/К= 0,176 кДж/К, энтропия системы возрастает (ΔS0x.p.>0), следовательно, система стала обладать меньшей степенью упорядоченности.
) = 2·197,5 – (5,7+213,7) = = 175,6 Дж/К= 0,176 кДж/К, энтропия системы возрастает (ΔS0x.p.>0), следовательно, система стала обладать меньшей степенью упорядоченности.
Зная физический смысл энтропии, можно установить некоторые закономерности в изменении энтропии.
1. Фазовые переходы: упорядоченность системы уменьшается при переходе от твердого к жидкому состоянию, от жидкого к газообразному – происходит увеличение значения энтропии. Значения энтропии, приведенные для воды в разных агрегатных состояниях, подтверждают это:
H2O(тв) → H2O(ж) → H2O(г)
S  , Дж/моль·К 39,3 69,9 188,7
, Дж/моль·К 39,3 69,9 188,7
2. Изменения кристаллической решетки: чем правильнее кристаллическая решетка, тем меньше значение энтропии; минимальное значение имеет практически идеальная решетка алмаза.
C графит C алмаз
Тип кристаллической решетки гексагональная кубическая
S  , Дж/моль·К 5,74 2,36
, Дж/моль·К 5,74 2,36
3. Изменение объема: при увеличении объема, определяемого по изменению количества вещества (Δ n) в ходе реакции, значение энтропии тоже увеличивается. Число молей твердого вещества при расчете изменения объема системы не учитывается. Примеры реакций приведены в табл. 4.1.
Таблица 4.1.
Изменение энтропии процесса
| Реакция
| Δ V x.p.=Δ n
| Δ S 0x.p.
|
| С(тв) + СO2(г) = 2СО(г)
| +1
| >0
|
| 3H2(г) + N2(г) = 2NH3(г)
| -2
| <0
|
| Al(тв)+ Sb(тв) = AlSb(тв)
|
| ~0
|
| С(тв) + O2(г) = СО2(г)
|
| ~0
|
Таким образом, поскольку энтропия является функцией состояния, её изменение, отвечающее какому-либо изменению состояния системы, вычисляется по данным об энтропии конечного и исходного состояний системы: энтропия растет с повышением температуры при переходе вещества из состояния с меньшей энергией в состояние с большей энергией (при плавлении и возгонке твердого, кипении жидкого, расширении газа, растворении кристаллов, диссоциации). Энтропия уменьшается при охлаждении, отвердевании, конденсации, сжатии, кристаллизации растворов и т.п., в процессах, связанных с увеличением упорядоченности вследствие уменьшения числа частиц. Энтропия связана с плотностью и твердостью вещества.



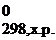 ) проводится по формуле:
) проводится по формуле: + b2Δ H
+ b2Δ H  +...) – (a1Δ H
+...) – (a1Δ H  + a2Δ H
+ a2Δ H 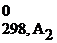 +...).
+...).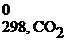 + 2Δ H
+ 2Δ H 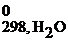 ) – (Δ H
) – (Δ H 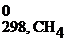 + 2Δ H
+ 2Δ H 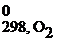 )=
)=
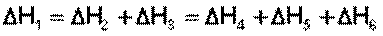
 .
. – табличные данные.
– табличные данные.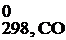 – (S
– (S  + S
+ S 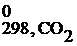 ) = 2·197,5 – (5,7+213,7) = = 175,6 Дж/К= 0,176 кДж/К, энтропия системы возрастает (ΔS0x.p.>0), следовательно, система стала обладать меньшей степенью упорядоченности.
) = 2·197,5 – (5,7+213,7) = = 175,6 Дж/К= 0,176 кДж/К, энтропия системы возрастает (ΔS0x.p.>0), следовательно, система стала обладать меньшей степенью упорядоченности.


