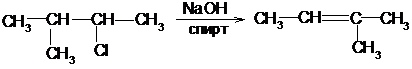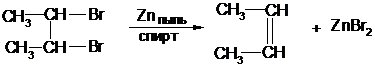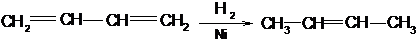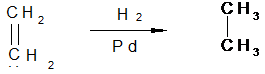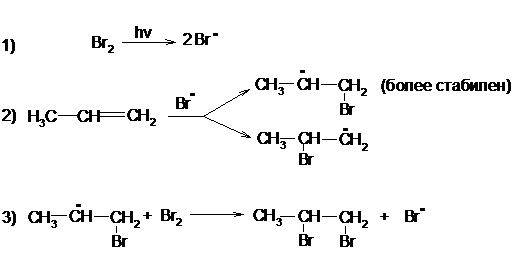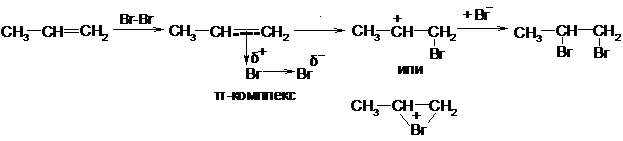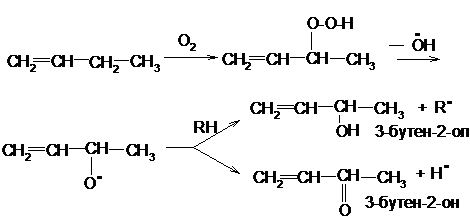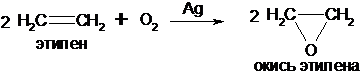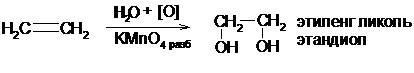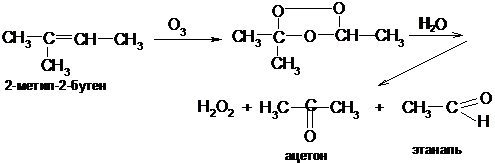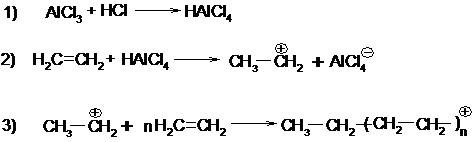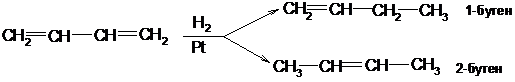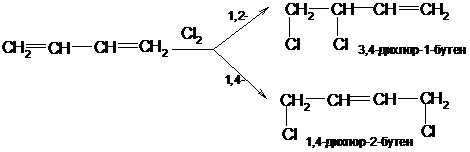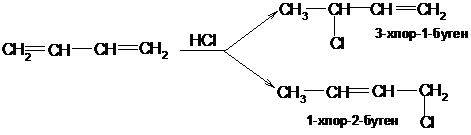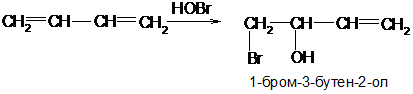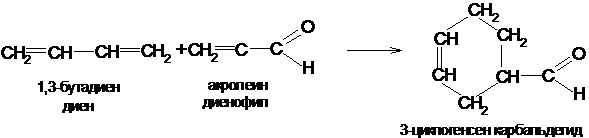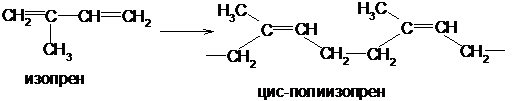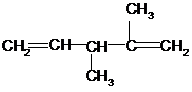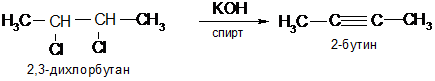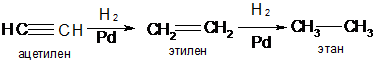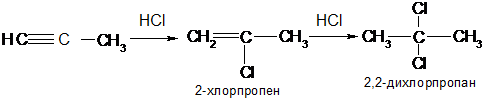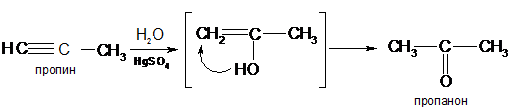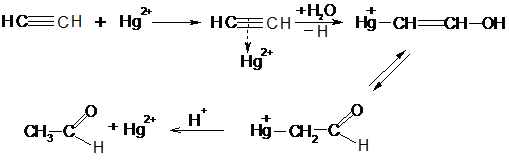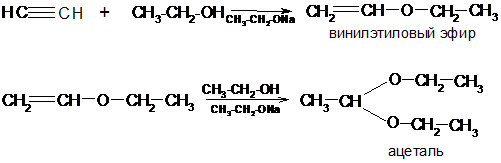Глава 3 АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
АЛКАНЫ,АЛКЕНЫ, АЛКИНЫ И АЛКАДИЕНЫ
Предельными углеводородами (алканами) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только σ-связями. В алканах атомы углерода находятся в состоянии sp3-гибридизации.
Алканы: определениек,изомерия и номенклатура
Для предельных углеводородов характерна структурная изомерия. Изомеры этого типа отличаются друг от друга порядком связей между отдельными атомами в молекуле (структурой углеродной цепи).
Как ранее отмечалось, первые четыре члена гомологического ряда предельных углеводородов сохранили тривиальные названия: метан, этан, пропан, бутан. По рациональной номенклатуре алканы называют как производные метана. При выборе основы используют или самый разветвленный атом углерода, или тот, вокруг которого стоят наиболее простые радикалы. По номенклатуре ИЮПАК названия предельных углеводородов характеризуются суффиксом «ан».
 триметилизобутилметан трет-бутилнеопентилметан
триметилизобутилметан трет-бутилнеопентилметан
2,2,4-триметилпентан 2,2,5,5-тетраметилгексан
Способы получения алканов
Главным природным источником предельных углеводородов является нефть, а для первых членов гомологического ряда – природный и попутный газы.
Выделение индивидуальных соединений из нефти или продуктов ее крекинга – задача весьма трудоемкая, поэтому приходится прибегать к синтетическим методам получения.
1. Алканы могут быть получены при восстановлении алкенов или алкинов водородом в присутствии катализаторов. Катализаторами гидрирования и дегидрирования чаще всего используют специальным образом обработанные металлические платину, палладий или никель.
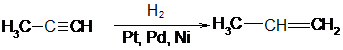
пропин пропен
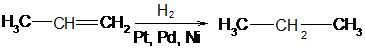
пропен пропан
2. Самые разнообразные производные алканов могут быть восстановлены при высокой температуре восстановителями или водородом на катализаторе. Обычно эта реакция используется для восстановления галогенопроизводных:

иодэтан этан
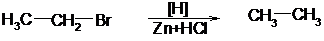
бромистый этил этан
3. Предельные углеводороды образуются при действии воды на металлоорганические соединения:

бромистый этилмагний этан
4. В лабораторной практике алканы получают сплавлением солей карбоновых кислот со щелочами:
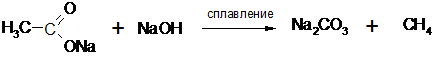
ацетат натрия метан
5. При действии металлического натрия на моногалогенопроизводные (реакция Вюрца):
2 CH3─CH2─J  2NaJ + CH3─CH2─CH2─CH3
2NaJ + CH3─CH2─CH2─CH3
иодэтан бутан
Если в реакции Вюрца участвуют два типа галогенопроизводных, то образуется смесь трех различных алканов, так как вероятность встречи в реакционном комплексе молекул одинаковых или разных равна:
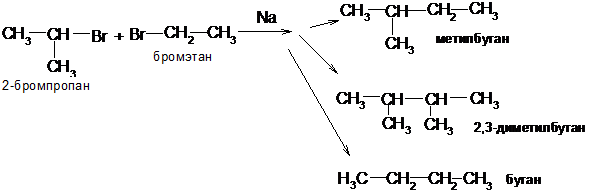
6. Электролиз солей карбоновых кислот (реакция Кольбе):

Анионы кислотного остатка окисляются на аноде с образованием свободных радикалов:
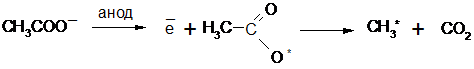
которые объединяются в молекулы предельных углеводородов:

Физические свойства
Согласно теории химического строения А.М.Бутлерова, физические свойства алканов, как и других органических соединений, определяются их составом и строением.
В гомологическом ряду предельных углеводородов четыре первых члена при обычной температуре – газы, далее следуют жидкости и, начиная с С16Н34 – твердые вещества.
Таблица 3.1 - Физические свойства некоторых алканов
| Углеводород
| tпл,оС
| tкип,оС
| Плотность
г/см3
| Показатель рефракции
|
|
|
|
|
|
|
| Метан СН4
Этан С2Н6
Пропан С3Н8
н-Бутан С4Н10
Изобутан С4Н10
н-Пентан С5Н12
Изопентан С5Н12
Неопентан С5Н12
н-Гексан С6Н14
н-Гептан С7Н16
н-Октан С8Н18
Изооктан (2,2,4-триметилпентан)
н-Нонан С9Н20
н-Декан С10Н22
н-Пентадекан С15Н32
н-Эйкозан С20Н42
н-Гектан С100Н202
| -182,5
-182,8
-187,6
-138,3
-159,4
-129,8
-159.9
-16,6
-95,3
-90,6
-56,8
-107,4
-53.6
-29,7
10,0
36,4
115,2
| -161,6
-88,6
-42,1
-0,5
-11,7
36,0
27,9
9,5
68,7
98,5
125,7
99,2
150,8
174,0
270,5
205,0 (2кПа)
-
| 0,4161
0,5461
0,5082
0,5842
0,5632
0,563
0,626
0,613
0,660
0,684
0,703
0,692
0,718
0,730
0,765
0,777при tпл
-
| -
-
1,33781
1,3326
-
1,3575
1,3537
1,3513
1,3749
1,3838
1,3974
1,3915
1,4056
1,4120
1,4313
-
-
|
1.При температуре кипения
2. В жидком состоянии под давлением
Алканы – вещества неполярные и труднополяризуемые. Растворимость их в воде ничтожна. Атомы в молекулах предельных углеводородов соединены только σ-связями. Расстояния между соседними углеродными атомами 0,154 нм. В коротких цепях по С-С связям возможно свободное или почти свободное вращение.
Алканы поглощают ультрафиолетовое излучение в области длин волн менее 200 нм (они бесцветны). В ИК спектрах для них характерны полосы в области 2800 – 3000 см–1 (валентные колебания связи С-Н) 1380 -1470 см–1 (деформационные колебания той же связи). Полосы поглощения, отвечающие колебаниям связи С-С, мало интенсивны и трудно идентифицируются.
ЯМР-спектры алканов трудно расшифровываются, так как химические сдвиги различным образом расположенных протонов имеют близкие значения (около 0,5 – 2 м.д.)
Химические свойства
Химические превращения предельных углеводородов могут происходить либо за счет разрыва цепи углеродных атомов, либо за счет отрыва атомов водорода с последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления и замещения.
Процессы расщепления связей С-С или С-Н с образованием свободных радикалов требуют большой энергии активации и поэтому при обычной температуре идут только в присутствии катализаторов.
Место вступления заместителя в молекулу алкана определяется в первую очередь вероятностью образования того или иного радикала, т.е. прочностью связей водородного атома с углеродом и стабильностью возникающего радикала.
Радикальное галогенирование
Замещение водородных атомов на галоген – одна из наиболее характерных реакций предельных углеводородов. С F2 реакция идет со взрывом, а с J2 – процесс ограничен равновесием, т.к. йодистый водород восстанавливает образующиеся йодистые алкилы. Следовательно, скорость галогенирования с одной стороны зависит от природы галогена (F>>Cl>Br>J), а с другой от строения углеводорода. Общеизвестно, что легче всего галогенирование протекает по третичному углеродному атому, а труднее всего – по первичному.
Галогеном можно заместить как один атом водорода в молекуле, так и все.

хлористый метил
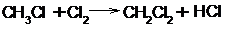
хлористый метилен

Хлороформ

четыреххлористый углерод
Галогенирование алканов на свету или под действием высоких температур протекает по цепному радикальному механизму и является типичным примером радикального замещения (SR).
СН4 + Br2 → СН3Br + НBr
На первой стадии под влиянием света происходит гомолитический разрыв связи в молекуле брома и она распадается на два радикала:
Br2 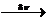 2 Br*
2 Br*
Атом или молекула подобного типа, содержащие неспаренный электрон, называются свободными радикалами и, как правило, существуют лишь доли секунды, так как мгновенно реагируют с присутствующими веществами.
Поэтому на следующей стадии реакции радикал Br• атакует молекулу метана, образуя бромистый водород и углеводородный радикал – метил:
СН4 + Br* → НBr + СН3*
Образовавшийся органический радикал атакует молекулу брома и регенерирует радикал галогена:
СН3* + Br2 → СН3Br + Br*
Этот процесс может продолжаться бесконечно долго, но на практике течение цепных реакций ограничивается так называемыми процессами обрыва цепи, при которых радикалы, реагируя один с другим, выбывают из процесса:
Br• + Br• → Br2
CH3• + Br• → CH3Br
CH3• + CH3• → CH3-CH3
Кроме того, они могут взаимодействовать с примесями или со стенками сосуда.
Нитрование
Концентрированная азотная кислота при обычной температуре почти не действует на предельные углеводороды, а при нагревании действует как окислитель. М. И. Коновалов предложил проводить нитрование предельных углеводородов разбавленной азотной кислотой при нагревании (около 140 оС). По механизму реакция нитрования является свободно радикальным процессом:
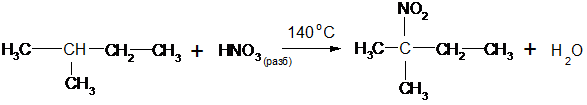
2-метил-2-нитробутан
В случае разветвленной молекулы алкана легче всего замещается водород у третичного углеродного атома. В промышленных условиях нитрование осуществляют оксидами азота.
Окисление
Окислители, даже сильные, при обычных температурах не действуют на предельные углеводороды.
При температуре выше 300оС предельные углеводороды воспламеняются и сгорают с образованием СО2 и Н2О.
При температуре около 200оС эти углеводороды окисляются кислородом воздуха в присутствии марганцевых катализаторов, образуя кислородсодержащие вещества с меньшим числом атомов углерода в молекуле, т.е. окисление сопровождается расщеплением молекул углеводородов. Окисление алканов также имеет радикальный механизм, а промежуточными продуктами являются гидроперекиси:
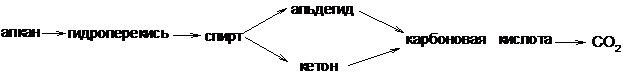
При очень высоких температурах в промышленности реализован процесс взаимодействия метана с водой
СН4 + Н2О → СО + 3Н2
Получающаяся смесь газов идет на синтез синтина или метанола.
Задачи для самопроверки
1. Рассчитать массу алкана (в г), полученного при взаимодействии 10 г бромистого пропила с металлическим натрием, если выход продукта составляет 60%.
2. Сколько монохлорзамещенных углеводородов можно получить хлорированием 2,3-диметилбутана?
3. Сколько моль кислорода потребуется для сжигания 1 моль гептана?
4. Определить объем (дм3) диоксида углерода, образовавшегося при взрыве смеси 5 дм3 метана и 11 дм3 кислорода.
5. Сколько мононитрозамещенных углеводородов можно получить при нитровании по Коновалову 2,3-диметилбутана?
6. Рассчитать объем (дм3) газа (н. у.), полученного при прокаливании 6 г ацетата натрия с избытком гидроксида натрия, если выход продукта составляет 50%.
Изомерия и номенклатура
В соответствии с правилами ИЮПАК при построении названий алкенов наиболее длинная углеродная цепь, содержащая двойную связь, получает название соответствующего алкана, в котором суффикс «ан» заменен на «ен». Эта цепь нумеруется таким образом, чтобы углеродные атомы, участвующие в образовании двойной связи, получили номера, наименьшие из возможных. Радикалы называются и нумеруются, как и в случае алканов:
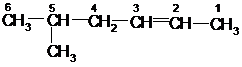 5-метил-2-гексен
5-метил-2-гексен
Углеводородные радикалы, образованные из алкенов, получают суффикс –енил, в общем случае –алкенил. Нумерация в сложных радикалах начинается от углеродного атома, имеющего свободную валентность. Для простейших радикалов используются тривиальные названия:
 этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил
этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил
(винил) (аллил) (изоаллил)
Структурная изомерия начинается в этом ряду, как и в ряду предельных углеводородов, с члена ряда С4, однако число изомеров значительно больше. Наряду с изомерией, связанной со строением углеродной цепи, в ряду олефинов наблюдается структурная изомерия, обусловленная положением двойной связи в цепи.

Кроме того, в ряду олефинов имеет место пространственная (геометрическая), так называемая цис-, транс- изомерия (E, Z).
Вращение вокруг связи С─С в молекулах алканов требует малой затраты энергии (8-16 кДж/моль). Для этого достаточно теплового движения молекул.
Вращение же фрагментов С=С относительно друг друга требует разрыва π-связи и затраты 272 кДж/моль. В связи с этим соединения, содержащие у атомов углерода, связанных двойной связью, хотя бы по одному разному заместителю, могут существовать в изомерных формах. Эти изомеры различаются пространственным расположением заместителей относительно друг друга. Если заместители расположены по одну сторону от двойной связи, то такой изомер называется цис-изомером, и транс-изомером, если по разные стороны:

(Z) цис-2-бутен (Е) транс-2-бутен
В сложных молекулах понятие цис- и транс- становятся неопределенными. В этих случаях пользуются общей ZЕ-системой обозначений. Составлена таблица возрастающего старшинства групп. Если старшая группа у одного из углеродных атомов находится по одну сторону со старшей группой у другого атома углерода, то этот изомер называется Z-изомером.
Способы получения
Олефины встречаются в некоторых сортах нефти. В чистом виде из нефти выделены углеводороды от С6Н12 до С13Н26. Алкены, в виде сложных смесей получаются при крекинге нефти.
В технике, кроме того, применяется получение этиленовых углеводородов дегидрированием предельных углеводородов. Катализатором этого процесса служит окись хрома:
 В лаборатории этиленовые углеводороды получают следующими способами:
В лаборатории этиленовые углеводороды получают следующими способами:
1. При действии спиртовых растворов едких щелочей на галогенопроизводные отщепляется галогеноводород и образуется двойная связь. Порядок отщепления галогеноводорода в большинстве случаев определяется правилом Зайцева: при образовании галогеноводорода и воды наиболее легко отщепляется водород от наименее гидрогенизированного соседнего атома углерода:
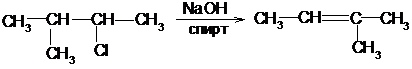
2-метил-3-хлорбутан 2-метил-2-бутен
2. При действии на спирт дегидратирующих средств:


этилен
3. При действии Zn или Mg на дигалогенопроизводные с двумя атомами галогена у соседних атомов углерода (вицинальные дигалогенопроизводные):
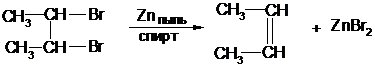
2,3-дибромбутан 2-бутен
4. Гидрированием ацетиленовых или диеновых углеводородов. Алкины гидрируются над катализаторами с пониженной активностью (Fe или платина и Рd, «отравленные» серой, Na в аммиаке):

пропин пропен
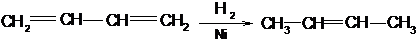
1,3-бутадиен 2-бутен
Физические свойства
Физические свойства алкенов подобны свойствам соответствующих алканов. Низшие алкены (С2 – С4) являются газами, средние алкены (начиная с С5 до С17) жидкостями, не смешивающиеся с водой. Высшие алкены – твердые вещества.
Олефины с нормальной цепью углеродных атомов кипят при более высокой температуре, чем их изомеры с разветвленной цепью. Перемещение двойной связи в центр молекулы вызывает повышение температуры кипения и плавления алкена. Цис-изомеры обычно кипят при более высокой, а плавятся при более низкой температуре, чем транс-изомеры.
Плотность олефинов меньше единицы, но больше, чем плотность соответствующих парафинов. В гомологическом ряду она увеличивается. Для олефинов характерны более высокие показатели преломления света, чем для парафинов.
Следует заметить, что этиленовые углеводороды хорошо растворяются в растворах некоторых солей тяжелых металлов (Сu2Cl2), образуя с ними комплексные соединения.
Химические свойства
Главным структурным элементом, определяющим реакционную способность алкенов, является двойная связь, представляющая собой сочетание σ- и π-связей (sp2-гибридизация). При сравнении структурных и энергетических параметров молекул алканов и алкенов видно, что двойная связь значительно короче и прочнее одинарной связи. Однако энергия двойной связи меньше, чем энергия двух ординарных, на 92,1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
Таким образом, для олефинов наиболее типичны реакции присоединения. Однако следует иметь в виду, что олефины способны и к реакциям замещения, причем некоторые из них идут значительно легче, чем у парафинов (наиболее легко замещается водород у α-углеродного атома по отношению к двойной связи благодаря σ,π-сопряжению (сверхсопряжению). При разрыве таких СН-связей образуется радикал, стабилизированный сопряжением (см. главу 2).
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерны реакции электрофильного присоединения (АЕ).
Гидрирование
Присоединение водорода к алкенам происходит только в присутствии катализаторов, как гетерогенных (Pt, Pd, Ni) так и гомогенных. Наиболее часто проводят каталитическое гидрирование на гетерогенных катализаторах:
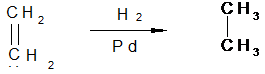
этилен этан
Галогенирование
Олефины легко присоединяют галогены. Скорость реакции зависит от природы галогена и строения алкена. Фтор реагирует с воспламенением, иод – медленно на солнечном свету:

1,2-дибромэтан
Галогены могут присоединяться к олефинам по радикальному или ионному механизму.
При радикальном присоединении атома галогена, присоединение начинается к наиболее доступному из атомов углерода с образованием наиболее стабильного из возможных радикалов:

пропен 1,2-дибромпропан
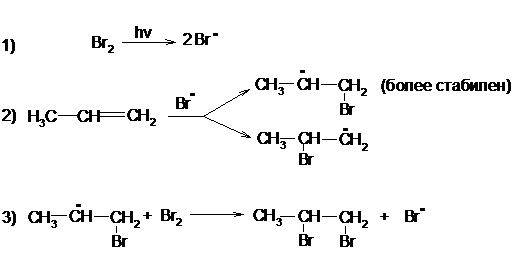
Чаще происходит присоединение по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделятся отрицательный ион галогена. К возникшему карбониевому или бромониевому катиону присоединяется отрицательный ион галогена:
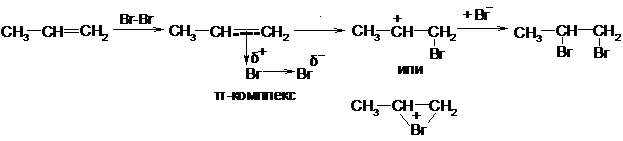
Реакция олефинов с галогенами служит для качественного и количественного определения их в смеси.
Гипогалогенирование
Присоединение к олефинам гипогалогенитных кислот и их эфиров также происходит по правилу Марковникова: более электроотрицательный гидроксил направляется преимущественно к наименее гидрогенизированному атому углерода:

пропен 1-хлор-2-пропанол
Окисление
Олефины окисляются кислородом воздуха или другими окислителями. Направление окисления зависит от условий реакции и выбора окислителя.
а) Алкены с кислородом воздуха без катализатора образуют гидропероксиды, распадающиеся с образованием спиртов и карбонильных соединений. Воздействию подвергается атом водорода у α-углеродного атома:
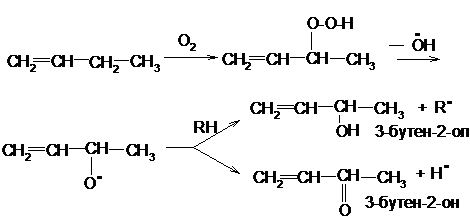
б) Кислородом воздуха в присутствии серебряного катализатора олефины окисляются до органических окисей (эпоксидов):
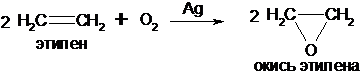
Аналогично действуют гидропероксиды ацилов (реакция Прилежаева)

В) Разбавленный раствор перманганата калия (реакция Вагнера) или пероксид водорода в присутствии катализаторов (Cr2O3, OsO4 и др) с олефинами образуют гликоли:
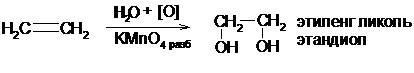
Г) При действии концентрированных растворов окислителей (перманганат калия, хромовая кислота, азотная кислота) молекула олефина разрывается по месту двойной связи образуя кетоны и кислоты:

Д) При определении строения этиленовых углеводородов в качестве специфического окислителя используют озон – реакция озонирования Гарриеса (озонолиз). Озон присоединяется по месту двойной связи, образуя нестойкие, взрывчатые озониды, которые при обработке водой распадаются на пероксид водорода и карбонильные соединения:
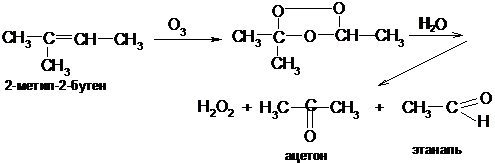
Полимеризация
Одним из наиболее важных для современной техники превращений олефинов является реакция полимеризации.
Полимеризацией называют процесс образования высокомолекулярного вещества (полимера) путем соединения с помощью главных валентностей молекул исходного низкомолекулярного вещества (мономера).
Полимеризация алкенов может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов.
В реакцию полимеризации могут вступать как индивидуальные вещества, так и смеси мономеров. В последнем случае говорят о смешанной полимеризации – сополимеризации.
Полимеризация алкенов в зависимости от механизма может быть двух типов: радикальная или ионная.
Радикальная полимеризация вызывается (инициируется) веществами, способными в условиях реакции распадаться на свободные радикалы, а также действием теплоты, света. Растущая частица полимера вплоть до момента стабилизации представляет собой свободный радикал. Радикалы-инициаторы входят в состав молекул полимеров, образуя его концевую группу:

Обрыв цепи происходит при столкновении либо с молекулой регулятора цепи, примеси, стенками сосуда.
Каталитическая или ионная полимеризация может быть катионной или анионной.
Катализаторами катионной полимеризации являются кислоты, хлориды алюминия, бора и т.д. При катионной полимеризации катализатор обычно регенерируется и не входит в состав полимера. Процесс может иметь цепной характер и протекать с очень большой скоростью. Поэтому ионную полимеризацию проводят при низких температурах.
Механизм катионной полимеризации этилена в присутствии AlCl3 и следов НСl можно представить следующим образом:
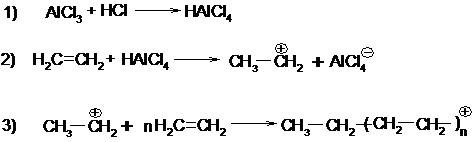
Обрыв цепи может произойти вследствие захвата растущим катионом аниона или потерей протона и образованием концевой двойной связи.
Катализаторами анионной полимеризации служат щелочные металлы, их амиды, металлоорганические соединения и т.д.
Механизм анионной полимеризации под влиянием металлалкилов можно представить следующим образом:

На реакцию полимеризации сильное влияние оказывает присутствие в мономере ничтожных примесей. Некоторые примеси, например многоатомные фенолы, ароматические амины, хиноны, способны задерживать полимеризацию. Такие вещества называются ингибиторами (замедлителями). Ингибиторы используются при хранении и транспортировке мономеров.
Промышленное значение имеет полимеризация этилена и пропилена в присутствии триэтилалюминия.
ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ
1. При взаимодействии 20 г 3-бромпентана со спиртовым раствором гидроксида калия с последующей очисткой было получено 8 г цис-изомера непредельного углеводорода. Написать уравнение реакции и определить выход целевого продукта.
2. При взаимодействии 38 г 2-бром-3-метилбутана со спиртовым раствором гидроксида калия с последующей очисткой было получено 10 г непредельного углеводорода. Написать уравнение реакции и определить выход целевого продукта.
3. При обработке 15 дм3 (при н. у.) газообразной смеси этана и пропилена хлором было получено 25 г 1,2-дихлорпропана. Определить объемную долю (в %) пропилена в смеси.
4. Смесь пропана и пропилена объемом 300 см3 (н. у.) пропустили через раствор йода, получив при этом 3 г 1,2-дийодпропана. Рассчитать объемную долю (%) пропана в смеси.
5. Написать структурную формулу 2,5,5,6-тетраметил-3-октена.

6.Назовите углеводород по международной номенклатуре

Гидрирование
Каталитически возбужденный водород присоединяется в 1,2- и 1,4-положения:
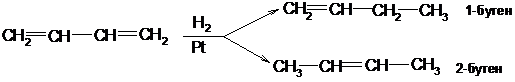
Галогенирование
Галогены также способны присоединяться к сопряженным системам в 1,2- и 1,4-положения:
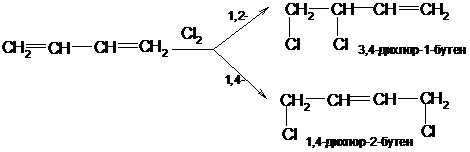
Как и в случае этиленовых углеводородов, присоединение может проходить как по ионному, так и по радикальному механизму.
При ионном механизме присоединения первоначально возникающий π-комплекс (I) быстро превращается в сопряженный карбониевый ион с положительным зарядом на втором и четвертом углеродных атомах. Этот ион можно изобразить или двумя граничными формулами (II) или одной формулой (III). Этот карбкатион присоединяет анион галогена с образованием продуктов 1,2- и 1,4-присоединения:

Гидрогалогенирование
В реакциях присоединения галогеноводородов действуют те же закономерности:
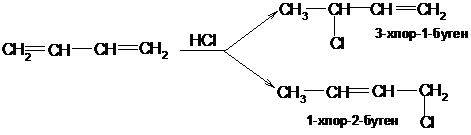
Гипогалогенирование
Гипогалогенитные кислоты и их эфиры присоединяются преимущественно в 1,2-положение:
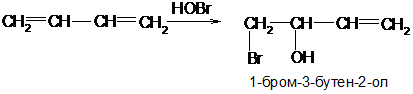
Димеризация
При нагревании молекулы диеновых углеводородов способны присоединяться друг к другу таким образом, что одна из них реагирует в 1,2-, а другая в 1,4- положениях. Одновременно в небольших количествах образуется продукт, когда обе молекулы реагируют в 1,4-положениие:

Диеновый синтез
Диеновые углеводороды особенно легко димеризуются с молекулами, имеющими активированную двойную связь. Реакции этого типа называются диеновым синтезом или реакциями Дильса-Альдера:
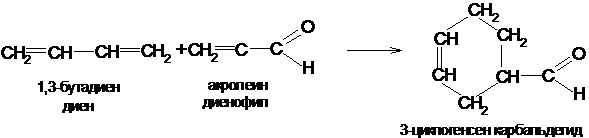
Полимеризация
Важной особенностью диеновых углеводородов с сопряженными связями является их способность полимеризоваться в каучукоподобные продукты.
Промышленный интерес представляет цепная полимеризация диеновых углеводородов под влиянием катализаторов или инициаторов. В качестве катализаторов используются щелочные металлы, металлоорганические соединения, в качестве инициаторов – органические и неорганические пероксиды.
При полимеризации отдельные молекулы мономеров могут соединяться друг с другом в 1,2-, в 1,4-положения или одна молекула реагирует в 1,2-, а другая – в 1,4- положение:

Скорость полимеризации зависит от строения диенов и условий полимеризации. Заместители в середине молекулы облегчают, а на конце молекулы затрудняют полимеризацию. Изопрен полимеризуется быстрее, а пиперилен медленнее, чем дивинил.
Наиболее ценные продукты получаются при стереорегулярной (пространственно упорядоченной) полимеризации в 1.4-положение с образованием цис-конфигурации каждого остатка:
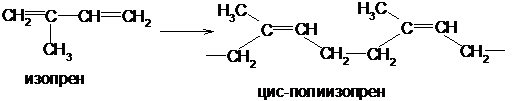
По химическому составу и строению натуральный каучук представляет собой стереорегулярный цис-полимер изопрена.
Строение каучука и других полимеров диеновых углеводородов было доказано методом озонирования (по Гарриесу). Получение при озонолизе левулинового альдегида подтверждает упорядоченное 1,4-строение.

Различные виды синтетического и натурального каучука широко применяются в промышленности. Пионером в организации крупного промышленного производства синтетического каучука был Советский Союз.
ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ
1. Рассчитать массу (г) 1,3-бутадиена, образующегося в результате дегидрирования 20 дм3 бутана (н. у.), если выход бутадиена составляет 50%.
2. При пропускании 200 дм3 (при н. у.) паров этилового спирта над дегидратирующим и дегидрирующим катализаторами было получено 90 дм3 газообразного (при н. у.) дивинила. Определить выход реакции.
3. Рассчитайте максимальную массу (г) брома, который может присоединиться к 1,3-бутадиену, если его объем составляет 12 дм3 (условия нормальные).
4. При окислении по Гарриесу непредельного углеводорода получен ацетон, масса которого оказалась равной 29 г. Определить массу (в г) непредельного углеводорода, вступившего в реакцию, исходя из предположения, что выход продуктов озонолиза – количественный.
5. Назовите углеводород по международной номенклатуре
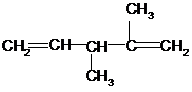
6. Написать структурную формулу 2,5-диметил-4-изопропил-1,5-гексадиена.
Изомерия и номенклатура
Ацетиленовые углеводороды по номенклатуре ИЮПАК называют, пользуясь теми же правилами, что и в случае предельных углеводородов, но суффикс «ан» заменяется суффиксом «ин». Главная цепь выбирается так, чтобы в нее попала тройная связь, а нумеруется с того конца, к которому ближе тройная связь.
Простейшие ацетиленовые углеводороды часто называют как алкилзамещенные ацетилена, т.е. по рациональной номенклатуре:

4-метил-1-пентин 4-метил-2-пентин
Изобутилацетилен метилизопропилацетилен
Изомерия ацетиленовых углеводородов определяется как строением углеродного скелета, так и положением тройной связи.
Способы получения.
Ацетиленовые углеводороды получают либо алкилированием ацетилена, либо отщеплением галогеноводородов или галогенов от полигалогенопроизводных.
1. Ацетилен можно получить при высокотемпературном крекинге метана:

а также при гидролизе карбида кальция:
СаС2 + 2Н2О → СН≡СН + Са(ОН)2
2. Алкилирование ацетилена осуществляют, превращая ацетилен в металлоорганические соединения:
СН≡СН +NaNH2 → CH≡C–Na + NH3
ацетиленид натрия
CH≡C–Na + СH3J → CH≡C–СH3 + NaJ
пропин
3. Ацетиленовые углеводороды образуются при действии спиртовой щелочи на дигалогенопроизводные предельных углеводородов, содержащих галогены у одного или соседних атомов углерода:

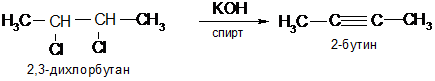
Физические свойства
Основные закономерности в изменении температур кипения и плавления в гомологическом ряду ацетиленовых углеводородов сходны с закономерностями в ряду этиленовых и предельных углеводородов.
Положение тройной связи в цепи еще больше влияет на температуру кипения. Так, например, 1-бутин кипит при 8,5оС, а 2-бутин – при 27оС, тогда как оба бутана и все бутилены при обычных условиях – вещества газообразные.
Плотность и показатель преломления алкинов значительно выше, чем у алкенов и тем более алканов.
Ацетиленовые углеводороды имеют в инфракрасном спектре характерные полосы поглощения валентных колебаний тройной связи при 4,75 – 4,2 мкм (2100 – 2300 см–1.
Химические свойства
При рассмотрении химических свойств алкинов следует учитывать особенности тройной связи: по сравнению с алкенами алкины несколько менее активны в реакциях электрофильного присоединения и более активны в реакциях с нуклеофилами (вода, алкоголяты, амины). Эти особенности ацетиленовой группировки объясняются ее строением. Оба углеродных атома в ацетилене находятся в sp-гибридном состоянии. Между тем, чем больше доля s-орбитали в гибридном состоянии, тем ближе электроны находятся к ядру и, следовательно, тем труднее эти электроны вовлекаются в химические превращения с участием электрофилов. С другой стороны, ядра углерода в ацетилене гораздо более доступны для нуклеофильных реагентов благодаря его линейному строению:

Этот же фактор обусловливает и значительную СН-кислотность концевой ацетиленовой группировки. Электронная пара С-Н связи в молекуле ацетилена ближе к ядру, чем в случае этилена, и атом водорода более положительно поляризован.
Гидрирование
Водород присоединяется по месту тройной связи в присутствии тех же катализаторов, что и по месту двойной связи:
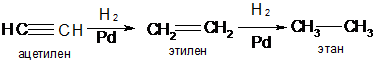
Галогенирование
Присоединение галогенов (хлора, брома, йода) к алкинам по электрофильному механизму также идет с меньшей скоростью, чем к олефинам. Образующиеся при этом непредельные дигалогенопроизводные можно выделить из реакционной смеси:

Гидрогалогенирование
Присоединение галогеноводородов к алкинам приводит к смеси этиленовых моногалогенозамещенных и предельных дигалогенозамещенных углеводородов:
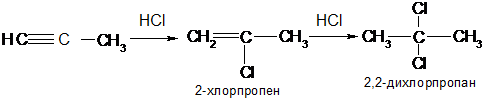
Реакции присоединения галогенов и галогеноводородов к алкинам могут проходить по механизму электрофильного или радикального присоединения. При электрофильном присоединении соблюдается правило Марковникова, при радикальном механизме наблюдается противоположное направление присоединения.
Гидратация
Алкины легко присоединяют воду и кислоты в отличие от алкенов. Присоединение воды ведут в присутствии сульфата ртути – реакция Кучерова. При этом из ацетилена получается уксусный альдегид, а из его гомологов – кетоны:
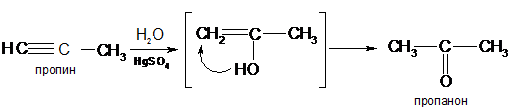
Реакцию ацетилена с водой используют в промышленности для получения уксусного альдегида. Возможный механизм реакции Кучерова:
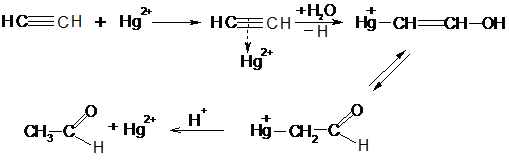
Присоединение спиртов
Спирты присоединяются к алкинам в присутствии алкоголятов. Этим способом получают виниловые эфиры, а также ацетали:
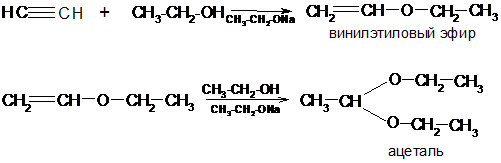
Присоединение спиртов в присутствии алкоголятов – это типичная реакция нуклеофильного присоединения. Ее механизм можно представить следующим образом:

Окисление
Алкины способны окисляться по месту тройной связи до карбоновых кислот. Однако тройная связь более стойкая к действию окислителей, чем двойная. В качестве окислителей приме<



 триметилизобутилметан трет-бутилнеопентилметан
триметилизобутилметан трет-бутилнеопентилметан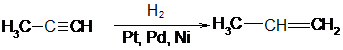
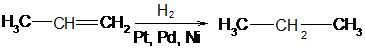

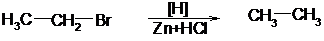

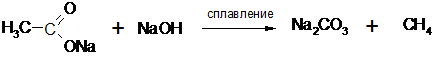
 2NaJ + CH3─CH2─CH2─CH3
2NaJ + CH3─CH2─CH2─CH3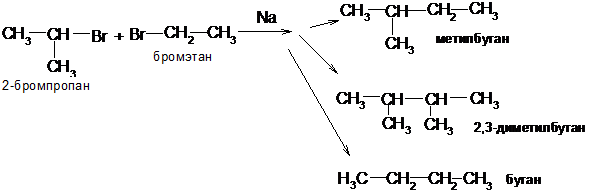

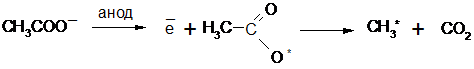


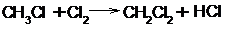


 2 Br*
2 Br*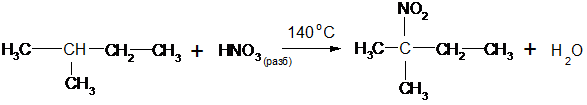
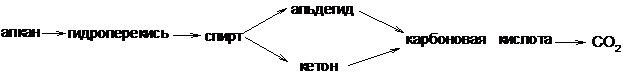
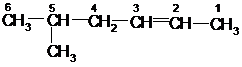 5-метил-2-гексен
5-метил-2-гексен этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил
этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил

 В лаборатории этиленовые углеводороды получают следующими способами:
В лаборатории этиленовые углеводороды получают следующими способами: