Процессы, протекающие при постоянном давлении встречаются в физической химии чаще, чем процессы протекающие при при постоянном объеме, т.к. большинство процессов проводится в открытых сосудах.
Если совершается только работа расширения и давление P поддерживается постоянным, то I закон термодинамики можно записать в виде
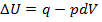
(1.13)
Или U2-U1=q-P(V2-V1)
Поглощенная теплота равна q=(U2+PV2)-(U1+PV1)
U+PV – величина являтся функцией состояния
Пусть H=U+PV новая функция состояния 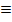 энтальпия
энтальпия
(1.14)
Или уравнение (20) -> q=H2-H1= 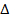 H
H
То есть теплота, поглощенная в процессе, который протекает при постоянном давлении, равна изменению энтальпии, если единственным видом произведенной работы является работа расширения.
Пример:
Пусть совершается только механическая работа в калориметре с постоянным объемом q= 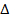 U (из I закона), количество выделившейся теплоты есть U, а в калориметре с P=const, количество выделившейся теплоты есть мера уменьшения энтальпии H, q=
U (из I закона), количество выделившейся теплоты есть U, а в калориметре с P=const, количество выделившейся теплоты есть мера уменьшения энтальпии H, q= 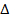 H.
H.
Теплоёмкость
Определение:
Теплоёмкостью называется количество теплоты, необходимое для того, чтобы повысить Т системы на какую-то определенную величину (обычно на 10), т.е. отношение поглощенной теплоты к приросту T: q/ 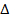 T
T
Теплоёмкость при данной Т представляет собой предел к которому стремится это отношение при уменьшении 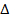 T.
T.
C= 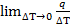
Пусть существует система химически инертная, обладает постоянной массой m и совершает работу расширения.
U=f(T,V) U – функция состояния
Полный дифференциал U:
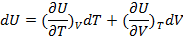
(1.15)
 – изменение внутренней энергии за счет изменения Т
– изменение внутренней энергии за счет изменения Т
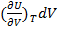 - изменение внутренней энергии за счет изменения V
- изменение внутренней энергии за счет изменения V
Поскольку система сама совершает работу (расширение), то
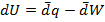 и
и  =>
=>
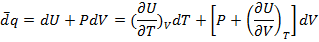
(1.16)
Т.о. количество поглощенной теплоты зависит не только от прироста T, но и от изменения V.
Пусть V=const: 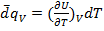 или
или

(1.17)
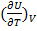 - измеряется экспериментально при постоянном объёме.
- измеряется экспериментально при постоянном объёме.
С другой стороны в такой же системе H – функция(P,T) и
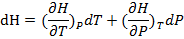
(1.18)

(1.19)
Как соотносятся Cp и Cv?
Cp> Cv, так как нагревание вещества при P=const всегда сопровождается работой расширения.
Поделим 1.16 на dT:
Пусть P=const:
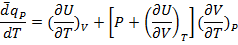
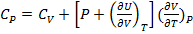
(1.20)
Для одного моля чистого вещества:
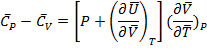
(1.21)
{ 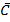 -мольные C}
-мольные C}
Велbчину 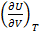 можно измерить экспериментально
можно измерить экспериментально
 Опыт Джоуля
Опыт Джоуля
При открытии крана газ переходит из сосуда 1 в сосуд 2. Такое расширение газа не приводит к заметному изменению Т жидкости, т.е. 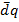 =0; При таком расширении никакая работа не совершается
=0; При таком расширении никакая работа не совершается 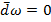 =>
=>
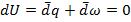
Пусть Т=const => dU – полный дифференциал (1.15);
dU= 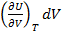 =0
=0
dV≠0 => 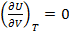
(1.22)
Т.о. внутренняя энергия газа при постоянной Т не зависит от V.
Уравнение 1.22 справедливо для идеальных газов.
Для реальных газов величина 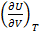 ≠0
≠0
Учтем также, что T=const

(1.23)
Молекулы идеального газа не взаимодействуют друг с другом => энергия остается неизменной при изменении расстояния между молекулами.
Уравнения 1.22 и 1.23 являются выражениями закона идеальных газов и выводятся из II Закона термодинамики, применив закон идеальных газов.
Кроме того учтем для идеальных газов

Тогда разность 1.21 теплоемкостей приобретает вид

(1.24)
Общее выражение  для газов будет получено с помощью II закона термодинамики.
для газов будет получено с помощью II закона термодинамики.
Вообще говоря, чем сложнее молекула, тем больше её мольная теплоёмкость и тем больше влияние Т. 
Зависимость 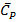 от Т для пара газов.
от Т для пара газов.
Мольную теплоёмкость простых газов можно с большой точностью вычислить метеорологических данных, чем непосредственно измерить в эксперименте, особенно при высоких Т.
Для вычисления теплоты поглощаемой 1 молем при нагревании газа от Т1 до Т2, удобно представить 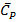 как функцию Т.
как функцию Т.
Эмпирическое уравнение  применимо в диапазоне Т 300-1500К
применимо в диапазоне Т 300-1500К
Теплоемкость твердых тел см. ФТТ
 особенно полезно для расчета С твердого тела при Т<15К
особенно полезно для расчета С твердого тела при Т<15К
Примеры:
1)Молекулярные кристаллы, в частности кристаллы инертных газов. Энергия взаимодействия двух частиц может быть представлена 
Запишем потенциал в более красивой форме
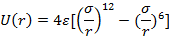
имеем потенциал Ленарда Джонса.
Этот потенциал описывает свойства газообразных Ne-Xe (атомы не деформируются при объединении в тв. т.)
Параметры  подобрать так, чтобы они позволяли хорошо описывать термодинамические свойства газов. А затем использовать те же параметры для описания свойств твердых тел, сопоставив результаты с экспериментом.
подобрать так, чтобы они позволяли хорошо описывать термодинамические свойства газов. А затем использовать те же параметры для описания свойств твердых тел, сопоставив результаты с экспериментом.
2)Ионные кристаллы.
Полная энергия ионного кристалла в состоянии равновесия
 (если силы отталкивания
(если силы отталкивания  )
)
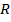 – равновесное состояние между ионами
– равновесное состояние между ионами
 постоянная Манделунга
постоянная Манделунга
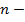 константа, определяемая природой кристалла (справедливость подобного выражения подвергается проверке с помощью термодинамического цикла Габера-Борна)
константа, определяемая природой кристалла (справедливость подобного выражения подвергается проверке с помощью термодинамического цикла Габера-Борна)
Рассматривается 1 моль NaCl. Переводится это кол-ва вещества из кристаллического состояния в пар (ионный и атомный) Для вычисления теплоты используем теплоемкость. Зная теплоту реакции можно определить U.
Термохимия
1.10.1 Определения.
В термохимии предметом рассмотрения является теплота, поглощаемая или выделяемая в химических реакциях (1), при разовых превращениях (2) или при разбавлении растворов (3).
Экзотермические реакции протекают с выделением q и 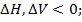
Эндотермические реакции протекают с поглощением q и 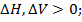
Изменение 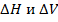 в химических реакциях зависит от того, в каком состоянии находится вещества и продукты реакции.
в химических реакциях зависит от того, в каком состоянии находится вещества и продукты реакции.
Например, теплота сгорания графита ≠ теплоте сгорания алмаза.
Значение термодинамических свойств обычно приводятся для стандартных состояний.
Стандартное состояние газа – это идеальный газ при P=1атм и данной Т, стандартное состояние твердого тела – это характерное кристаллическое состояние при P=1атм и данной Т, например, графит для углерода.
Стандартное состояние растворенного вещества – это концентрация, при которой активность = 1.
Температуру следует указать особо, т.к термодинамические функции табулируются при Т=250С.
Термодинамические функции в стандартном состоянии помечаются верхним индексом «0».
Уже знаем, что теплота, поглощенная при P=const в реакциях где единственным видом произведенной роботы является работа расширения =  , т.е. разности энтальпий продуктов реакции, указных в правой части уравнения, в их конечном состоянии Н1-Н данного числа молей реагирующих веществ, указанных слева, в их начальном состоянии. Можно определить только изменение Н, но не их абсолютные значения.
, т.е. разности энтальпий продуктов реакции, указных в правой части уравнения, в их конечном состоянии Н1-Н данного числа молей реагирующих веществ, указанных слева, в их начальном состоянии. Можно определить только изменение Н, но не их абсолютные значения.
Калориметрические изменения
Теплота, выделяемая или поглощаемая в химической реакции измеряется с помощью калориметра. Наиболее распространенный тип калориметра представляет собой камеру, в которой протекает реакция, а камера помещенная в сосуд, заполнена известным количеством воды. Повышение температуры воды измеряется чувствительным термометром произведение  (Своды+Скалор)
(Своды+Скалор) 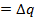 выделившейся.
выделившейся.
Своды: mводы*Суд
Скалор.: в калориметре проводят реакцию с известным тепловым эффектом.
Для термохимических измерений пригодны только реакции, которые проходят быстро и до конца, теплота сгорания в термохимии имеет наибольшее значение.
Сравнение различного типа реакций проводят по величине изменения стандартной энтальпии в данной реакции при 250С 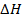 0.
0.
Колориметрические реакции бывают двух типов:
1) В калориметре с V=const: работа не производится, => поглощается 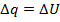 приросту внутренней энергии.
приросту внутренней энергии.
2) В калориметре с P=const: I закон 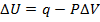
Количества теплоты 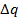 , поглощаемые в обоих экспериментах отличаются.
, поглощаемые в обоих экспериментах отличаются.
Задача 5
Теплота сгорания СО в калориметре с постоянным объемом равна -67,370 ккал/моль.
Вычислить теплоту сгорания в калориметре с постоянным давлением при допущении, что газы идеальны.
СО(газ)+1/2О2(газ)=СО2(газ)
В других типах калориметрических измерений выделяется очень маленькие количества теплоты и поэтому применяют чувствительные дифференциальные методы (термисторы) некоторые специальные калориметры имеют чувствительность в 1 мккал. Такие калориметры можно использовать для измерения теплоты, выделяющейся в реакциях с участием белков и полинуклеидов.
Теплоты сгорания имеют практическое значение, а не только теоретическое.
(Например, для того, чтобы человеку полностью израсходовать энергию, полученную от 1 свиного шницеля нужно 2 часа убирать снег, в то время как 10 минут плавания по энергии эквивалентны 1 яблоку.)
Пример:
1)Покупатель должен знать теплоту сгорания 1г угля.
2)Врач-диетолог должен знать число ккал, получаемое при сгорании различных видов пищи.



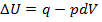
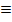 энтальпия
энтальпия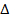 H
H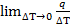
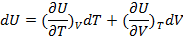
 – изменение внутренней энергии за счет изменения Т
– изменение внутренней энергии за счет изменения Т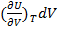 - изменение внутренней энергии за счет изменения V
- изменение внутренней энергии за счет изменения V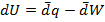 и
и  =>
=>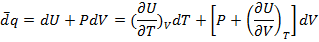
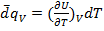 или
или
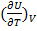 - измеряется экспериментально при постоянном объёме.
- измеряется экспериментально при постоянном объёме.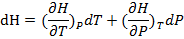

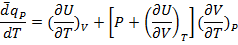
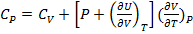
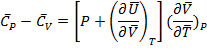
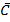 -мольные C}
-мольные C}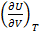 можно измерить экспериментально
можно измерить экспериментально Опыт Джоуля
Опыт Джоуля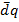 =0; При таком расширении никакая работа не совершается
=0; При таком расширении никакая работа не совершается 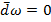 =>
=>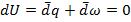
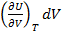 =0
=0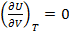



 для газов будет получено с помощью II закона термодинамики.
для газов будет получено с помощью II закона термодинамики.
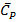 от Т для пара газов.
от Т для пара газов. применимо в диапазоне Т 300-1500К
применимо в диапазоне Т 300-1500К особенно полезно для расчета С твердого тела при Т<15К
особенно полезно для расчета С твердого тела при Т<15К
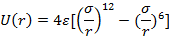
 подобрать так, чтобы они позволяли хорошо описывать термодинамические свойства газов. А затем использовать те же параметры для описания свойств твердых тел, сопоставив результаты с экспериментом.
подобрать так, чтобы они позволяли хорошо описывать термодинамические свойства газов. А затем использовать те же параметры для описания свойств твердых тел, сопоставив результаты с экспериментом. (если силы отталкивания
(если силы отталкивания  )
)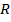 – равновесное состояние между ионами
– равновесное состояние между ионами постоянная Манделунга
постоянная Манделунга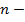 константа, определяемая природой кристалла (справедливость подобного выражения подвергается проверке с помощью термодинамического цикла Габера-Борна)
константа, определяемая природой кристалла (справедливость подобного выражения подвергается проверке с помощью термодинамического цикла Габера-Борна)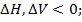
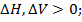
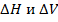 в химических реакциях зависит от того, в каком состоянии находится вещества и продукты реакции.
в химических реакциях зависит от того, в каком состоянии находится вещества и продукты реакции. , т.е. разности энтальпий продуктов реакции, указных в правой части уравнения, в их конечном состоянии Н1-Н данного числа молей реагирующих веществ, указанных слева, в их начальном состоянии. Можно определить только изменение Н, но не их абсолютные значения.
, т.е. разности энтальпий продуктов реакции, указных в правой части уравнения, в их конечном состоянии Н1-Н данного числа молей реагирующих веществ, указанных слева, в их начальном состоянии. Можно определить только изменение Н, но не их абсолютные значения. (Своды+Скалор)
(Своды+Скалор) 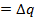 выделившейся.
выделившейся.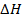 0.
0.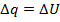 приросту внутренней энергии.
приросту внутренней энергии.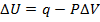
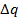 , поглощаемые в обоих экспериментах отличаются.
, поглощаемые в обоих экспериментах отличаются.


