

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Обозначения: А – атомная масса (а.е.м.)
N – число нейтронов в ядре атома
Z – заряд ядра атома = порядковый номер элемента в ПСЭ =
= число протонов в ядре атома (р) = число электронов (е–)
А = N + Z; N = А – Z; Z = А – N.
Обозначение элемента (Э): в ПСЭ – ZАЭ; вне ПСЭ – АZЭ
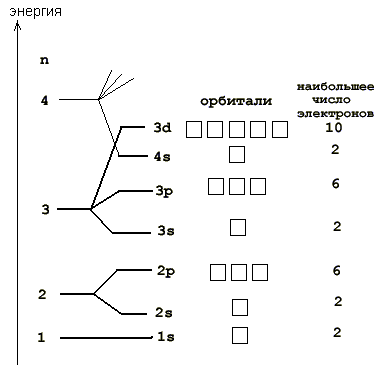
Распределение электронов в атоме по энергетическим уровням и подуровням
| Уровни (n) | Подуровни | Орбитали (n2) | Электроны (2n2) |
| I | 1 (s) | ||
| II | 2 (s, p) | 1 + 3 = 4 | 2 + 6 = 8 |
| III | 3 (s, p, d) | 1 + 3 + 5 = 9 | 2 + 6 + 10 = 18 |
| IV, V, VI, VII | 4 (s, p, d, f) | 1 + 3 + 5 + 7 = 16 | 2 + 6 + 10 + 14 = 32 |
| Энергетический уровень (n) | Энергетический подуровень | Атомная орбиталь | Максимальное число электронов | |||
| Обозначение орбитали | Число орбиталей на энергетич. подуровне | Число орбиталей на энергетич. уровне (n2) | На подуровнях | На уровнях (2n2) | ||
| 1s | ||||||
| 2s 2p | ||||||
| 3s 3p 3d | ||||||
| 4s 4p 4d 4f |
Правила заполнения электронных оболочек:
1. Выясняем, сколько электронов содержит атом элемента. Для этого находим порядковый номер элемента в ПСЭ, который равен числу протонов в ядре, заряду его ядра и количеству электронов.
2. Записываем схему электронного строения атома (распределение электронов по энергетическим уровням). Количество уровней соответствует номеру периода в ПСЭ, к которому принадлежит данный элемент.
3. Записываем электронную формулу элемента (распределение электронов по энергетическим подуровням):1S1, где S – обозначение подуровня, 1 – число электронов.
4. Записываем электронно-графическую формулу элемента (распределение электронов по энергетическим орбиталям).
Последовательное заполнение орбиталей имеющимися электронами следует начать с нижней 1s-орбитали. На каждой орбитали можно располагать не более двух электронов.
|
|
Например:заполнение электронных оболочек элемента с порядковым номером 7.
Это элемент азот, расположенный во втором периоде. Значит, в его атоме два энергетических уровня. В его атоме 7 электронов.
Схема электронного строения атома: 147N))
2 5
Распределение электронов по энергетическим уровням (см. табл. на с. 9):
· на первом (ближнем к ядру) уровне – 2 электрона,
· на втором (дальнем от ядра) уровне – 5 электронов.
Электронная формула элемента: 147N 1s2 2s2 2р3, т.е. заполнение орбиталей,
начиная с нижней 1s-орбитали следующее:
· 2 электрона расположены на 1s-орбитали,
· 2 электрона – на 2s-орбитали,
· оставшиеся 3 электрона – на трех 2p-орбиталях.
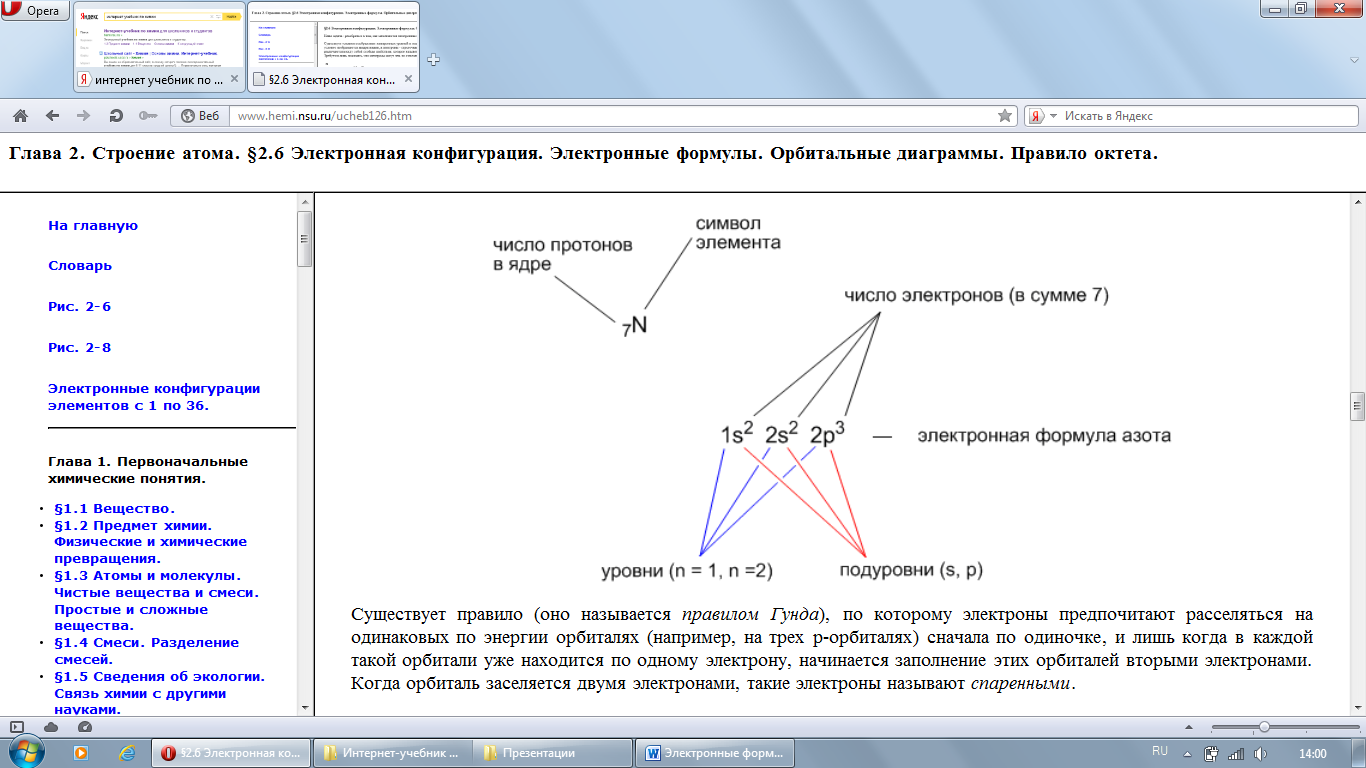
Электронно-графическая формула элемента: 2S2 ↑↓ 2p3 ↑ ↑ ↑
147N 1S2 ↑↓

Электроны заполняют все орбитали сначала по одному, и только после этого –
спариваются (правило Хунда).
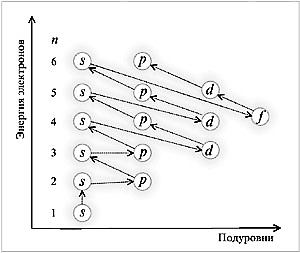
Для атомов c небольшим числом электронов порядок заполнения уровней и подуровней вполне логичный: 1s, 2s, 2p, 3s, 3p, 3d, 4s …
С увеличением числа электронов в атоме подуровень 4s начинает заполняться раньше, чем 3d. А на более высоких уровнях такие «нарушения» становятся правилом:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d,...
Решение типовых задач:
VI. Строение атома
(распределение электронов по энергетическим уровням, подуровням и орбиталям)
VI.1. Определите строение атомного ядра, напишите электронно-графическую формулу (распределение электронов по энергетическим уровням, подуровням и орбиталям) для элемента с порядковым номером 15 в ПСЭ.
Дано: Элемент с порядковым № 15 в ПСЭ
Найти: Строение атомного ядра; электронно-графическая формула.
Решение: Порядковый номер 15 в ПСЭ имеет элемент фосфор. Химический знак – Р.
Его номер соответствует:
· количеству положительно заряженных элементарных частиц в ядре атома (протонов);
|
|
· количеству отрицательно заряженных электронов, вращающихся вокруг ядра.
Атомная масса наиболее распространенного изотопа фосфора – А = 31 а.е.м. 3115Р
Число нейтронов (N) в ядре этого изотопа рассчитывают как разность между атомной массой (А) и порядковым номером (т.е. зарядом ядра Z): N = А – Z = 31 – 15 = 16.
Строение атомного ядра фосфора:Р (15p + 16N).
Фосфор – элемент III периода, т.е. его электроны располагаются на трех энергетических уровнях. Схема электронного строения атома: 3115Р)))
2 8 5
· на первом (ближнем к ядру) – 2, как у инертного газа гелия (1s2);
· на втором – 8, как у инертного газа неона (2s22р6);
· на третьем (дальнем от ядра) – 5 электронов (3s2 3р3) – незавершенный электронный слой
Электронная формула фосфора имеет следующий вид: 3115Р 1s2 2s2 2р6 3s2 3р3
1s2 2s2 2р6 3s2 3р3
Как у гелия Как у неона
В основном (невозбужденном) состоянии атома фосфора его электронно-графическая формула имеет следующий вид: 3S2 ↑↓ 3p3 ↑ ↑ ↑
2S2 ↑↓ 2p6 ↑↓ ↑↓ ↑↓
3115Р 1S2 ↑↓

VII. Строение атома (определение элемента по внешнему энергетическому уровню)
VII.1. Распределение электронов на внешнем энергетическом уровне элемента можно представить формулой 3s23р4. Составьте его электронно-графическую формулу, определите строение атомного ядра. Назовите этот элемент.
Дано: Распределение электронов на внешнем энергетическом уровне: 3s23р4
Найти: Строение атомного ядра;
электронно-графическая формула,
название элемента.
Решение: Формула внешнего электронного слоя принадлежит элементу III периода.
У элементов III периода электроны расположены на 3 энергетических уровнях:
· на первом (ближнем к ядру) – 2, как у инертного газа гелия (1s2);
· на втором – 8, как у инертного газа неона (2s22р6);
· на третьем (дальнем от ядра) – по условию задачи 6 электронов (3s23р4).
Схема электронного строения атома элемента: Э)))
2 8 6
Электронная формула имеет вид: 1s2 2s2 2р6 3s2 3р4.
В основном (невозбужденном) состоянии атома элемента его электронно-графическая формула имеет следующий вид:
3p4 ↑↓ ↑ ↑
3S2 ↑↓
2p6 ↑↓ ↑↓ ↑↓
2S2 ↑↓
1S2 ↑↓
Всего у этого элемента 16 электронов и 16 протонов в ядре.
Порядковый номер элемента в ПСЭ – 16,
атомная масса самого распространенного изотопа – А = 32 а.е.м.
Число нейтронов (N) в ядре этого изотопа рассчитывают как разность между атомной массой (А) и порядковым номером элемента (т.е. зарядом ядра Z): N = А – Z = 32 – 16 = 16.
|
|
Это сера – 3216S.
Строение атомного ядра серы:S (16p + 16N).
Химическая связь
Теоретические основы:
Способность атома образовывать химические связи – валентность.
Внеорганической химии вместо валентности используют понятие «степень окисления» (СО): условный заряд атома исходя из предположения, что связующие электроны переходят к более электроотрицательным атомам.
Правила определения СО элемента в молекулах или ионах:
• СО атома в молекуле может быть равна нулю или выражена (+) или (–) числом;
• молекула всегда электрически нейтральна, сумма условных (+) и (–) зарядов в ней равна нулю:
Н3 Р О4 (+1)۰ 3+ Х + (–2) ۰ 4 = 0, Х = +5
• в простых веществах СО атомов равна нулю, т.к. электронное облако в равной мере принадлежит обоим атомам (Н2, Cl2, N2);
• СО металлов во всех соединениях (+): щелочные +1, щелочноземельные +2;
• СО водорода в соединениях с неметаллами +1, с щелочными и щелочноземельными металлами –1;
• СО фтора во всех соединениях –1;
• СО кислорода во всех соединениях –2 (исключение: фториды, пероксиды, озониды);
• СО атома в одноатомном ионе равна заряду этого иона (для иона К+ +1, S–2 –2);
• при оценке СО в сложных ионах учитывают заряд иона:
Сr 2О7–2 2 Х + (–2) ۰ 7 = – 2, Х = + 6.
• СО элементов в составе аниона соли такие же, как и в кислоте:
(NH4)2Cr2+6O7 и H2Cr2+6O7;
• В соединениях знак электроположительного элемента на первом месте, а электроотрицательного – на втором (исключение: N–3H+3, C–4H+4).
Maксимальная степень окисления – у элемента, отдавшего все валентные электроны с внешнего уровня (численно равна номеру группы в ПСЭ).
Mинимальная степень окисления – у элемента, который принял все электроны для завершения электронного слоя (для металлов она равна нулю, а для неметаллов – номеру группы минус 8).
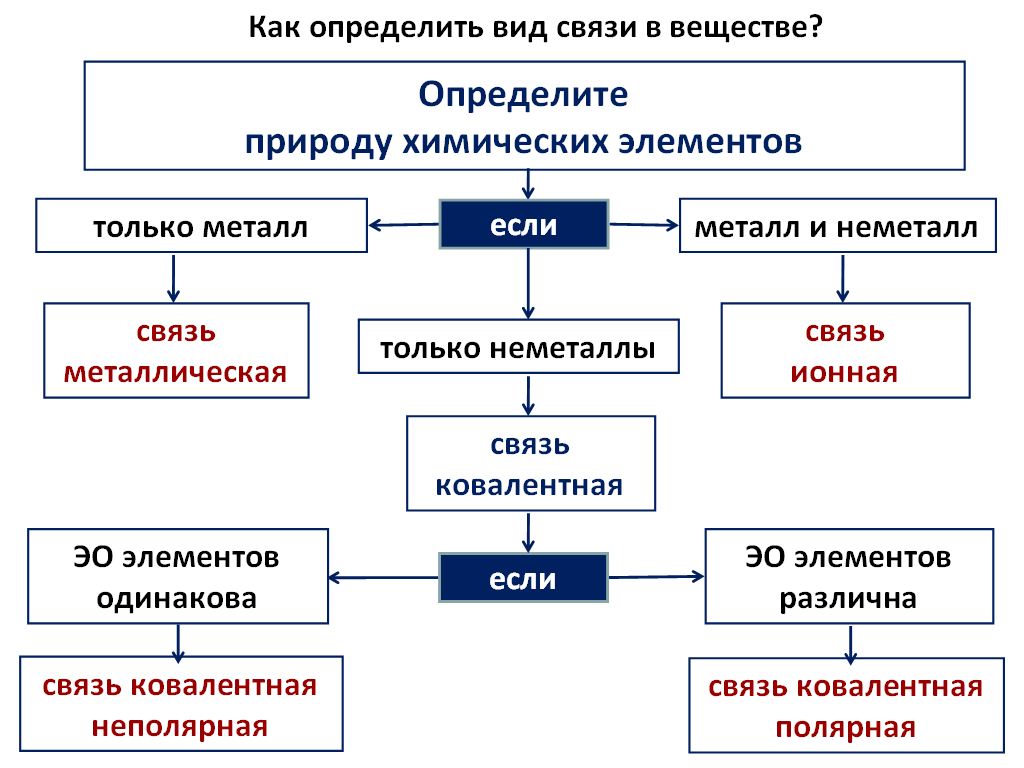
Основные типы химических связей:
· ковалентная (образуется за счет общих электронных пар между атомами);
· ионная (образуется за счет электростатического притяжения ионов);
· металлическая (образуется за счет обобществленных электронов между атомами);
|
|
· водородная (образуется за счет электростатического притяжения
(+) поляризованного атома водорода одной молекулы
и (–) поляризованного атома F, О, N, Сl, S другой молекулы).
 Виды водородной связи: межмолекулярные и внутримолекулярные.
Виды водородной связи: межмолекулярные и внутримолекулярные.
На первый взгляд, в соответствии с приведенной выше схемой, определение типа связи основывается на природе химических элементов, образующих молекулу. На самом деле, этих данных недостаточно для того, чтобы разграничить полярную ковалентную и ионную связь, а также измерить степень полярности ковалентной связи. С этой целью используется такой показатель, как электроотрицательность (X), который измеряется в относительных величинах.
Шкала электроотрицательностей некоторых элементов (по Л. Полингу):
| Элемент | Х | Элемент | Х | |
| Cs | 0,79 | Cu | 1,90 | |
| K | 0,82 | Si | 1,90 | |
| Ba | 0,89 | Ag | 1,93 | |
| Na | 0,93 | B | 2,04 | |
| Li | 0,98 | P | 2,19 | |
| Ca | 1,00 | H | 2,20 | |
| Mg | 1,31 | C | 2,55 | |
| Mn | 1,55 | S | 2,58 | |
| Be | 1,57 | I | 2,66 | |
| Al | 1,61 | Br | 2,96 | |
| Zn | 1,65 | N | 3,04 | |
| Cr | 1,66 | Cl | 3,16 | |
| Fe | 1,83 | O | 3,44 | |
| Co | 1,88 | F | 3,98 |
Разность электроотрицательностей элементов (ΔX) позволяет судить о том, насколько их связь отличается от чисто ковалентной. Для вычисления ΔX из большей электроотрицательности вычитают меньшую.
При ΔX = 0 связь ковалентная неполярная:
· связь F– F в молекуле фтора F2: ΔX = (3,98 – 3,98) = 0;
· связь O=O в молекуле кислорода O2: ΔX = (3,44 – 3,44) = 0.
При 0 < ΔX < 0,4 связь условно ковалентная.
При ΔX от 0,4 до 2,0 связь ковалентная полярная:
· связь H–F в молекуле фтороводорода HF: ΔX = (3,98 – 2,20) = 1,78;
· связь C–Cl в молекуле CСl4: ΔX = (3,16 – 2,55) = 0,61;
· связь S=O в молекуле SO2: ΔX = (3,44 – 2,58) = 0,86.
При ΔX > 2,0 связь ионная:
· связь Na–Cl в соединении NaCl: ΔX = (3,16 – 0,93) = 2,23;
· связь Na–F в соединении NaF: ΔX = (3,98 – 0,93) = 3,05;
· связь K–O в соединении K2O: ΔX = (3,44 – 0,82) = 2,62.
Решение типовых задач:
VIII. Определение степени окисления атомов в молекулах.
VIII. 1. Определите степени окисления атомов в молекулах: Cl2, NН3, НNО3, KCl, KClО3, НЗРО4. Ответ поясните.
Дано: Cl2, NН3, НNО3, KCl, KClО3, НЗРО4
Найти: Степени окисления атомов в данных молекулах.
Решение:
В соответствии с правилами определения степени окисления элемента в молекулах или ионах (см. теоретические основы):
· В молекуле Cl2 СО хлора равна нулю, т.к. Cl2 – простое вещество.
· В молекуле NН3 СО водорода в соединении с неметаллом азотом равна + 1;
в составе молекулы аммиака NН3 три атома водорода, их суммарная СО равна + 3,
при электронейтральности молекулы аммиака СО азота равна – 3:
Х + (+1) × 3 = 0; Х = – 3.
· В молекуле азотной кислоты НNО3 СО водорода + 1, кислорода –2.
В электронейтральной молекуле азотной кислоты СО азота равна:
(+1) + Х + (–2) × 3 = 0 Х = + 5.
· В молекуле КСl щелочной металл калий имеет СО +1, а неметалл хлор: (+1) + Х = 0; Х = – 1.
|
|
· В молекуле бертолетовой соли КСlO3 калий имеет СО + 1, кислород –2.
Следовательно, хлор имеет СО, равную: (+1) + Х + (–2) × 3 = 0; Х = +5.
· В молекуле ортофосфорной кислоты НЗРО4 водород имеет СО +1, кислород –2,
следовательно СО фосфора равна: (+1) × 3 + Х + (–2) × 4 = 0; Х = +5.
Ответ: Cl02; N–3Н03; Н+1N+5О–23; K+1Cl–1; K+1Cl+5О–23; Н+1ЗР+5О–24
IX. Типы химических связей
IX. 1. Определите тип связей в молекулах: LiF, ВеО, СО2, NO, F2. Ответ подтвердите расчетом разности электроотрицательности элементов (ΔХ).
Дано: LiF, ВеО, СО2, NO, F2.
Найти: ΔХ элементов и тип связей в данных молекулах.
Решение:
· в молекуле LiF связь атомов лития и фтора ионная:
Х(Li) = 0,98; Х(F) = 3,98; ΔХ = Х(F) – Х(Li) = 3,98 – 0,98 = 3,0;
поскольку ΔХ > 2,0, связь ионная.
· в молекуле ВеО связь атомов бериллия и кислорода ковалентная полярная:
Х(Ве) = 1,57; Х(О) = 3,44; ΔХ = Х(О) – Х(Ве) = 3,44 – 1,57 = 1,87;
поскольку 0,4 < ΔХ < 2,0, связь ковалентная полярная.
· в молекуле СО2 связь атомов углерода и кислорода
Х(С) = 2,55; Х(О) = 3,44; ΔХ = Х(О) – Х(С) = 3,44 – 2,55 = 0,89;
поскольку 0,4 < ΔХ < 2,0, связь ковалентная полярная.
· в молекуле F2 связь атомов фтора друг с другом ковалентная неполярная:
Х(F) = 3,98; ΔХ = Х(F) – Х(F) = 3,98 – 3,98 = 0;
поскольку ΔХ = 0 связь ковалентная неполярная.
Ответ: Тип связи: в молекуле LiF ионная;
в молекулах ВеО и СО2 – ковалентная полярная;
в молекуле F2 – ковалентная неполярная.
Раздел 2 Химические системы
2.1 Растворы
Теоретические основы:
Концентрация – количество растворенного вещества
в определенном объеме или массе раствора или растворителя.
1. Массовая концентрация – отношение массы растворенного вещества (т)
к объему раствора (V).
Измеряется в г/л, г/мл, кг/м3:
2. Массовая доля – отношение массы растворенного вещества (m1)
к общей массе раствора (т2).
Измеряется в долях единицы:
или в процентах (процентная концентрация):
3. Молярная концентрация – число молей растворенного вещества (n)
в 1 литре (1 дм3) раствора (V).
Измеряется в моль/л:
4. Нормальная (эквивалентная) концентрация – количество эквивалентов
растворенного вещества
в 1 л раствора:
nэкв
С = –––––
V
nэкв – количество эквивалентов; V – объём раствора, л.
молекулярный вес соединения
Эквивалент соединения = –––––––––––––––––––––––––––––––––––––
число связей между катионом и анионом
Число связей:
· для кислот = их основность = число атомов водорода (H2SO4 – 2).
· для оснований = их кислотность = число гидроксогрупп (Fe(OH)3 – 3).
· для солей = произведение валентности (степени окисления) металла
и числа его атомов в молекуле соли
(NaNO3 – 1, Al2(SO4)3 – 6).
Например:
mэкв кислоты = Мкислоты/основность кислоты;
mэкв(H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв основания = Моснования/кислотность основания;
mэкв(Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв соли = М соли/(число атомов металла × степень окисления металла)
mэкв(Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;
mэкв оксида = М оксида/(число атомов кислорода × 2);
mэкв(Fe2O3) = М(Fe2O3)/(3·2) = 160/6 = 26,7 г/моль.
Решение типовых задач:
Х. Концентрация растворов.
Х.1. Рассчитайте массовую концентрацию раствора, если в 0,5 л этого раствора содержится 5 г растворенного вещества.
Дано: m = 5 г, V = 0,5 л
Найти: С
Решение: Массовая концентрация (С) – отношение массы растворенного вещества (m)
к объему раствора (V):
m
С = ------, следовательно, С = 5 г/0,5 л = 10 г/л.
V
Ответ: С = 10 г/л.
Х.2. Определите, сколько граммов растворенного вещества и растворителя необходимо для приготовления 250 г 8-%-го раствора.
Дано: m раствора = 250 г; С = 8%
Найти: m растворенного вещества; m растворителя.
Решение:
Процентная концентрация (С) – отношение массы растворенного вещества (m1)
к общей массе раствора (m2):
m1
С = ------ × 100%
m2
Преобразуем формулу процентной концентрации для расчета массы растворенного вещества:
С × m2 8% × 250 г 2000 г %
m1 = -------- = ------------------- = ---------------- = 20 г
100% 100% 100%
Определим массу растворителя (m3), вычитая массу растворенного вещества из общей массы раствора: m3 = m2 – m1 = 250 г – 20 г = 230 г
Ответ: m растворенного вещества = 20 г; m растворителя = 230 г.
Х.3. Определите молярную концентрацию раствора хлорида кальция, содержащего 44,4 г растворенного вещества в 800 мл раствора.
Дано: m растворенного вещества = 44,4 г; m раствора = 800 мл.
Найти: С
Решение: Молярная концентрация – число молей растворенного вещества
в 1 л раствора: С = n/V.
Объем раствора известен по условию задачи. Необходимо определить число молей растворенного вещества. Для этого рассчитаем относительную молекулярную массу CaCl2:
Мr(CaCl2) = Аr(Ca) + 2Аr(Cl) = 40 + 35,5×2 =111. Отсюда М(CaCl2) =111 г/моль
Определим число молей (n), содержащихся в 44,4 г CaCl2 (m):
m
n = ------- = 44,4 г: 111 г/моль = 0,4 моль
М
Рассчитываем молярную концентрацию (С) по формуле: С = n/V, где V = 800 мл = 0,8 л
по условию задачи: С = 0,4 моль/0,8 = 0,5 моль/л
Ответ: С = 0,5 моль/л
Х.4. Определите, сколько граммов серной кислоты содержится в 1500 мл 0,2 М раствора.
Дано: V раствора = 1500 мл; С = 0,2 М.
Найти: m H2SO4
Решение: m = n × М
Необходимо найти количество H2SO4 в молях и молярную массу H2SO4.
Молярная концентрация – число молей растворенного вещества в 1 л раствора,
т.е. в 1 л 1 М раствора содержится 1 моль растворенного вещества.
Следовательно, в 1 л 0,2 М раствора содержится 0,2 моль вещества,
а в 1500 мл = 1,5 л такого раствора – n моль вещества.
Отсюда n = 0,2 × 1,5 = 0,3 моль H2SO4.
Рассчитаем молекулярную массу H2SO4: Мr(H2SO4) = 2Аr(H) + Аr(S) + 4Аr(O) = 2 + 32 + 64 = 98
Молярная масса серной кислоты (М) численно равна её молекулярной массе (Мr):
М (H2SO4) = 98 г/моль.
Определяем массу (m) 0,3 моль H2SO4: m = n × М = 98 г/моль × 0,3 моль = 29,4 г
Ответ: m H2SO4 = 29,4 г
Х.5. Определите нормальную (эквивалентную) концентрацию раствора сульфата натрия, содержащего 2,13 г растворенного вещества в 300 мл раствора.
Дано: m растворенного вещества = 2,13 г; m раствора = 300 мл.
Найти: С
Решение: С = nЭ : V
Нормальная концентрация – количество эквивалентов растворенного вещества,
которое содержится в 1 л раствора.
Сульфат натрия – это соль. Эквивалентная масса соли рассчитывается по формуле:
mэквсоли= М соли/(число атомов металла × степень окисления металла).
Следовательно: Э(Na2SO4) = М (Na2SO4) / число атомов Na × степень окисления Na.
Э(Na2SO4) = М: 2 = Мr : 2 = (2 Аr(Na) + Аr(S) + 4 Аr(O)): 2 =
= (46 +32 + 64): 2 = 142: 2 = 71 г/экв.
Узнаем, сколько эквивалентов (nЭ) содержится в массе m растворенного вещества.
По условию m = 2,13 г; nЭ = m: Э = 2,13 г: 71 г/экв. = 0,03 экв.
Определяем нормальную концентрацию (С) как отношение числа эквивалентов (nЭ) растворенного вещества к объему раствора (по условию V = 300 мл = 0,3 л):
С = nЭ : V = 0,03 экв.: 0,3 л = 0,1 экв./л
Ответ: С = 0,1 экв./л.
Водородный показатель рН
Теоретические основы
Электролиты – вещества, которые в водных растворах проводят электрический ток
(растворимые кислоты, основания, соли)
Степень диссоциации (α): показывает, какая часть растворенных молекул электролита распалась на ионы:
N1
α = ––––
N
N – общее число растворенных молекул;
N1 – число растворенных молекул, распавшихся на ионы.
По степени диссоциации выделяют электролиты:
· сильные α ≥ 30% кислоты: HNO3, H2SO4, HCl, HBr, HI, HClO3, HClO4;
щелочи: KOH, NaOH, Ba(OH)2, Ca(OH)2;
все растворимые соли;
· средние α = 3-30% кислоты: H2SO3, H3PO3, H3PO4, HF;
· слабые α < 3% кислоты: H2S, H2CO3, H2SiO3, H3BO3, CH3COOH;
NH4OH, основания: нерастворимые, амфотерные:
Mg(OH)2, Be(OH)2;
вода: Н2О.
Вода относится к слабым электролитам, из 55 млн. молекул воды распадается на ионы всего 1: Н2О ↔ Н+ + ОН– Т.е. С Н+ = С ОН– = 10–7 моль/л.
Ионное произведение воды (КН2О) при 22°: КН2О = С Н+ × С ОН– = 10–14 моль2/л2
Добавление кислот ведет к увеличению концентрации ионов Н+
и снижению концентрации ионов ОН–.
Добавление оснований приводит к повышению концентрация ионов ОН–
и снижению концентрации ионов Н+.
Реакция среды по соотношению концентраций свободных Н+ и ОН– ионов:
· нейтральная – Сн+ = Сон_ = √10–14 = 10–7 моль/л (в чистой воде)
· кислая – Сн+ > Сон_
· щелочная – Сн+< Сон_
Водородный показательpH = – lgCH+ десятичный логарифм концентрации
водородных ионов с обратным знаком,
который характеризует реакцию среды:
| Конц. ионов, моль/л | Водородный показатель (рН) | ||||||||||||||
| 5 | |||||||||||||||
| Сильнокислая среда | Слабокислая среда | Нейтр. среда | Слабощелочная среда | Сильнощелочная среда | |||||||||||
| С Н+ | 10 0 | 10–1 | 10–2 | 10–3 | 10–4 | 10–5 | 10–6 | 10–7 | 10–8 | 10–9 | 10–10 | 10–11 | 10–12 | 10–13 | 10–14 |
| С ОН– | 10–14 | 10–13 | 10–12 | 10–11 | 10–10 | 10–9 | 10–8 | 10–7 | 10–6 | 10–5 | 10–4 | 10–3 | 10–2 | 10–1 | 10 0 |
Решение типовых задач:
ХI. Водородный показатель рН
ХI.1. Чему равна концентрация водородных и гидроксид-ионов в растворе, если его водородный показатель рН равен 6. Какова реакция среды этого раствора?
Дано: рН = 6
Найти: СН+; СОН–; реакция среды.
Решение: Если рН = 6, то СН+ = 10–6 моль/л.
Концентрацию гидроксид-ионов (СОН–) можно рассчитать,
разделив ионное произведение воды (КН2О) на концентрацию водородных ионов (СН+):
КН2О 10–14 моль2/л2
СОН–= ----------- = ---------------------- = 10–8 моль/л.
СН+ 10–6 моль/л
В данном случае СН+ > СОН–.
Концентрация Н+-ионов превышает концентрацию ОН–-ионов в 100 раз:
СН+ 10–6
------ = ------- = 100
СОН– 10–8
Для определения реакции среды этого раствора следует сравнить значение рН = 6 с табличными величинами (см. табл. на с. 19): 4 < 6 < 7.
Следовательно, раствор имеет слабокислую реакцию.
Ответ: СН+ = 10–6 моль/л, СОН–= 10–8 моль/л. Реакция раствора слабокислая.
ХI.2. Определите концентрацию водородных и гидроксид-ионов, значение рН и реакцию среды в сантимолярном (0,01 моль/л) растворе соляной кислоты.
Дано: СНСl = 0,01 моль/л
Найти: СН+; СОН–; рН раствора.
Решение: НСl – это сильная кислота.
В растворах сильных кислот молярная концентрация ионов водорода совпадает с молярной концентрацией кислоты
(как и концентрация гидроксид-ионов в растворах сильных оснований).
Поэтому в 0,01 М растворе НСl концентрация водородных ионов (СН+) равна 0,01 моль/л = 10–2 моль/л, следовательно, рН = – lg СН+= – lg 10–2 = 2.
Концентрацию гидроксид-ионов (СОН–) можно рассчитать, разделив ионное произведение воды (КН2О) на концентрацию водородных ионов (СН+):
КН2О 10–14 моль2/л2
СОН–= ----------- = ---------------------- = 10–12 моль/л
СН+ 10–2 моль/л
В данном случае СН+ > СОН– в 10 млрд. раз:
СН+ 10–2
------ = ------- = 1010
СОН– 10–12
Для определения реакции среды этого раствора следует сравнить значение рН = 2 с табличными величинами (см. табл. на с. 19): 0 < 2 < 3.
Следовательно, раствор имеет сильнокислую реакцию.
Ответ: СН+ = 10–2 моль/л; СОН– = 10–12 моль/л; рН = 2. Реакция раствора сильнокислая.
|
|
|

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!