Лихорадочное состояние; острые воспалительные процессы; склонность к кровотечениям; системные заболевания крови; активный туберкулез легких; тяжелое течение ишемической болезни сердца с частыми приступами стенокардии, стенокардия покоя, сердечная астма; аневризма сердца и сосудов; частые пароксизмальные нарушения ритма сердечной деятельности; недостаточность кровообращения выше II стадии; злокачественные новообразования; наличие в тканях, подлежащих воздействию, металлических инородных тел; беременность.
Аппаратура для ДМВ
Для контактного воздействия на небольшие участки тела пользуются аппаратом «Ранет» мощностью до 20 Вт с двумя плоскими излучателями диаметром 40 и 100 мм и стержневыми вагинальными излучателями. Аппарат мощностью 100 Вт «Волна-2» комплектуется двумя дистанционными излучателями: размером 15, 35 см и цилиндрическим диаметром 15 см, которые устанавливают на расстоянии 4-5 см от поверхности тела. Продолжительность процедур ДМВ-терапии составляет от 6 до 15 мин, а при нескольких локализациях - до 30 мин.
Техника безопасности. Для защиты глаз больного при проведении процедур по дистанционной методике применяют защитные очки ОРЗ-5. Для защиты персонала от действия рассеянного СВЧ-излучения при использовании дистанционных методик терапии аппараты «Луч-58», «Луч-11», «Волна-2» должны эксплуатироваться в отдельных закрытых помещениях или в общем физиотерапевтическом кабинете, но с обязательным экранированием кабин защитной тканью с микропроводом.
Дидактический блок к СРС
ПЕРВИЧНЫЕ ФОТОХИМИЧЕСКИЕ РЕАКЦИИ БЕЛКОВ.
В настоящее время доказано, что основной первичной фото-реакции триптофана (АН) в белке является его фотоионозация с образованием катион-радикала и сольватированого электрона:
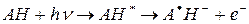 [1]
[1]
При комнатной температуре эта реакция протекает за 5-20 мкс и исследована с использованием метода флеш-фотолиза. Показано, что через 5 мкс после Уф облучения в растворе триптофана появляются характерные спектры поглощения в красной и дальней красной области спектра, которые принадлежат выбитому сольватированному электрону, т.е. электрону, «выбитому» из молекулы аминокислоты и захваченному дипольными молекулами растворителями. Сольватированный электрон быстро реагирует с другими молекулами, в частности, с молекулами растворителя и, вследствие чего полоса его поглощения исчезает. Однако, если облучать замороженные образцы триптофана при температуре жидкого азота (в этих условиях сольватированные электроны не рекомбинируют), то поглощение сольватированого электрона (максимум при 600 нм) можно зарегистрировать и на обычном спектрофотометре. Кроме того, наличие некомпенсированного магнитного момента (спин) у сольватированного электрона позволяет обнаружить его методом ЭПР.
ФОТОХИМИЧЕСКИЕ ПРЕВРАЩЕНИЕ ДНК.
Согласно общепринятому мнению, ДНК основная внутриклеточная мишень при летальном и мутагенном действии коротковолнового УФ излучения. Это в частности, подтверждается совпадением максимума в спектрах действия фотобиологических эффектов (260-265 нм) с максимумом в спектре поглощения ДНК. Основными хромофорами ДНК являются азотистые основания нуклеотидов, причем квантовые выходы фотопревращений пирими-диновых компонентов примерно на порядок выше, чем пуриновых. Поглощение азотистыми основаниями квантов Уф света (максимум поглощения при 260 нм) приводит к образованию их электронно-возбужденных синглетных и триплетных состояний, которые возникают за счет p–p*-переходов. Электронно-возбужденные состояния пиримидиновых оснований могут вступать в ряд фотохимических реакций, из которых, биологически наиболее важны три реакции присоединения: димеризация, гидратация и образования сшивок с белком.
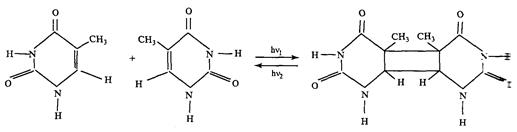
Реакция фотодимеризации.
Эта реакция впервые была обнаружена при Уф облучении замороженных растворов тимина. Она состоит в соединении двух оснований по 5,6-двойной углеродной связи с образованием кольца циклобутанового типа:
Характерная черта реакции димеризации ее обратимость. Пиримидиновые основания поглощают свет в области 200-300 нм, их димеры примерно в том же диапазоне УФ-спектра (200-285 нм).Поэтому при Уф облучении оснований или ДНК для каждой длины волны возбуждающего света между димерами и основаниями устанавливается динамическое равновесие, определяемое соотношением поперечных сечений димеризации оснований и мономеризации димеров. Так, в случае облучения тимина при 200 нм димеризуется около 65% оснований, а при 280-15%.
Вследствие бимолекулярного характера реакций фотодимеризации ее квантовый выход существенно зависит от степени взаимоориентации мономеров при возбуждении одного из них. Например, квантовый выход димеризации тимина в водном растворе при комнатной температуре - 4,7×10-4, а в замороженном - 1. Квантовый выход димеризации тимина в ДНК - 2×10-2. В соответствии с проведенными расчетами условия для димеризации тимина в ДНК являются оптимальными, если соседние мономеры ориентированы друг к другу под углом в 36.
Некоторые красители акридинового ряда могут эффективно уменьшать выход УФ- индуцированных димеров в ДНК. Защитное свойство акридинов основано на их способности интеркалировать между парами оснований в молекуле ДНК. Характерная черта взаимодействия акридинов (например акридиновый оранжевый) с ДНК заключается в том, что при образовании комплекса резко увеличивается интенсивность флуоресценции красителя в максимуме спектра при 530 нм. По мнению некоторых авторов, это может быть обусловлено синглет-синглетной миграцией энергии возбуждения с оснований на краситель. Расчеты показывают, что максимальный квантовый выход такой миграции энергии достигается при соотношении 1 молекула красителя / 5 оснований и составляет 32%.
Помимо увеличения интенсивности флуоресценции тестом на связывание акридинов с ДНК может служить так же изменение степени поляризации люминесценции, зависящей от подвижности молекул красителей. С помощью этого метода показано, в частности, что плоскость кольца акридинового оранжевого перпендикулярна длинной оси спирали ДНК и параллельна плоскостям оснований.
Реакция фотогидратации.
Этот процесс - вторая важная фотохимическая реакция пиримидиновых оснований ДНК, которая заключается в присоединении воды к пиримиддиновым основаниям ДНК, которая заключается в присоединении воды к пиримидиновому кольцу у С 5(Н) и С6(ОН) углеродных атомов с разрывом двойной связи между ними и образованием 6-окси-5-гидропроизводных оснований.
| |
| | 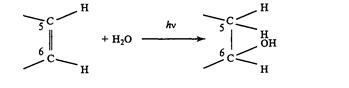 |
В отличие от димеризации реакция гидратации не является фотообратимой. Однако гидраты могут разрушаться при повышении температуры (>30 50 0С) и ионной силы раствора, а так же при сдвигах рН. Скорость фотогидратации уменьшается при замене Н2О на Д2О. Предшественниками гидратов пиримидинов являются видимо, их синглетные возбужденные состояния. В пользу этого свидетельствуют следующие данные: триплетные тушители не влияют на фотогидратацию, квантовый выход реакции не зависит от длины Уф света, хотя вероятность конверсии в триплетное состояние зависит от нее, избирательное фотосенсибилизированное заселение триплетных уровней оснований не приводит к их гидратации. Особенность реакции фотогидратации заключается в том, что она протекает только в одно-цепочной ДНК. Поэтому гидраты пиримидинов могут вносить вклад в летальный или мутагенный эффект лишь у клеток с активным процессом репликации и транскрипции, в ходе которых появляются короткие одно-цепочные участки ДНК.
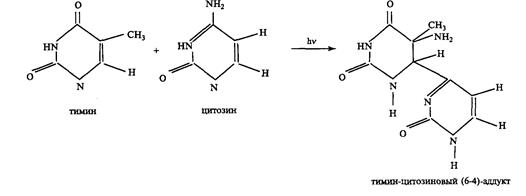
Образование (6-4) пиримидиновых аддуктов.
Эти фотопродукты, характеризующиеся абсорбцией при 315-320 нм и флуоресценцией в области 405-440 нм, были выделены из кислотного гидролизата УФ-облученной ДНК. Структура аддуктов была установлена с помощью УФ-, ИК-, ЯМР-спектроскопии и масс-спектрометрии, Квантовый выход (6-4)-аддуктов порядка 10~3, т. е. в ~ 10 раз меньше, чем цикло-бутановых димеров, и следовательно, в летальный эффект УФ-излучения (254 нм) они вносят незначительный вклад. Однако в УФ-мутагенезе они могут играть важную роль. В отличие от летальных повреждений ДНК, мутационные дефекты возникают намного реже, и поэтому для них требование максимального квантового выхода не имеет принципиального значения. Полагают, что реакция образования (6-4) пиримидиновых аддуктов идет по схеме:
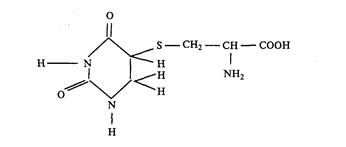
Сшивки с белком.
Это пример межмолекулярных взаимодействий, относящихся к третьему типу фотохимических реакций, в которые вступают Пиримидиновые основания ДНК. Акцепторами Уф света являются оба компонента, поскольку облучение как белка, так и ДНК перед сшиванием сопровождается образованием сшивок. Механизм данного процесса, вероятно, заключается в прикреплении аминокислотных остатков белка через SН- или ОН- группы к С5 или С6 цитозина или тимина ДНК. В модельной системе наблюдали образование по такому механизму 5-S-цистеин-6-гидроурацила.
Рассмотренные выше фотохимические реакции ДНК протекают с участием низших возбужденных (синглетных и триплетных) состояний пиримидиновых оснований, которые возникают в результате поглощения одного кванта Уф света.



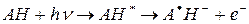 [1]
[1]