

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
Состояние электрона в многоэлектронных атомах всегда отвечает закону, сформулированному Паули: в атоме не может быть даже двух электронов, обладающих одинаковым набором всех четырех квантовых чисел. Это говорит о том, что на атомной орбитале может находится не более двух электронов.
Электронная оболочка имеет упорядоченное строение. Она состоит из электронных уровней (слоев), число которых равно номеру периода. В соответствии с принципом Паули максимальное число электронов на энергетическом уровне равно 2n2.
Каждый уровень, кроме первого, делится на подуровни. Число подуровней равно номеру уровня, максимальное число электронов на подуровне-2(2l +1).
Чем выше расположен уровень, тем больше энергия его электронов.
Наименьшей энергией обладают электроны первого уровня а наибольшей -внешнего уровня. Наиболее устойчиво состояние атома, в котором электроны имеют наименьшую энергию.
Заполнение электронной оболочки происходит в соответствии с тремя правилами:
1. Заполнение электронной оболочки происходит в порядке возрастания энергии уровней (принцип наименьших энергий).
2. Заполнение подуровней происходит в соответствии с правилом Клечковского:
- электроны заполняют тот подуровень для которого сумма значений главного и орбитального квантовых числе наименьшая;
- если сумма значений главного и орбитального квантовых чисел одинакова, то электроны заполняют тот подуровень для которого меньше значение главного квантового числа.
Отсюда следует следующий порядок заполнения уровней и подуровней: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
3. Порядок заполнения атомных орбиталей происходит в соответствии с правилом Хунда: электроны заполняют атомные орбитали таким образом чтобы спин был максимальным.
Например:
+15 Р 1s2 2s2 2p6 3s2 3p3
+25 Mn 1s2 2s2 2p6 3s2 3p3 3d5 4s2
Приведённые формулы называются полными электронными формулами элемента. В зависимости от того электроны какого подуровня заполняются у данного элемента, они делятся на s-,p-,d-, f- элементы.
К s-элементам относятся элементы главных подгрупп первой и второй групп, р-элементы - это элементы главных подгрупп всех остальных групп. К d-элементам относятся элементы побочных подгрупп, а к f-элементам - лантаноиды и актиноиды.
Обычно используют сокращённые электронные формулы, содержащие только электроны валентного уровня, число которых равно номеру группы. (для элементов главных подгрупп валентными являются электроны последнего энергетического уровня, для элементов побочных подгрупп последнего s и предпоследнего d).
Эти формулы используют для определения валентных возможностей атома. Их легко составить, зная период и группу атома. Например, бром-это элемент четвертого периода седьмой группы главной подгруппы, поэтому его сокращенная электронная формула: +35Вr...4s2 4p 5; ванадий элемент четвертого периода пятой группы побочной подгрупп: +23V …3d3 4s2
2. Электронно-графические формулы
Эти схемы используют для определения валентных возможностей
атома. Уровни и подуровни должны располагаться в соответствии с их энергией: чем выше подуровень, тем выше его располагают. Орбитали изоб-ражают квадратиком или черточкой.


 Например: Е 3d
Например: Е 3d





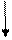
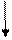 17Cl...3s2 3p5
17Cl...3s2 3p5






 3p
3p
3s

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!