Влияние концентраций реагирующих веществ на скорость реакции выражается основным законом химической кинетики или законом действующих масс:
Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам, стоящим перед формулами этих веществ в уравнении реакции.
Так, для реакции, протекающей по уравнению:
aA + bB = cC + dD,
скорости прямой и обратной реакций определяются выражениями:


где k1 и k2 – константы скоростей прямой и обратной реакций.
Необходимо отметить, что данное определение справедливо только для простых реакций, т.е., для реакций, в которых порядок реакции совпадает со стехиометрическими коэффициентами уравнения реакции и может быть равен молекулярности.
Уравнения, выражающие зависимость скорости химических реакций от концентраций реагентов, называют кинетическими.
Коэффициент пропорциональности k называют константой скорости химической реакции.
Величина k зависит от природы реагирующих веществ, температуры, наличия катализатора и не зависит от концентрации реагирующих веществ. Физический смысл константы скорости реакции заключается в следующем: она равна скорости реакции в случае, если концентрации всех реагирующих веществ равны и составляют 1 моль/л.
Например:
H2(газ) + I2(газ) ⇄ 2HI(газ)
 ;
;
 .
.
Если система гетерогенна, то концентрация твердой фазы в кинетическом уравнении учитывается в значении константы скорости (т.е., в явном виде в уравнении не присутствует):
S(тв) + O2(газ) ⇄ SO2(газ)
 ;
;
 .
.
Б. Зависимость скорости реакции от температуры.
При повышении температуры скорость реакции, как правило, увеличивается. Эта закономерность может быть выражена уравнением:

| (5)
|
где 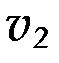 и
и 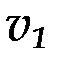 - скорости реакций при температурах
- скорости реакций при температурах  и
и  ;
;
γ - температурный коэффициент скорости реакции (температурный коэффициент Вант-Гоффа), который показывает во сколько раз возрастает скорость данной реакции при повышении температуры на 100.
Для большинства реакций g = 2-4. В таких случаях выполняется правило Вант-Гоффа:
При повышении температуры на каждые 100 скорость химической реакции возрастает в 2-4 раза.
Для ферментативных процессов, протекающих в биосистемах, g больше 4 (обычно около 7).
Основное влияние температура оказывает на константу скорости реакции. Эта зависимость выражается уравнением Аррениуса:
 , ,
| (6)
|
где: k – константа скорости реакции;
А – частотный фактор, отражающий число столкновений между реагирующими молекулами в единице объема в единицу времени;
R – универсальная газовая постоянная (8,31 Дж×моль-1×К-1);
T – температура по Кельвину (273 + t0С);
Ea – энергия активации, кДж/моль.
В. Энергия активации
Важным понятием в химической кинетике является энергия активации:
Энергия активации представляет тот избыток энергии, которым должны обладать молекулы взаимодействующих веществ по отношению к средней энергии молекул.
Химическое взаимодействие, как правило, начинается с разрыва или ослабления связи между атомами в молекулах реагирующих веществ. Этот процесс осуществляется путем столкновения молекул. Однако далеко не все столкновения заканчиваются химической реакцией. Так, в реакции разложения йодоводорода, протекающей при комнатной температуре, эффективным (т.е., приводящим к химической реакции) является лишь одно столкновение из 2×1017 столкновений молекул.
Такое соотношение между числом эффективных столкновений и общим числом столкновений объясняется тем, что в ходе взаимодействия частиц образуется неустойчивое промежуточное состояние, которое называется активированным комплексом. Для создания активированного комплекса молекулам необходимо преодолеть силы межъядерного отталкивания. Для преодоления этих сил молекулам требуется дополнительная энергия, т.е., энергия активации. Неустойчивый активированный комплекс существует очень короткое время и распадается с образованием продуктов реакции и выделением энергии.
Энергия активации зависит от природы реагирующих веществ и в некоторой степени от температуры.
Если энергия активации мала (меньше 40 кДж/моль), скорость реакции велика. Так, ионные реакции в растворах протекают практически мгновенно.
Если энергия активации реакции велика (больше 120 кДж/моль), скорость реакции мала. Например, синтез йодоводорода из I2 и H2 (Еа = 163 кДж/моль) при обычных условиях протекает за астрономический промежуток времени.
Реакции, энергия активации которых находится в пределах от 40 до 120 кДж/моль, протекают за время, которое можно зафиксировать в лабораторных условиях. Так, время протекания реакции разложения тиосульфата натрия серной кислотой, Еа = 86,5 кДж/моль:
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O
составляет несколько минут.
Соотношение констант скоростей при разных температурах определяется уравнением:
 , ,
| (7)
|
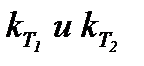 где – константы скорости реакции при температурах T1 и T2;
где – константы скорости реакции при температурах T1 и T2;
R – универсальная газовая постоянная, равная 8,31×10-3 кДж/моль×К;
Ea – энергия активации данной реакции в кДж/моль.
Данное уравнение позволяет рассчитать энергию активации системы.
Пример.
Для прямой элементарной реакции I2 + H2 = 2HI опытным путем определены константы скорости: при 443°С – 0,0067; при 508°С – 0,1059. Определить энергию активации данной реакции.
| T1 = 443 + 273 = 716 K
| T2 = 508 + 273 = 781 K
|


Вывод: скорость реакции очень мала, так как Еа > 120 кДж/моль.





 ;
; .
. ;
; .
.
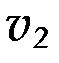 и
и 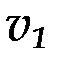 - скорости реакций при температурах
- скорости реакций при температурах  и
и  ;
; ,
,
 ,
,
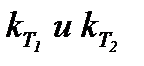 где – константы скорости реакции при температурах T1 и T2;
где – константы скорости реакции при температурах T1 и T2;



