На смещение химического равновесия
Влияние концентрации добавляемого вещества на направление смещения химического равновесия рассматривается для реакции
FеСl3 + 3 NH4CNS ⇄ Fе (CNS)3 + 3NH4Сl.
В результате взаимодействия хлорида железа (III) (FеСl3) и роданида аммония (NH4CNS) образуется комплексное соединение темно-красного цвета – роданид железа [Fе (CNS)3 ]- и бесцветный раствор хлорида аммония. Чем выше концентрация раствора роданида железа, тем меньше пропускная способность для пучка света через этот раствор и меньше величина оптической проницаемости (П, %).
На рис.3 изображен калиброванный график изменения пропускной способности света (проницаемость П, %) в зависимости от концентрации раствора роданида железа (С, моль/л).
Первый эксперимент проводят следующим образом. В кювету приливают 2мл 0,005 М раствора хлорида железа (III) и 2 мл 0,005 М раствора роданида аммония. Определяют по калибровочному графику концентрацию образовавшегося роданида железа (III). Данные записывают в
табл. 2.
| Рис. 3. Калибровочный график изменения проницаемости раствора (П, %)
от концентрации роданида железа (III) С, моль/л
| |
Таблица 2
Направление смещения равновесия при изменении концентрации исходных веществ и продуктов реакции
| Добавляемое вещество
| П,
%
| Концентрация
Fе(CNS)3, моль/л
| Смещение
химич.
равновесия
|
| 1. Без добавления исходных веществ и продуктов реакции
|
|
|
|
| 2. Добавляют исходное вещество 1,0 М раствор FеСl3
|
|
|
|
| 3. Добавляют исходное вещество1,0 М раствор NH4CNS
|
|
|
|
| 4. Добавляют продукт реакции (кристалич.) NH4Сl
|
|
|
|
Второй эксперимент заключается в приливании в кювету 1 мл 0,005 М раствора хлорида железа (III), 1 мл 0,005 М раствора роданида аммония и добавлении 2 мл 1 М раствора FeCl3; данные записываются в табл. 2.
Третий эксперимент. В кювету приливают 1 мл 0,05 М раствора FeCl3 и 1 мл 0,05 М раствора NH4CNS, затем добавляют в эту же кювету 2мл 1 М NH4CNS. Данные записывают в табл.2.
Четвертый эксперимент заключается в приливании в кювету по 1 мл 0,005 М растворов FeCl3 и NH4CNS и добавлении в эту кювету кристаллического хлорида аммония (несколько кристаллов).
Ваши визуальные наблюдения по четырем экспериментам запишите в тетрадь, затем определите направление смещения химического равновесия в четырех экспериментах и запишите результаты в табл. 2.
Сформулируйте общий вывод по результатам опыта 2.
Вопросы для самоконтроля и повторения
1. Дайте определение скорости химической реакции, напишите математиче-ское выражение для скорости химической реакции, для гомогенной и гетерогенной реакции.
2. Как графически определить скорость химической реакции?
3. Влияние концентрации на скорость химической реакции.
4. Дайте определение химического равновесия, константы химического равновесия.
5. При каких условиях происходит смещение химического равновесия? Сформулируйте принцип Ле Шателье.
Компьютеризированная лабораторная работа № 5
Изучение кинетики реакции разложения карбамида
В водных растворах методом электропроводности
Цель работы: определить величину константы скорости и энергию активации реакции разложения карбамида в водном растворе. Для этого необходимо:
- снять зависимость электропроводности раствора от времени протекания реакции при заданной температуре;
- определить величину константы скорости реакции разложения карбамида в водном растворе при заданной температуре.
- рассчитать энергию активации данной реакции, воспользовавшись значениями константы скорости разложения при других температурах, полученными другими исследователями.
Теоретическая часть
Результаты многочисленных исследований этой реакции указывают на то, что первым этапом разложения карбамида в водных растворах является его изомеризация – превращение в цианат аммония с последующим переходом из цианата в карбонат и далее — в аммиак и углекислоту:
CO(NH2)2⇄NH4CNO,
NH4CNO ® (NH4)CО3 ® 2 NH3 + СО2 + Н2О.
Реакция превращения цианата в карбонат протекает практически необратимо. Такого рода разложение с заметной скоростью происходит лишь в водных растворах и при повышенных температурах (50 оС и более), причем протекает по мономолекулярному механизму. В ходе реакции водный раствор органического вещества CO(NH2)2 с ковалентными связями превращается в раствор диссоциирующей на ионы соли NH4CNO, поэтому электропроводность его со временем растет. Это дает возможность измерять скорость реакции, так как приращение электропроводности можно считать пропорциональным концентрации конечного продукта. Влиянием присутствия переменного количества карбамида можно пренебречь.
Как уже указывалось, исследуемая реакция является реакцией первого порядка, поэтому расчет константы скорости реакции ведется по уравнению
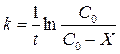 , (1)
, (1)
где С 0 – начальная концентрация карбамида; Х – концентрация карбамида, прореагировавшего к данному моменту времени; С 0- Х – концентрация карбамида, не прореагировавшего к данному моменту времени; t – время данного замера от начала реакции.
Принимаем, что увеличение электропроводности во времени пропорционально количеству образовавшегося карбоната или количеству прореагировавшего карбамида.
Обозначим: χ 0– электропроводность раствора в момент начала реакции; χ t – электропроводность в данный момент времени t; χ∞– электропроводность, соответствующая последнему измерению, когда процесс разложения мочевины полностью закончен.
Тогда, С 0 = const(χ∞ – χ0), (С 0 – х) = const(χ∞ – χ0) – const(χ∞– χt).
Таким образом, расчеты можно проводить по уравнению
 . (2)
. (2)
Величину χ0 непосредственно экспериментально определить не удается, так как от начала реакции до первого измерения проходит некоторое время. Поэтому, величину χ0 находят экстраполяцией, для чего строят график в координатах ln(χ∞– χt). и затем вычисляют χ0.
Вычислив константу скорости реакции для каждого момента времени, определяют ее среднее значение и сравнивают с величиной k, полученной графическим путем по тангенсу угла наклона прямой к оси tна графике ln(χ∞-χt)-t.
По двум константам скорости, при двух температурах, по уравнению Аррениуса рассчитывают величину энергии активации для данной реакции:
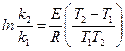 . (3)
. (3)
Вторую константу скорости берут у экспериментаторов, которые провели аналогичный опыт при другой температуре.
Экспериментальная часть
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации:
- центральный контроллер;
- модуль «Электрохимия» в комплекте с электродами для измерения электропроводности;
- модуль «Термостат» в комплекте со стаканчиком (на 150 см3), мешалкой и датчиком температуры;
2. Карбамид, дистиллированная вода.




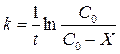 , (1)
, (1) . (2)
. (2)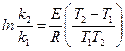 . (3)
. (3)


