

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Катализ – явление изменения скорости реакций в присутствии веществ – катализаторов, которые вступают в промежуточное взаимодействие с реагирующими веществами, но не входят в состав продуктов реакции.
Катализаторы, увеличивающие скорость реакции, называются положительными, а уменьшающие – отрицательными. Отрицательные катализаторы называются ингибиторами.
Механизм действия катализатора сводится к изменению энергии активации данной реакции: положительные катализаторы уменьшают энергию активации и тем самым увеличивают число активных молекул, а отрицательные – увеличивают энергию активации, тем самым уменьшая число активных молекул. Это происходит за счет образования промежуточных, нестойких комплексов, которые в дальнейшем распадаются на продукты реакции с выделением катализатора в химически неизменном виде.
В отсутствие катализатора реакцию можно представить следующим образом:
А + В = АВ
В присутствии катализатора реакция протекает в две быстро идущие стадии:
1 стадия А + Каt = АКаt
2 стадия AKat + B = AB + Kat,
в результате которых сначала образуются частицы промежуточного соединения AKat, а затем конечные продукты с регенерацией катализатора.
Если катализатор и реагирующие вещества находятся в одной фазе, то процесс называют гомогенным катализом.
Гетерогенный катализ протекает на границе раздела фаз, катализатор в гетерогенном катализе, как правило, находится в твердой фазе. Процесс в этом случае начинается с адсорбции исходных молекул на поверхности катализатора. Образование промежуточных соединений происходит на активных центрах катализатора. Активные центры составляют незначительную долю всей поверхности. Для увеличения поверхности катализатора и, тем самым, увеличения числа его активных центров его тонко измельчают.
|
|
Свойства катализатора:
1. Катализатор не входит в состав исходных веществ и продуктов реакции, поэтому не может оказать влияние на изменение энергии Гиббса DG, следовательно, он не может вызвать протекание реакций, для которых DG>0. Катализатор ускоряет те реакции, для которых DG<0.
2. Для обратимой реакции катализатор не смещает химическое равновесие и не влияет на константу равновесия, а лишь ускоряет достижение химического равновесия.
3. Использование катализатора не влияет на тепловой эффект химической реакции, так как тепловой эффект реакции не зависит от пути процесса.
4. Из возможных параллельных реакций катализатор ускоряет только одну – селективное действие катализатора.
5. Подбор катализатора проводится экспериментально. Для гетерогенного катализа часто используются переходные металлы и их соединения, при этом особенно высоким каталитическим действием отличаются металлы VIII Б подгруппы.
6. Активность и селективность катализатора можно изменить, вводя в объем твердого тела или на поверхность катализатора вещества, не обладающие каталитической активностью, но повышающие активность катализатора – промоторы. Вещества, которые приводят к уменьшению активности катализатора, называются каталитическими ядами.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Написать математическое выражение закона действия масс для гомогенной реакции:
2NO(г) + O2(г) = 2NO2(г)
Решение. В связи с тем, что перед NO стоит коэффициент 2, а перед O2 стоит коэффициент 1 в законе действия масс стоит концентрация NO в квадрате, а концентрация O2 в первой степени: 
Пример 2. Написать математическое выражение закона действия масс для гетерогенной реакции:
2C(к) + O2(г) = 2CO(г)
Решение. Твердая фаза в явном виде не входит в закон действия масс, поэтому для данной реакции: 
Пример 3. Во сколько раз изменится скорость реакции
|
|
2NO(г) + O2(г) = 2NO2(г)
при увеличении концентрации NO в 3 раза?
Решение. Первоначальная скорость реакции может быть записана следующим образом:

после повышения концентрации NO в 3 раза

 Таким образом, скорость реакции увеличилась в 9 раз.
Таким образом, скорость реакции увеличилась в 9 раз.
Пример 4. Во сколько раз изменится скорость реакции 
2NO(г) + O2(г) = 2NO2(г)
при увеличении объема системы в 3 раза?
Решение. Увеличение объема в системе равносильно уменьшению давлению: во сколько раз увеличивается объем, во столько же раз уменьшается давление, поэтому задачу можно переформулировать: во сколько раз изменится скорость реакции при уменьшении давления в системе в 3 раза? Для расчета следует использовать уравнение закона действия масс, в котором скорость выражена через парциальные давления, т.е: 
При уменьшении общего давления в системе парциальные давления всех компонентов уменьшаются в такое же число раз:

Таким образом, скорость реакции уменьшилась в 27 раз.
Пример 5. Вычислить, во сколько раз увеличится скорость реакции при увеличении температуры на 30оС, если температурный коэффициент равен 2.
Решение. По правилу Вант-Гоффа

Пример 6. Определить температурный коэффициент γ для реакции, скорость которой увеличилась в 32 раза при увеличении температуры на 50 К.
Решение. Подставим условие в правило Вант-Гоффа:  . Получится
. Получится  . Теперь надо представить 32 как число, возведенное в степень 5, т.е. 32=2 5. Следовательно, 2 5 = γ5. Отсюда γ= 2.
. Теперь надо представить 32 как число, возведенное в степень 5, т.е. 32=2 5. Следовательно, 2 5 = γ5. Отсюда γ= 2.
Пример 7. Скорость реакции 2СO(г) + O2(г) = 2СО2(г) при концентрациях 
 равна 0,72. Вычислить константу скорости реакции.
равна 0,72. Вычислить константу скорости реакции.
Решение. Запишем закон действия масс для данной реакции
 выразим из него константу скорости
выразим из него константу скорости  .
.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. В чем разница между гомогенными и гетерогенными реакциями?
2. Какие факторы влияют на скорость химических реакций?
3. Как формулируется закон действия масс? Каков физический смысл константы скорости реакции?
4. Как влияет температура на скорость химических реакций?
5. Сформулируйте правило Вант-Гоффа.
6. Напишите математическое выражение закона действия масс для реакции
4Al(к) + 3O2(г) = 2Al2O3(к)
7. Во сколько раз изменится скорость реакции
N2(г) + 3H2(г) = 2NH3(г)
при уменьшении объема системы в 3 раза?
8. Во сколько раз изменится скорость реакции
2Fe2O3(к) + 3CO(г) = 4Fe(к) + 3CO2(г)
при увеличении концентрации CO в 3 раза?
|
|
9. Вычислите, во сколько раз увеличится скорость реакции при увеличении температуры на 50оС, если температурный коэффициент равен 3.
10.Определите температурный коэффициент γ для реакции, скорость которой уменьшилась в 32 раза при понижении температуры с 70ºС до 20ºС.
11. Скорость реакции 2NO(г) + O2(г) = 2NO2(г)
при  равна 0,054. Константа скорости реакции равна 0,012. Вычислите
равна 0,054. Константа скорости реакции равна 0,012. Вычислите  .
.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование: стаканы, мерные цилиндры, мерные пробирки, секундомеры, растворы реактивов.
В основу экспериментальной работы положена реакция между иодноватокислым калием и сернистокислым натрием в кислой среде.
Одним из продуктов реакции является йод, который можно обнаружить по посинению раствора крахмала.
2KIO3 + 5Na2SO3 + H2SO4  K2SO4 + 5 Na2SO4 + I2 + H2O
K2SO4 + 5 Na2SO4 + I2 + H2O
Начало посинения раствора происходит при одинаковой степени завершенности реакции по йоду, что дает возможность определить относительную скорость процесса.
Для опытов возьмите четыре химических стакана и налейте в них из мерного цилиндра раствор иодноватокислого калия: в первый – 20 мл, во второй – 15 мл, в третий – 10 мл, в четвертый – 5 мл. В те же стаканы долейте необходимое количество H2O, отмеренное другим мерным цилиндром. Суммарный объем раствора во всех четырех стаканах должен быть одинаковым – 20 мл. В четыре мерные пробирки налейте по 5 мл смеси, состоящей из сернистокислого натрия, серной кислоты и небольшого количества крахмала.
Быстро вылейте в химический стакан с раствором KIO3 содержимое одной из пробирок со смесью и перемешайте, вращая стакан, одновременно включите секундомер. В момент появления синей окраски раствора выключите секундомер. То же самое проделайте с содержимым второй, третьей и четвертой пробирок. Результаты наблюдений занесите в таблицу 3.1.
Таблица 3.1
Зависимость скорости реакции от концентрации
| № | Объем, мл | Относительная концентрация

| Время

| Относит.
скорость
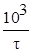
| |
| (А) KIO3 | (B) H2O | ||||
На основании экспериментальных данных построить графическую зависимость υотносит.= f(c), откладывая по оси ординат относительную скорость υотносит.=  , а по оси абсцисс – относительную концентрацию С.
, а по оси абсцисс – относительную концентрацию С.
|
|
Лабораторная работа № 4
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель работы: определение влияния условий протекания реакций на химическое равновесие.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!