Введение
После установления высоких лечебных свойств первого антибиотика - пенициллина сразу же возникли задачи организации его производства в больших количествах. На первом этапе промышленное получение этого препарата носило примитивный, экономически нерентабельный характер. Выращивание продуцента антибиотика осуществлялось на средах, находящихся в небольших сосудах, при поверхностном культивировании гриба. Процесс развития гриба продолжался 8-10 суток. Такой способ культивирования гриба при большой затрате труда давал весьма низкий выход антибиотика, и себестоимость препарата была соответственно очень высокой. В результате поисков путей наиболее рационального способа производства антибиотика был предложен метод глубинного выращивания гриба в специальных емкостях- ферментаторах при продувании воздуха и перемешивании культуральной жидкости.
Современное промышленное получение антибиотиков - это сложная многоступенчатая биотехнологическая схема, состоящая из ряда последовательных стадий:
1. Стадии биосинтеза (образования) антибиотика.
Это основная биологическая стадия сложного процесса получения антибиотического вещества. Главная задача на этой стадии - создание оптимальных условий для развития продуцента и максимально возможного биосинтеза антибиотика.
Высокая результативность стадии зависит от уровня биосинтетической активности продуцента антибиотика, времени его максимального накопления, стоимости сред для культивирования организма, в том числе стоимости применяемых предшественников, а также общих энергетических затрат на процессы, связанные с развитием продуцента антибиотического вещества.
2. Стадии предварительной обработки культуральной жидкости, клеток (мицелия) микроорганизма и фильтрации (отделение культу- ральной жидкости от биомассы продуцента).
Эффективность стадии во многом определяется составом среды для выращивания продуцента антибиотика, характером его роста, местом основного накопления биологически активного вещества (в культуральной жидкости или внутриклеточно).
3. Стадия и выделения и очистки антибиотика.
На этой стадии, в зависимости от свойств антибиотика, его химического строения и основного места накопления антибиотического вещества, применяют различные методы выделения и очистки. В качестве основных методов используются экстрация, осаждение, сорбция на ионообменных материалах, упаривание, сушка.
Особенность этой технологической стадии определяется тем, что на первой стадии работы имеют дело с небольшой концентрацией (~1 %) антибиотика в обрабатываемом растворе, тогда как на последующих этапах его концентрация увеличивается до 20-30 %. Все это требует применения различных емкостей и объемов используемых реагентов.
4. Стадии получения готовой продукции, изготовления лекарственных форм, расфасовки.
Особенность стадии определяется очень высоким требованиям к качеству конечного продукта. В случае выпуска антибиотиков, предназначенных для инъекций, препараты должны быть стерильными; получение таких антибиотических препаратов, приготовление различных лекарственных форм, дозировка (расфасовка) и упаковка должны осуществляться в асептических условиях.
Для максимального выхода антибиотика при культивировании продуцента используют комплекс мер, включающих подбор наиболее благоприятных для этих целей питательных сред и режимов культивирования организма. Весь этот комплекс мер включается в понятие «управляемый биосинтез».
В промышленных условиях управляемый биосинтез требует строгого соблюдения технологического процесса как на стадии подготовки инокулята, так и на стадии биосинтеза. На стадии подготовки инокулята особое внимание обращают на состав среды, на которой выращивается организм, на возраст клеток или мицелия. На стадии биосинтеза, кроме состава среды, большую роль играют скорость потребления тех или иных компонентов, предшественники, регуляция процесса аэрации культуры, поддержание соответствующих температуры и рН среды и других показателей режима культивирования.
В современных условиях производства принимают меры к максимальному снижению себестоимости препаратов путем интенсификации всех стадий технологического процесса и, прежде всего, повышением эффективности первой стадии - биосинтеза антибиотического вещества.
Для этого необходимо:
а) внедрение в производство наиболее высокопродуктивных штаммов микроорганизмов - продуцентов антибиотиков;
б) создание и обеспечение самых благоприятных условий развития продуцента антибиотика на относительно дешевых средах;
в) широкое использование математических методов планирования процесса развития организма и электронно-вычислительной техники с целью оптимизации и моделирования условий его культивирования, обеспечивающих максимальный выход антибиотика;
г) применение современного оборудования на всех стадиях технологического процесса с автоматизированными контролирующими устройствами основных параметров развития организма и стадий биосинтеза антибиотика.
Подготовка посевного материала
Подготовка посевного материала - одна из ответственейших операций в цикле биотехнологического способа получения антибиотиков. От количества и качества посевного материала зависит как развитие культуры в ферментаторе, так и биосинтез антибиотика. Продуцент обычно выращивают на богатых по составу натуральных средах, способных обеспечить наивысшую физиологическую активность микроорганизмов. Подготовка посевного материала - процесс многоступенчатый (рис. 1).
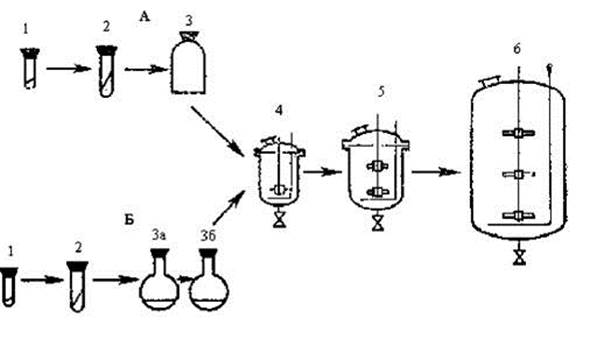
Рис. 1 Схема многоступенчатого приготовления посевного материала А - выращивание во флаконах, Б - в колбах на качалках: 1 - законсервированный исходный материал; 2 - споровая генерация на косом агаре в пробирке; 3 - II споровая генерация на твердой среде в сосуде; 3 а и 3б - I и III генерации на жидкой среде в колбе; 4 - ферментатор предварительного инокулирования; 5 - ферментатор инокулирования; 6 - основной ферментатор
Микроорганизм предварительно выращивают на агаризованной среде в пробирке (1, 2), затем из пробирки делают высев в колбы с жидкой питательной средой и проводят две генерации при глубинном выращивании на качалках в течение двух-трех суток для каждой генерации (3а и 3б). Из второй генерации культуры в колбе делают посев в небольшой (10 л) инокулятор 4, после чего хорошо развившуюся культуру переносят в более крупный инокулятор 5 (100-500 л), откуда и делают посев в основной ферментатор 6. Для посева в основной ферментатор используют от 5 до 10 % посевного материала (инокулята).
Контроль препарата
Готовый антибиотик подвергается тщательному контролю: биологическому и фармакологическому.
При биологическом контроле ставится задача выяснения стерильности готового препарата. Для этого обычно используют два метода.
Первый связан с инактивацией антибиотика и высевом его в соответствующую питательную среду. Например, биологический контроль бензилпенициллина и полусинтетических препаратов, полученных на его основе, проводится следующим образом. В пробирки, содержащие тиогликолевую среду, вносят фермент пенициллазу в количестве, способном полностью инактивировать пенициллин. Пробирки с пеницилла-зой выдерживают двое-трое суток при температуре 37 оС для контроля стерильности фермента, затем в них вносят раствор пенициллина. Пробирки разделяют на две группы: одну выдерживают при 37 оС, а другую - при 24 оС в течение пяти суток. Ведут ежедневное наблюдение за возможным развитием микроорганизмов.
Второй метод выяснения стерильности антибиотиков определяется тем, что для большинства этих соединений не имеется инактиваторов их биологической активности. Поэтому у изучаемых препаратов выявляют устойчивые к ним формы микроорганизмов, а также определяют возможное присутствие чувствительной микрофлоры. Для определения возможного присутствия в таких препаратах чувствительной к ним микрофлоры раствор антибиотика пропускают через мембранные фильтры с диаметром пор не более 0,75 мк.
Фармакологический контроль.
К антибиотическим веществам, используемых в медицинской практике, в соответствии с Государственной Фармакопеей предъявляются очень строгие требования. Каждый новый лекарственный препарат, прежде чем он будет разрешен к практическому применению, должен пройти всесторонние испытания на токсичность, пирогенность и другие свойства, жизненно важные для организма. Препарат изучают на разных видах животных в отношении его острой и хронической токсичности (влияние на кровь, ЦНС, дыхание и т. д.). Показатели острой токсичности - один из критериев качества антибиотического вещества. Устанавливают максимально переносимую дозу (МПД) антибиотика; дозу, вызывающую гибель 50 % подопытных животных (LD50) и смертельную дозу (LD100). Только после всестороннего и тщательного изучения препарата он может быть рекомендован к практическому применению.
Производство пенициллинов
В 1871 г. В.А. Манасеиным было установлено, что зеленая плесень Penicillium glaucum при своем росте уничтожает бактерии, попадающие в культуральную среду. Это свойство Penicillium было тогда же использовано врачом А. Г. Полотебневым, применившим смоченные этой плесенью повязки при лечении гнойных ран и язв.
Выдающееся открытие русских ученых не получило широкой известности, и в 1928 г. англичанин Александр Флеминг вторично обнаружил способность плесневого грибка Penicillium угнетать рост микроорганизмов. Было показано, что вызываемая плесенью гибель микробов обусловлена образованием неизвестного органического вещества, названного пенициллином.
Однако выделение пенициллина в чистом виде в то же время осуществлено не было, так как он оказался веществом очень лабильным, а применявшиеся методы очистки были несовершенны.
В годы Второй мировой войны огромная практическая потребность в эффективных антибактериальных препаратах привлекла к пенициллину внимание широкого круга специалистов, и примерно с 1939 г. начался период интенсивных исследований. Благодаря этому в относительно короткий срок (3-5 лет) англичанами Х. Флори и А. Чэттеном были разработаны способы промышленного получения и очистки пенициллина, изучены его лечебные свойства и методы клинического применения, а также установлена его химическая структура.
К пенициллинам относится группа близких по химическим свойствам соединений, содержащих в своей структуре b-лактамное и тиазо- лидиновые кольца:
R может иметь различные значения, в зависимости от типа пенициллина. Например, при R = -CH2C6H5 - это бензилпенициллин; R = - СН2-О-С6Н5 - это феноксиметилпенициллин и т. д. Наличие карбоксильной группы придает молекуле пенициллина сильные кислотные свойства, поэтому пенициллин легко образует соли со щелочами (Na, K), а также с органическими основаниями, например с дибензилэтилендиамином (препарат - бициллин).
Для практических целей медицины пенициллин получают в промышленности путем биосинтеза.
Процесс биосинтеза складывается из следующих стадий:
1) выращивания посевного материала (микроорганизмов) в аппаратах малой емкости - инокуляторах;
2) выращивания посевного материала в больших посевных аппаратах;
3) процесса ферментации;
4) выделения антибиотика из культуральной жидкости и его очистки.
Важное значение имеет также селекционный подбор высокопроизводительных штаммов плесени, подготовка и стерилизация питательной среды и аппаратуры.
Очень важное значение для высокого выхода пенициллина имеет питательная среда, примерный состав которой (в %) следующий:
| Кукурузный настой - 3 (по объему)
| Сульфат цинка - следы
|
| Лактоза (или глюкоза) - 2 (по весу)
| Карбонат кальция - 0,25
|
| Нитрат натрия - 0,6
| Магний сернокислый гептагидрат - 0,05
|
| Калий фосфорнокислый (одноза- мещенный) - 0,15
| Вода ~90
|
| Вместо какурузного настоя успешно применяется мука из хлопковых семян или мясные гидролизаты.
|
Приготовленную питательную среду подвергают стерилизации. Процесс ведут в колоннах непрерывного действия. Далее питательная среда поступает в аппарат-выдерживатель, где охлаждается в течение определенного времени до температуры 23-25 оС.
Первая стадия процесса - выращивание стандартной колонии штаммов плесени Penicillium chrysogenum - проводится в инокуляторах на питательной среде, где процесс идет ~30 часов. Подготовленный инокулят передают в посевной аппарат, объем которого ~ в 10 раз больше объема инокулятора. В посевном аппарате находится также стерилизованная питательная среда. Процесс роста здесь идет ~15-20 часов, и далее посевной материал передается на ферментацию в большие реакторы - ферментаторы объемом до 100 м на питательную среду. Процесс ферментации идет ~70 часов при температуре 23-24 оС, рН среды 6-6,5 и постоянной аэрации воздуха - 1 л воздуха/1 литр питательной среды/1 мин по всему объему ферментатора. Основная задача этого процесса - создание оптимальных условий для развития продуцента и накопления антибиотика. Биосинтез антибиотика - двухфазный процесс. В течение первой фазы происходит быстрый рост и размножение мицелия или бактериальных клеток. Куль- туральная жидкость в этот период богата углеводами, азотом и неорганическим фосфором. Продукты обмена веществ микроорганизмов, в том числе и антибиотики, находятся в малых количествах.
Вторая фаза начинается с момента замедления роста культуры. Протекает она в культуральной жидкости, обогащенной продуктом жизнедеятельности организма с небольшим количеством углеводов и фосфора. В начале этой фазы мицелий обладает максимальной способностью к синтезу антибиотика. Фазы отличаются характером и интенсивностью биохимических реакций. С учетом этих различий подбирают условия, благоприятные для первой и второй фаз развития продуцента.
Для увеличения выхода антибиотика в питательную среду вводят «предшественники», т. е. химические вещества, способствующие целенаправленному синтезу антибиотика. Так, в питательную среду при биосинтезе пенициллина вводят «предшественник» фенилацетамид - это увеличивает выход антибиотика более чем в 2 раза.
По окончании процесса ферментации культуральную массу передают на процесс выделения антибиотика.
 Рис. 3
Схема производства антибиотиков в процессе микробного синтеза Рис. 3
Схема производства антибиотиков в процессе микробного синтеза
|
Большинство продуцентов при биосинтезе выделяют антибиотик в водную фазу, поэтому процесс выделения антибиотика начинается с разделения твердой и жидкой фаз.
Твердая фаза, кроме массы мицелия, содержит значительное количество коллоидных примесей, затрудняющих фильтрование, поэтому культуральную массу предварительно подвергают различным типам коагуляции (электролитической, тепловой, кислотной и т. д.). Наиболее эффективным методом коагуляции культуральной массы является ее обработка флокулянтами (высокомолекулярными полиэлектролитами), например, поли-(4-винил)-Ы-бензилтриметиламмонийхлоридом.
Оставшийся от фильтрации мицелия водный раствор антибиотика направляют на химическую очистку и выделение.
Таким образом, водный раствор пенициллина направляют после фильтрации на экстракцию бутилацетатом при рН водной среды, равной 2. При таком значении кислотности среды подавляет кислотная ионизация пенициллина в водной фазе и он переходит в органическую фазу (в бутилацетат). Реэкстракцию пенициллина из бутилацетата проводят слабыми растворами щелочей.
Широко применяются сорбционные методы выделения и очистки антибиотиков. В качестве сорбентов широко используются синтетические ионообменные смолы.
Сушат пенициллины методом сублимации или распыления.
Широкое и успешное использование антибиотиков в медицине привело к их использованию и в других областях, в том числе:
- в ветеринарии (с теми же целями, что и в медицине);
- для борьбы с некоторыми болезнями растений бактериального и грибкового происхождения;
- в качестве добавки к кормам животных, так как они ускоряют рост и увеличивают степень превращения кормов в мясо;
- в качестве консервантов скоропортящихся продуктов;
- для подавления бактериальной флоры при осуществлении различных процессов при производстве вакцин.
Наука об антибиотиках продолжает быстро развиваться. С одной стороны, продолжаются поиски новых, еще более эффективных препаратов биотехнологии, в том числе с иммуностимулирующим, противоопухолевым, противовирусным действием, с другой стороны, расширяются работы по химическому синтезу производных этих веществ и химической модификации природных антибиотиков.
Введение
После установления высоких лечебных свойств первого антибиотика - пенициллина сразу же возникли задачи организации его производства в больших количествах. На первом этапе промышленное получение этого препарата носило примитивный, экономически нерентабельный характер. Выращивание продуцента антибиотика осуществлялось на средах, находящихся в небольших сосудах, при поверхностном культивировании гриба. Процесс развития гриба продолжался 8-10 суток. Такой способ культивирования гриба при большой затрате труда давал весьма низкий выход антибиотика, и себестоимость препарата была соответственно очень высокой. В результате поисков путей наиболее рационального способа производства антибиотика был предложен метод глубинного выращивания гриба в специальных емкостях- ферментаторах при продувании воздуха и перемешивании культуральной жидкости.
Современное промышленное получение антибиотиков - это сложная многоступенчатая биотехнологическая схема, состоящая из ряда последовательных стадий:
1. Стадии биосинтеза (образования) антибиотика.
Это основная биологическая стадия сложного процесса получения антибиотического вещества. Главная задача на этой стадии - создание оптимальных условий для развития продуцента и максимально возможного биосинтеза антибиотика.
Высокая результативность стадии зависит от уровня биосинтетической активности продуцента антибиотика, времени его максимального накопления, стоимости сред для культивирования организма, в том числе стоимости применяемых предшественников, а также общих энергетических затрат на процессы, связанные с развитием продуцента антибиотического вещества.
2. Стадии предварительной обработки культуральной жидкости, клеток (мицелия) микроорганизма и фильтрации (отделение культу- ральной жидкости от биомассы продуцента).
Эффективность стадии во многом определяется составом среды для выращивания продуцента антибиотика, характером его роста, местом основного накопления биологически активного вещества (в культуральной жидкости или внутриклеточно).
3. Стадия и выделения и очистки антибиотика.
На этой стадии, в зависимости от свойств антибиотика, его химического строения и основного места накопления антибиотического вещества, применяют различные методы выделения и очистки. В качестве основных методов используются экстрация, осаждение, сорбция на ионообменных материалах, упаривание, сушка.
Особенность этой технологической стадии определяется тем, что на первой стадии работы имеют дело с небольшой концентрацией (~1 %) антибиотика в обрабатываемом растворе, тогда как на последующих этапах его концентрация увеличивается до 20-30 %. Все это требует применения различных емкостей и объемов используемых реагентов.
4. Стадии получения готовой продукции, изготовления лекарственных форм, расфасовки.
Особенность стадии определяется очень высоким требованиям к качеству конечного продукта. В случае выпуска антибиотиков, предназначенных для инъекций, препараты должны быть стерильными; получение таких антибиотических препаратов, приготовление различных лекарственных форм, дозировка (расфасовка) и упаковка должны осуществляться в асептических условиях.
Для максимального выхода антибиотика при культивировании продуцента используют комплекс мер, включающих подбор наиболее благоприятных для этих целей питательных сред и режимов культивирования организма. Весь этот комплекс мер включается в понятие «управляемый биосинтез».
В промышленных условиях управляемый биосинтез требует строгого соблюдения технологического процесса как на стадии подготовки инокулята, так и на стадии биосинтеза. На стадии подготовки инокулята особое внимание обращают на состав среды, на которой выращивается организм, на возраст клеток или мицелия. На стадии биосинтеза, кроме состава среды, большую роль играют скорость потребления тех или иных компонентов, предшественники, регуляция процесса аэрации культуры, поддержание соответствующих температуры и рН среды и других показателей режима культивирования.
В современных условиях производства принимают меры к максимальному снижению себестоимости препаратов путем интенсификации всех стадий технологического процесса и, прежде всего, повышением эффективности первой стадии - биосинтеза антибиотического вещества.
Для этого необходимо:
а) внедрение в производство наиболее высокопродуктивных штаммов микроорганизмов - продуцентов антибиотиков;
б) создание и обеспечение самых благоприятных условий развития продуцента антибиотика на относительно дешевых средах;
в) широкое использование математических методов планирования процесса развития организма и электронно-вычислительной техники с целью оптимизации и моделирования условий его культивирования, обеспечивающих максимальный выход антибиотика;
г) применение современного оборудования на всех стадиях технологического процесса с автоматизированными контролирующими устройствами основных параметров развития организма и стадий биосинтеза антибиотика.
Методы культивирования продуцентов антибиотиков
В современных условиях наиболее перспективным методом выращивания микроорганизмов-продуцентов антибиотиков признан метод глубинного культивирования. Метод состоит в том, что микроорганизм развивается в толще жидкой питательной среды, через которую непрерывно подается стерильный воздух, и среда перемешивается.
Существует четыре основных модификации глубинного способа выращивания микроорганизмов.
1. Периодическое культивирование.
При этом способе весь процесс развития микроорганизмов полностью завершается в одном ферментаторе, после чего ферментатор освобождается от культуральной жидкости, тщательно промывается, стерилизуется и вновь заполняется свежей питательной средой. Среда засевается изучаемым микроорганизмом, и процесс возобновляется.
2. Отъемный метод.
Культивирование микроорганизмов осуществляется в ферментаторах с периодическим отбором части объема культуральной жидкости в ферментаторе и доводится свежей питательной средой до исходного уровня.
3. Батарейный способ.
Микроорганизмы развиваются в ряду последовательно соединенных ферментаторов. Культуральная жидкость на определенной стадии развития микроорганизма перекачивается из первого ферментатора во второй, затем из второго в третий и т. д. Освобожденный ферментатор немедленно заполняется свежей питательной средой, засеянной микроорганизмом. При этом способе выращивания микроорганизмов емкости используются более рационально.
4. Непрерывное культивирование.
В основе метода лежит принцип непрерывного протока питательной среды, что позволяет поддерживать развитие микроорганизма на определенной стадии его роста. Стадия развития микроорганизма определяется тем, что в этот период происходит максимальный биосинтез антибиотика или другого биологически активного соединения.
Установлено, что в условиях непрерывного процесса биосинтеза некоторых антибиотиков можно получить хорошие результаты, если процесс вести в две стадии. В первом аппарате батареи поддерживают высокую скорость потока, обеспечивающую большую скорость роста продуцента антибиотика, с тем, чтобы получить высокоактивную биомассу, а во втором аппарате обеспечивают низкую скорость потока и соответственно небольшую скорость роста. Процесс непрерывного культивирования - перспективное направление современной биотехнологии.





 Рис. 3
Схема производства антибиотиков в процессе микробного синтеза
Рис. 3
Схема производства антибиотиков в процессе микробного синтеза



