

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ БЕЛКОВ
А. Азотистый баланс
АК содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма.Азотистый баланс- разница между количеством азота, поступающего с пищей, и количеством выделяемого азота. Если количество поступающего азота равно количеству выделяемого, то наступаетазотистое равновесие.Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, у пациентов. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний.При безбелковой диете азотистый баланс становится отрицательным. Минимальное количество белков в пище, необходимое для поддержания азотистого равновесия, соответствует 30-50 г/cyt, оптимальное же количество при средней физической нагрузке составляет ∼100-120 г/сут.
Аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят фенилаланин, метио-нин, треонин, триптофан, валин, лизин, лейцин, изолейцин.
Две аминокислоты - аргинин и гистидин называют частично заменимыми. - тирозин и цистеин - условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, пролин, аланин.
|
|
Однако безбелковое питание заканчивается гибелью организма. Исключение даже одной незаменимой аминокислоты из рациона ведёт к неполному усвоению других аминокислот и сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста и нарушениями функций нервной системы.
При безбелковой диете в сутки выделяется 4гр азота,что составляет 25гр белка (КОЭФ-Т ИЗНАШИВАНИЯ).
Физиологический белковый минимум- минимальное количество белков в пище необходимое для поддержания азотистого равновесия- 30-50 г/сут.
В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются в ЖКТ под действием ферментов протеаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
Образование и роль соляной кислоты
Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов - гастринов, которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. НСI образуется в обкладочных клетках желудочных желёз
Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы
Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму. Ионы С1- поступают в просвет желудка через хлоридный канал.
|
|
РН снижается до 1,0-2,0.
Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина.
Пепсиноген - белок, состоящий из одной полипептидной цепи. Под действием НСl он превращается в активный пепсин В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты.
У детей грудного возраста в желудке находится фермент реннин (химозин), вызывающий свёртывание молока. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина.
ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника.
Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0.
Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина (см. раздел 11), который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
|
|
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбок-сипептидазы А и В.
Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В.
Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три).
Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина.
В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия.
Оксидаза L-аминокислот
В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:

Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен.
Оксидаза D-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
|
|

Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры
10. Трансаминирование - реакция переноса α-аминогруппы с ак-ы на α-кетокислоту, в результате чего образуются новая кетокислота и новая ак. процесс трансаминирования легко обратим
Синтез меланинов.

Виды меланинов
Реакция активация метионина
Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ.
Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).

Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы. Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования.
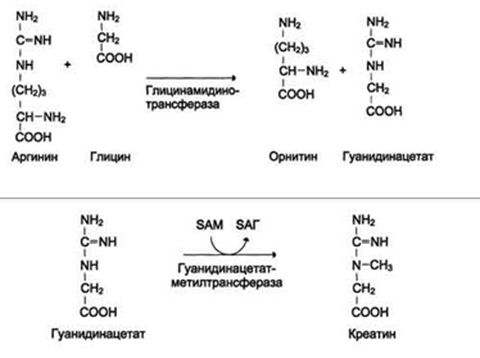
Реакции трансметилирования используются также для:
Инактивация биогенных аминов также происходит:
|
|
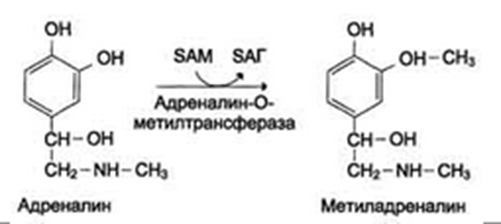
метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в ортоположении
Для диагностики ФКУ используют методы качественного и количественного анализа патологических метаболитов в моче, определение концентрации Фен в крови и моче. Дефектный ген, ответственный за ФКУ, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к Фен.
Регуляция синтеза гема
Последовательность нуклеотидов, которая называется железочувствительным элементом. При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. При низких концентрациях железа трансляция аминолевулинатсинтазы тормозится.
Распад гема
Гем(гемоксигеназа)-биливердин(биливердинредуктаза)-билирубин(УДФ-глюкуранилтрансфераза)-билирубинмоноглюкуронид(УД-глюкуронилтрансфераза)-билирубиндиглюкуронид
В нормальном состоянии концентрация общего билирубина в плазме составляет 0,3-1 мг/дл (1,7-17 мкмоль/л), 75% от общего количества билирубина находится в неконъюгированной форме (непрямой билирубин). В клинике конъ-югированный билирубин называют прямым, потому что он водорастворим и может быстро взаимодействовать с диазореагентом, образуя соединение розового цвета, - это прямая реакция Ван дер Берга. Неконъюгированный билирубин гидрофобен, поэтому в плазме крови содержится в комплексе с альбумином и не реагирует с диазореактивом до тех пор, пока не добавлен органический растворитель, например этанол, который осаждает альбумин. Неконъюгированный илирубин, взаимодействующий с азокрасителем только после осаждения белка, называют непрямым билирубином.
Когда содержание билирубина превышает норму, говорят о гипербилирубинемии. В зависимости от того, концентрация какого типа билирубина повышена в плазме - неконъюгированного или конъюгированного, - гипербилирубинемию классифицируют как неконъюгированную и конъюгированную.
У больных с печёночно-клеточной патологией, сопровождающейся длительным повышением концентрации конъюгированного билирубина, в крови обнаруживают третью форму плазменного билирубина, при котором билирубин ковалентно связан с альбумином, и поэтому его невозможно отделить обычным способом. В некоторых случаях до 90% общего содержания билирубина крови может находиться в этой форме.
Желтухи
Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах. Гипербилирубинемию отмечают также при закупорке желчевыводящих протоков печени.
Во всех случаях содержание билирубина в крови повышается. При достижении определённой концентрации он диффундирует в ткани, окрашивая их в жёлтый цвет. Пожелтение тканей из-за отложения в них билирубина называютжелтухой.Клинически желтуха может не проявляться до тех пор, пока концентрация билирубина в плазме крови не станет выше 50 мкмоль/л.
1. Гемолитическая (надпечёночная) желтуха
результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Гемолитическая желтуха развивается при исчерпании резервных возможностей печени. Основная причина надпечёночной желтухи - наследственные или приобретённые гемолитические анемии. Гипербилирубинемия у больных гемолитической желтухой обусловлена значительным повышением (103 - 171 мкмоль/л) в крови концентрации непрямой билирубин). Образование в печени и поступление в кишечник больших количеств билирубинглюкуронидов (прямой билирубин) ведёт к усиленному образованию и выделению с калом и мочой уробилиногенов и более интенсивной их окраски
Один из главных признаков гемолитической желтухи - повышение содержания в крови (непрямого) билирубина. Это позволяет легко отличить её от механической (подпечёночной) и печёночно-клеточной (печёночной) желтух.
Неконъюгированный билирубин токсичен. Гидрофобный, липофильный неконъюгирован-ный билирубин, легко растворяясь в липидах мембраны и проникая вследствие этого в митохондрии, разобщает в них дыхание и окислительное фосфорилирование, нарушает синтез белка, поток ионов калия через мембрану клетки и органелл. Это отрицательно сказывается а состоянии ЦНС, вызывая у больных ряд характерных неврологических симптомов.
Желтуха новорождённых"физиологическая желтуха", наблюдающаяся в первые дни жизни ребёнка. Причиной повышения концентрации непрямого билирубина в крови служит ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина. У новорождённых снижена активность УДФ-глюкуронилтрансферазы, но и, недостаточно активно происходит синтез второго субстрата реакции конъюгации УДФ-глюкуроната.УДФ-глюкуронилтрансфераза - индуцируемый фермент. Новорождённым с физиологической желтухой вводят лекарственный препарат фенобарбитал.
2. Печёночно-клеточная (печёночная) желтуха
Печёночно-клеточная (печёночная) желтуха обусловлена повреждением гепатоцитов и жёлчных капилляров, например, при острых вирусных инфекциях, хроническом и токсических гепатитах.
Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические процессы, в частности переводить конъюгированный (прямой) билирубин из клеток в жёлчь против градиента концентрации. Для печёночно-клеточной желтухи характерно то, что вместо преобладающих в норме диглюкуронидов билирубина в поражённой печёночной клетке образуются главным образом моноглюкурониды. В результате деструкции печёночной паренхимы образующийся прямой билирубин частично попадает в большой круг кровообращения, что ведёт к желтухе. Экскреция жёлчи также нарушена. При печёночно-клеточной желтухе повышается концентрация в крови как общего билирубина, так
3. Механическая, или обтурационная (подпечёночная) желтуха
Механическая, или обтурационная (подпечёночная), желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной При полной закупорке общего жёлчного протока конъюгированный билирубин в составе желчи не поступает в кишечник, хотя гепатоциты продолжают его вырабатывать. Поскольку билирубин в кишечник не попадает, продуктов его катаболизма уробилиногенов в моче и кале нет. Кал обесцвечен. Так как нормальные пути экскреции билирубина заблокированы, происходит его утечка в кровь, поэтому в крови больных повышена концентрация конъ-югированного билирубина. Растворимый билирубин экскретируется с мочой, придавая ей насыщенный оранжево-коричневый цвет.
Обмен железа
В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа.
В организме взрослого человека содержится 3 - 4 г железа, из которых только около 3,5 мг находится в плазме крови. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки.
В нейтральной или щелочной среде железо находится в окисленном состоянии - Fe3+, При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин.
Нарушение обмена железа
Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках. Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных тложений избыточного железа ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу. Гемохроматоз может быть обусловлен наследственным увеличением всасывания железа в кишечнике, при этом содержание железа в организме больных может достигать 100 г. Это заболевание наследуется по аутосомнорецессивному типу, а. Накопленш гемосидерина в поджелудочной железе приводит к разрушению р-клеток островков Лангерханса и, как следствие этого, к сахарному диабету. Отложение гемосидерина в гепатоцитах вызывает цирроз печени, а в миокардиоцитах - сердечную недостаточность. Больных наследственным гемохроматозом лечат регулярными кровопусканиями, еженедельно или один раз в месяц в зависимости от тяжести состояния больного. К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо.
31.
Спектральный анализ гемоглобина и его производных. Использование спектрографических методов при рассмотрении раствора оксигемоглобина выявляет в желто—зеленой части спектра между фраунгоферовскими линиями D и Е две системные полосы поглощения, у восстановленного гемоглобина в той же части спектра имеется лишь одна широкая полоса. Различия в поглощении излучения гемоглобином и оксигемоглобином послужили основой для метода изучения степени насыщения крови кислородом — оксигемометрии.
Карбгемоглобин по своему спектру близок к оксигемоглобину, однако при добавлении восстанавливающего вещества у карбгемоглобина появляются две полосы поглощения. Спектр метгемоглобина характеризуется одной узкой полосой поглощения слева на границе красной и желтой части спектра, второй узкой полосой на границе желтой и зеленой зон, наконец, третьей широкой полосой в зеленой части спектра
Кристаллы гемина или солянокислого гема-тина. С поверхности пятна соскабливается на предметное стекло и измельчается несколько крупинок. К ним добавляются 1—2 крупинки поваренной соли и 2—3 капли ледяной уксус- ной к-ты. Все накрывают покровным стеклом и осторожно, не доводя до кипения, нагревают. Присутствие крови доказывается появлением микрокристаллов буро-желтого цвета в виде ромбических табличек. Если кристаллы плохо сформированы, то имеют вид конопляного семени. Получение кристаллов гемина безусловно доказывает присутствие в исследуемом объекте крови. Отрицательный результат пробы не имеет значения. Примесь жира,ржавчина затрудняют получение кристаллов гемина
Зиологическая роль АФК.
В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других ОВР. Ферменты, участвующие ОВР с использованием О2, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот), синтезе жёлчных кислот и стероидов), в реакциях обезвреживания чужеродных веществ в печени
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона, которые располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:

Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции
Повреждающее действие свободных радикалов на компоненты клетки. 1 - разрушение белков; 2 - повреждение ЭР; 3 - разрушение ядерной мембраны и повреждение ДНК; 4 - разрушение мембран митохондрий; проникновение в клетку воды и ионов.
Образование супероксида в ЦПЭ. "Утечка" электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал нефермента-тивно взаимодействует с О2 с образованием супероксидного радикала. 
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород (
на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов.
В фагоцитирующих лейкоцитах в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов.
Микросомальное окисление
Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Сисгема включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу.
Цитохром Р450 - гемопротеин, содержит простетическую группу гем и имеет участки связывания для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм. Связывание в активном центре цитохрома Р450 липофильного вещества RH и молекулы кислорода повышает окислительную активность фермента.

Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.
37. Фаза конъюгации в системе обезвреживания токсических веществ. Виды конъюгации (примеры реакций с ФАФС, УДФГК)
Конъюгация - вторая фаза обезвреживание веществ, в ходе которой происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков
1. Участие трансфераз в реакциях конъюгации
УДФ-глюкуронилтрансферазы. Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе мик-росомального окисления
В общем виде: ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфотрансферазы. Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам
Реакция в общем виде: ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы. Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, билирубина, жёлчных кислот, В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях.
Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цис-теину карбоксильной группой радикала). ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
путём конъюгации субстрата R с глутатионом (GSH): R + GSH → GSRH,
в результате нуклеофильного замещения: RX + GSH → GSR + НХ,
восстановления органических пероксидов до спиртов: R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
В реакции: ООН - гидропероксидная группа, GSSG - окисленный глутатион.
Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма
ГТ своими гидрофобными центрами могут не-ковалентно связывать огромное количество ли-пофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином.
ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки.
Ацетилтрансферазы, метилтрансферазы
Ацетилтрансферазы катализируют реакции конъюгации - переноса ацетильного остатка от ацетил-КоА на азот группы -SO2NH2, например в составе сульфаниламидов. Мембранные и цитоплазматические метилтрансферазы с участием SAM метилируют группы -Р=О, -NH2 и SH-группы ксенобиотиков.
Роль эпоксидгидролаз в образовании диолов
Во второй фазе обезвреживания (реакции конъюгации) принимают участие и некоторые другие ферменты. Эпоксидгидролаза (эпоксидгидратаза) присоединяет воду к эпоксидам бензола, бензпирена и другим полициклическим углеводородам, образованным в ходе первой фазы обезвреживания, и превращает их в диолы (рис. 12-8). Эпоксиды, образовавшиеся при микросомальном окислении, являются канцерогенами. Они обладают высокой химической активностью и могут участвовать в реакциях неферментативного алкилирования ДНК, РНК, белков Химические модификации этих молекул могут привести к перерождению нормальной клетки в опухолевую.
Образование и обезвреживание n-крезола и фенола
Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путём разрушения боковых цепей аминокислот микробами
Всосавшиеся продукты по воротной вене поступают в печеНb, где обезвреживание фенола и крезола может происходить путём конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфераза
Конъюгация глюкуроновых кислот с фенолом и крезолом происходит при участии фермента УДФ-глюкуронилтрансферазы. Продукты конъюгации хорошо растворимы в воде и выводятся с мочой через почки. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом обнаруживают в моче при увеличении продуктов гниения белков в кишечнике.
Образование и обезвреживание индола и скатола
В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру.
Индол образуется в результате отщепления бактериями боковой цепи, возможно, в виде серина или аланина
Скатол и индол обезвреживаются в печени в 2 этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана
БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ БЕЛКОВ
А. Азотистый баланс
АК содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма.Азотистый баланс- разница между количеством азота, поступающего с пищей, и количеством выделяемого азота. Если количество поступающего азота равно количеству выделяемого, то наступаетазотистое равновесие.Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, у пациентов. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний.При безбелковой диете азотистый баланс становится отрицательным. Минимальное к

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!