ИНГУШСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КАФЕДРА БИОЛОГИИ
ХАШИЕВА Л.С.
ФОТОСИНТЕЗ
Магас 2016
Р е ц е н з е н т ы: доктор биологических наук, проф. Плиева А.М.,
кандидат биологических наук, доцент кафедры агрономии Леймоева А.Ю.
Составитель: Хашиева Л.С.
Учебное пособие. – Магас: ИнгГУ, 2016. – 34 с.
Учебное пособие включает лекционный материал по теме «Фотосинтез». Рассмотрены современные проблемы фотосинтеза высших растений и структурно-функциональные аспекты биоэнергетики, включая современные теории механизма фотосинтетического фосфорилирования; освещены новые данные о структурной организации и механизме функционирования АТФ-синтетазного комплекса.
Предназначен для студентов-биологов университетов, педагогических вузов.
© Хашиева Л.С., 2016
Предисловие
Все функции зеленого автотрофного растения – питание, дыхание, рост, развитие, размножение, а также разнообразие биохимических процессов – можно свести к явлениям превращения веществ и энергии, изменения и развития форм растительных организмов. Функции каждого органа растения непосредственно влияют на деятельность организма в целом, зависят от других органов и взаимосвязаны. Растительные организмы, как и другие живые системы, подчиняются законам превращения веществ и энергии, а особенности их жизни заключаются в специфике строения и способах их взаимодействия со средой. Создание и накопление растением органических веществ – результат взаимосвязанных физиологических процессов, интенсивность которых определяется особенностями самого растения и условиями, в которых оно растет и развивается.
Одним из кардинальных направлений современной фитофизиологии является исследование механизмов фотосинтеза. Здесь достигнуты большие успехи в познании молекулярных механизмов первичных процессов преобразования и запасания солнечной энергии, выяснении структурной организации фотосинтетического аппарата и механизмов, регулирующих его функциональную активность на всех этапах процесса.
Изучение условий, определяющих высокую эффективность работы АТФ-синтезирующих систем, представляет одно из важных направлений физиологии растений, поскольку уровень энергообмена контролирует активность всех метаболических систем растительного организма.
Успехи последних десятилетий в области экспериментальной биологии требуют постоянного обобщения большого потока новых данных по важнейшим разделам физиологии растений. В связи с этим в данном учебном пособии автор ставил задачу отразить основные итоговые данные и современные тенденции в развитии раздела фитофизиологии «фотосинтеза», имеющего важное значение для подготовки молодых специалистов.
При подготовке пособия была использована следующая литература:
Лебедев. Физиология растений. М.: Колос, 1982. – 463 с.
Либберт. Физиология растений. М.: Мир, 1976. – 580 с.
Полевой В.В. Физиология растений. М.: Высш.шк.,1989 – 464 с.
Якушкина Н.И. Физиология растений. М., 1980. – 303 с.
Ф О Т О С И Н Т Е З
Растительный мир представляет склад,
в котором лучи солнца задерживаются и запасаются для
дальнейшего полезного употребления.
М а й е р
Ф о т о с и н т е з – это процесс трансформации поглощенной организмом энергии солнечного излучения в химическую энергию органических соединений, синтезируемых из СО2 и Н2О.
Поскольку весь кислород фотосинтеза выделяется из воды, общее уравнение фотосинтеза выглядит следующим образом:
6СО2 + 12Н2О + hγ → С6Н12О6 + 6О2 + 6Н2О
Основным органом фотосинтеза является лист, который имеет плоскую форму и дорсовентральное строение. Пластинчатая форма листа обеспечивает наибольшую поверхность на единицу объема ткани, что создает наилучшие условия для воздушного питания. Анатомическое строение листа приспособлено к тому, чтобы обеспечить поступление СО2 к клеткам, содержащим пластиды, поглощение света, транспорт продуктов фотосинтеза, транспирацию. К верхнему эпидермису примыкает палисадная паренхима – основная ассимиляционная ткань, богатая хлоропластами – клетки которой вытянуты перпендикулярно поверхности листа (рис. 1). Под палисадной паренхимой находится губчатая паренхима, клетки которой расположены рыхло, вследствие наличия системы межклетников. Густая сеть жилок в листе облегчает снабжение клеток паренхимы водой, а также способствует быстрому оттоку из листа углеводов, образующихся в процессе фотосинтеза. СО2 поступает в лист через устьица, расположенные на нижней стороне листовой поверхности.
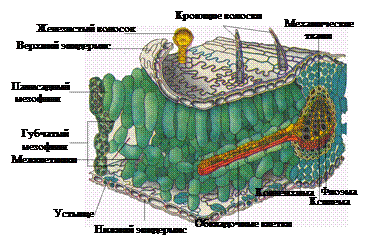
Рис.1. Схема клеточного строения листа двудольных
Фотофизические, фотохимические и биохимические реакции фотосинтеза протекают в зеленых пластидах – хлоропластах.
Х л о р о п л а с т ы – это овальные тела 5-10 мкм длиной и 2-3 мкм в диаметре, обладающие наружной и внутренней мембраной (рис.2.). Внутренняя мембрана, ограничивающая внутреннюю гомогенную среду (строму) хлоропласта, образует уплощенные инвагинации – тилакоиды, которые могут иметь форму дисков. Несколько таких тилакоидов, лежащих друг над другом, формируют стопку – грану и в этом случае называются тилакоидами гран. Другие тилакоиды, связывающие между собой граны или не контактирующие с ними называются тилакоидами стромы. От остальных органелл клетки хлоропласты отличаются большей автономностью: они содержат не только полный фотосинтетический аппарат, но и собственную белок-синтезирующую систему, оболочку, через которую происходит регулируемый обмен веществами с цитоплазмой, и даже генетическую информацию в виде пластидной ДНК.
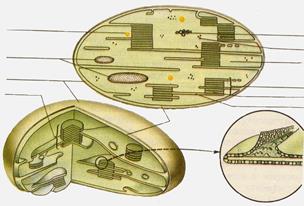
Рис. 2. Строение хлоропласта
В мембранах тилакоидов локализованы пигменты, участвующие в поглощении и использовании энергии света. Биохимические системы синтеза и превращения углеводов функционируют в строме хлоропластов.
Для фотосинтезирующих организмов характерно единая пигментная система. Пигменты зеленых растений играют важную роль в превращении лучистой энергии света в химическую. Все пигменты, встречающиеся в растениях, можно разделить на следующие группы: хлорофиллы, каротиноиды и фикобилины.
К группе хлорофиллов относятся органические соединения, которые содержат 4 пиррольных кольца, связанных между собой метиновыми мостиками (α,β,γ,δ), образуя порфириновое ядро. Атомы азота пиррольных колец четырьмя координационными связями взаимодействуют с атомом магния. В структуре порфиринового ядра есть также пятое циклопентановое кольцо (V), образованное остатком кетопропионовой кислоты и содержащее химически активную карбонильную группу у С9 и метилированную карбоксильную группу у С10. По химическому строению хлорофилл – это сложный эфир дикарбоновой кислоты – хлорофиллина, у которой одна карбоксильная группа этерифицирована остатком метилового спирта, а другая остатком одноатомного непредельного спирта фитола (рис.3). В настоящее время известно около 10 хлорофиллов, которые отличаются по химическому строению, окраске, распространению среди живых организмов.
У всех высших растений в хлоропластах содержатся хлорофиллы а (C55H72O5N4Mg, 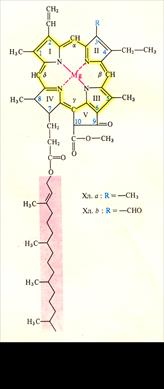 молекулярная масса 893) и хлорофиллы б (C55H70O6N4Mg, молекулярная масса 907), в бактериях содержится бактериохлорофилл (C55H74O6N4Mg, молекулярная масса 911).
молекулярная масса 893) и хлорофиллы б (C55H70O6N4Mg, молекулярная масса 907), в бактериях содержится бактериохлорофилл (C55H74O6N4Mg, молекулярная масса 911).
К группе каротиноидов относится большое количество (около 100) различных жирорастворимых пигментов желтого, оранжевого, красного цвета, которые присутствуют в хлоропластах всех растений. Они также входят в состав хромопластов в незеленых частях растений. К каротиноидам относятся три группы соединений: 1) оранжевые или красные пигменты каротины (C40H56); 2) желтые ксантофиллы (C40H56О2 и C40H56О4); 3) каротиноидные кислоты.
 Фикобилины – это пигменты, которые содержатся в красных и синезеленых водорослях и относятся к группе желчных пигментов – билинов. Характерный пигмент красных водорослей – фикоэритробилин (C34H47N4O8), пигмент сине-зеленых водорослей – фикоцианобилин (C34H42N4O9).
Фикобилины – это пигменты, которые содержатся в красных и синезеленых водорослях и относятся к группе желчных пигментов – билинов. Характерный пигмент красных водорослей – фикоэритробилин (C34H47N4O8), пигмент сине-зеленых водорослей – фикоцианобилин (C34H42N4O9).
Химическое и спектральное разнообразие пигментов имеет четкое функциональное значение. Спектр поглощения может захватывать видимый и невидимый участки спектра. Видимая часть спектра представлена длинами волн от 400 до 800 нм. Органические вещества, поглощающие свет с длиной волны менее 400 нм, кажутся бесцветными. Цвет всякого тела, в том числе хлорофилла и желтых пигментов, зависит от лучей, дополнительных к поглощенным. Следовательно, зеленый цвет хлорофилла зависит от непоглощенных зеленых лучей. Спектры поглощения пигментов пластид приведены на рис.4.
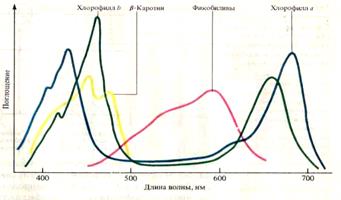
Рис.4. Спектры поглощения пигментов пластид
Роль всех пигментов заключается в поглощении света и передаче энергии возбуждения в реакционные центры фотосинтеза, где она используется в окислительно-восстановительных реакциях.
Процесс фотосинтеза осуществляется в два этапа. В тилакоидах протекают реакции, вызываемые светом – световая фаза фотосинтеза, а в строме – реакции, не связанные со светом, или реакции фиксации углерода – темновая фаза фотосинтеза.
Рис.6. Переходы между возбужденными состояниями хлорофилла после поглощения квантов синего или красного света
Исследования показали, что не каждая молекула хлорофилла принимает участие в последующих в фотохимических реакциях. Подсчитано, что каждая молекула хлорофилла на прямом солнечном свету поглощает квант света не чаще, чем через 0,1с. Между тем скорость последующих реакций фотосинтеза значительно больше. Следовательно, при непосредственной связи каждой молекулы хлорофилла с последующей реакцией процесс фотосинтеза шел бы прерывисто. Кроме того, если бы каждая молекула хлорофилла отдавала энергию непосредственно на фотохимические процессы, то в листе не хватило бы места для размещения всех необходимых для этого ферментных систем. В процессе эволюции в растениях выработался механизм, позволяющий наиболее полно использовать кванты света, падающие на лист подобно каплям дождя. Механизм заключается в том, что из 200-250 молекул хлорофилла непосредственная связь с реакционным центром осуществляется одной. Энергия поглощенных квантов света стекается от сотен молекул пигментов к одной молекуле хлорофилла-ловушки связанной с реакционным центром. Эта молекула хлорофилла-ловушки со всеми вспомогательными молекулами пигментов, которые передают ей энергию, представляют собой фотосинтетическую единицу (рис. 7).

е-
П700
Рис. 7. Схема передвижения квантов света к хлорофиллу
В улавливании и передаче энергии на молекулу хлорофилла-ловушки могут участвовать не только молекулы хлорофилла а и хлорофилла б, но и такие пигмента, как каротиноиды и фикобилины. Передача энергии между молекулами пигментов идет главным образом резонансным путем без разделения зарядов с большой скоростью и с большой эффективностью. Природа индуктивного резонанса состоит в том, что каждая молекула хлорофилла, поглотившая квант света и перешедшая в синглетное возбужденное состояние, является молекулярным осциллятором. Возникающее вокруг возбужденной молекулы переменное электрическое поле с определенной частотой колебаний индуцирует осцилляцию диполя (электрон-ядро) соседней молекулы. При этом молекула-донор переходит в основное состояние, а молекула-акцептор – в возбужденное. Механической моделью такой резонансной передачи энергии может быть система из двух маятников, связанных слабой пружинкой. Раскачивание одного из маятников вызывает колебания другого и затухание колебаний первого.
Условиями для резонансного переноса энергии электронного возбуждения служат малые расстояния между молекулами в мембранах – всего 1 нм.
 Молекула хлорофилла-ловушки характеризуется поглощением в наиболее длинноволновой части солнечного спектра – 700 нм и обозначается как пигмент 700 (П700). Перенос энергии происходит только от пигментов, поглощающих свет с меньшей длиной волны, к пигментам, поглощающим свет с большей длиной волны. Затем эта энергия переносится через хлорофилл-ловушку в реакционный центр, где используется в фотохимических реакциях. Дальнейшее превращение энергии света в химическую энергию проходит в ряд этапов, начиная с окислительно-восстановительных превращений хлорофилла, включая как фотохимические (световые), так и энзиматические (темновые) реакции. Фотохимические реакции – это реакции, в которых энергия света преобразуется в энергию химических связей.
Молекула хлорофилла-ловушки характеризуется поглощением в наиболее длинноволновой части солнечного спектра – 700 нм и обозначается как пигмент 700 (П700). Перенос энергии происходит только от пигментов, поглощающих свет с меньшей длиной волны, к пигментам, поглощающим свет с большей длиной волны. Затем эта энергия переносится через хлорофилл-ловушку в реакционный центр, где используется в фотохимических реакциях. Дальнейшее превращение энергии света в химическую энергию проходит в ряд этапов, начиная с окислительно-восстановительных превращений хлорофилла, включая как фотохимические (световые), так и энзиматические (темновые) реакции. Фотохимические реакции – это реакции, в которых энергия света преобразуется в энергию химических связей.
В процессе фотосинтеза принимают участие две фосистемы. Фотосистему составляет фотосинтетическая единица совместно с определенными белками-переносчиками электронов. Изучая влияние света на квантовый выход фотосинтеза[3] Р.Эмерсон (1957) показал, что эффективность света с длиной волны 700нм может быть значительно повышена добавлением света с более короткой длиной волны (λ 680нм). Интенсивность фотосинтеза при освещении смешанным светом (с двумя длинами волн) оказалась выше суммы интенсивностей фотосинтеза, наблюдаемой при освещении светом каждой длины волны в отдельности. Это явление называют эффектом усиления или эффектом Эмерсона. Из выше сказанного следует, что для нормального протекания процесса фотосинтеза необходимо одновременное световое возбуждение пигментов, различающихся по спектру поглощения.
Приняв энергию поглощенных квантов света от сотен молекул пигментов, молекула хлорофилла-ловушки отдает электрон (окисляется). Электрон поступает в электронно-транспортную цепь. Перенос электрона по цепи переносчиков включает ряд окислительно-восстановительных реакций, в ходе которых выделяется энергия. Эта энергия используется для синтеза АТФ из АДФ и неорганического фосфата, который получил название фотосинтетического фосфорилирования. Различают два типа фотофосфорилирования: нециклическое и циклическое, которые связаны соответственно с нециклическим и циклическим потоками электронов. При нециклическом потоке происходит фотоокисление воды и передача электронов от воды к НАДФ. При циклическом потоке электроны, переданные от молекулы хлорофилла первичному акцептору, возвращаются к ней обратно.
Установлено, что фотосистема I (ФС I) у высших растений включает 200 молекул хлорофилла а, 50 молекул каратиноидов и 1 молекулу хлорофилла-ловушки, поглощающую свет с длиной волны λ 700 нм (П700).
Фотосистема II (ФС II) включает 200 молекул хлорофилла а, 200 молекул хлорофилла в и 1 молекулу хлорофилла-ловушки, поглощающую свет с длиной волны λ 680 нм (П680).
Общая схема нециклического и циклического фосфорилирования представлена на рис. 8.
При нециклическом потоке электронов принимают участие обе фотосистемы.
Энергия квантов света стекается к молекуле П700 (ФС I), которая выступает в виде ловушки. Электрон в молекуле П700 переходит на более высокий энергетический уровень (S1*).
Рис. 8. Схема нециклического и циклического транспорта электронов в хлоропластах
В основном состоянии потенциал П700 довольно высокий (+0,43В), следовательно, тенденция к потере электрона выражена очень слабо. Но при поглощении кванта света, молекула П700 переходит в возбужденное состояние и ее окислительно-восстановительный потенциал падает (-0,60В). Поэтому в возбужденном состоянии молекула П700 легко отдает свой электрон е- (фотохимическая реакция). Электрон передвигается по направлению к ферредоксину (водорастворимый FeS-белок, О/В потенциал - 0,43) через ряд переносчиков, расположенных в порядке возрастания О/В потенциала. От ферредоксина электрон передается на НАДФ (О/В потенциал – 0,32). Этот перенос осуществляется с помощью специфического белка-фермента (ферредоксин-НАДФ-редуктазы), коферментом которого является ФАД.
Отдав электрон, молекула П700 остается в виде ионизированной молекулы. При этом О/В потенциал П700 снова становится +0,43 (основное состояние), благодаря чему является прекрасным акцептором для следующих электронов.
Источником электрона, заполняющего электронную «дырку» П700 является ФС II. Ловушкой света в ФС II является молекула хлорофилла, поглощающая свет с длиной волны λ680нм (П680). Под влиянием поглощенного кванта коротковолнового красного света возбужденный электрон П680 воспринимается акцептором и передается дальше по цепи переносчиков на пластохинон (PQ – липидорастворимый переносчик протонов и электронов), который выполняет роль «челнока» (воспринимая 2е- от П680 и 2Н+ из стромы хлоропласта пластохинон восстанавливается – PQH2, затем подойдя к цитохромному комплексу и передав ему 2е- - вновь окисляется – одновременно в полость тилакоида выделяются 2Н+). От цитохромного комплекса электрон воспринимается медьсодержащим белком – пластоцианином и далее передается на молекулу П700,заполняя электронную «дырку».
Образовавшаяся электронная «дырка» в молекуле П680 действует как сильный окислитель и через ряд переносчиков при участии иона марганца отнимает электрон е- от воды. Этот электрон восстанавливает электронную «дырку» П680. Происходит фотолиз воды и выделение кислорода:
 2Н2О свет 4Н+ + 4е- + О2
2Н2О свет 4Н+ + 4е- + О2
Перенос электрона по цепи переносчиков от ФС II к ФС I сопровождается аккумуляцией энергии в АТФ. Механизм фосфорилирования АДФ, сопряженного с деятельностью электронтранспортной цепи, объясняет хемиосмотическая теория, разработанная английским биохимиком П. Митчеллом (1961-1966). Сущность хемиосмотической теории состоит в следующем: переносчики электронов локализованы в мембране (перпендикулярно мембране) в определенной последовательности. При этом последовательно чередуются переносчики электронов – цитохромы с переносчиками электронов и протонов – пластохинонами, т.е. трансмембранный перенос электронов и протонов чередуется с переносом в обратную сторону только электронов. Благодаря этому происходит односторонний перенос протонов с наружной стороны мембраны тилакоида на внутреннюю. В результате образуется градиент ионов водорода (образуется положительно заряженное электрическое поле) и соответственно на разных сторонах мембраны возникает разность потенциалов. По достижению критической разности потенциалов протоны Н+ начинают переходить через протонный канал в ферменте АТФ -синтетазы, встроенному в мембрану тилакоида и получившему название сопрягающего фактора (СФ), наружу. На выходе из СФ создается высокий уровень энергии, которая идет на образование высокоэнергетической фосфатной связи АТФ. Образовавшиеся молекулы АТФ переходят в строму, где участвуют в реакциях фиксации углерода. Локализация электрон- и протон-транспортных реакций в тилакоидной мембране, образование мембранного потенциала и перенос протонов во внутритилакоидное пространство показано на рисунке 9.
| |
| | 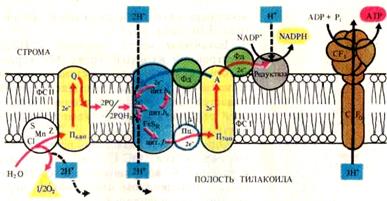 |
Рис. 9. Локализация электрон- и протон-транспортных реакций
В тилакоидной мембране
Протоны Н+, вышедшие на поверхность мембраны тилакоида, соединяются с электронами е-, образуя атомарный водород Н+, который восстанавливает НАДФ+:
2е- +2Н+ + НАДФ+ → НАДФ·Н2
Образовавшийся НАДФ·Н2 переходит в строму хлоропласта, где также участвует в реакциях фиксации углерода. Суммарное уравнение указанного процесса может выглядеть следующим образом:
2НАДФ + 2Н2О + 2АДФ + 2Н3РО4 + 8hγ → 2НАДФ · Н+ +2Н+ + 2АТФ + О2
Отличительными особенностями нециклического фотофосфолирования являются:
1) окисление двух молекул воды, происходящее в результате воздействия 8hγ света, которые улавливаются двумя фотосистемами;
2) передача электронов от молекул воды через электронно-транспортную цепь на НАДФ.
Продуктами процесса нециклического фотофосфорилирования являются восстановленный никотинамидадениндинуклеотидфосфат (НАДФ·Н2) и АТФ, которые используются в темновой фазе фотосинтеза.
В циклическом фотофосфорилировании принимает участие лишь фотосистема I. В результате поглощения квантов света П700 отдает возбужденный электрон на ферредоксин, который через ряд переносчиков возвращается к нему же обратно (рис.8,9). От ферредоксина электроны поступают на цитохромный комплекс через пластохинон, который действует как переносчик электронов и протонов. От цитохромного комплекса электроны поступают на пластоцианин, от которого возвращаются на основной энергетический уровень П700, а протоны поступают в полость тилакоида. Возникновение разности потенциалов обеспечивает затем синтез фосфатной связи АТФ в СФ.
Таким образом, П700 является и донором и акцептором электрона. Суммарное уравнение циклического фотофосфорилирования может выглядеть следующим образом:
АДФ+Н3РО4+hγ → АТФ + Н2О
Циклическое и нециклическое фотофосфорилирование принято включать в световую фазу фотосинтеза, однако свет необходим только на первых этапах этого процесса. Перенос электрона по цепи переносчиков может происходить и в темноте.
РДФ ФГК
2. Ф а з а в о с с т а н о в л е н и я. Дальнейшие превращения ФГК требуют участия продуктов световой фазы фотосинтеза: НАДФ·Н2 и АТФ. 3-ФГК восстанавливается до 3-фосфоглицеринового альдегида (3-ФГК) в два этапа. Сначала происходит фосфорилирование 3-ФГК при участии АТФ и фосфоглицераткиназы до 1,3-дифосфоглицириновой кислоты (1).
1.СООН СОО ~ (Р)
| |
6 СНОН + 6АТФ → 6 СНОН + 6АДФ
| |
СН2О (Р) СН2О (Р)
ФГК 1,3-ди ФГК
Образовавшееся в этой реакции соединение – дифосфоглицериновая кислота – обладает более высокой реакционной способностью, содержит макроэргическую связь. Затем карбоксильная группировка этого соединения восстанавливается до альдегидной с помощью триозофосфатдегидрогеназы, коферментом которой является НАДФ·Н2 (2).
2. СОО ~ (Р) СНО
| |
6 СНОН + 6НАДФ ·Н2 → 6СНОН + 6Н3РО4 + 6НАДФ
| |
СН2О (Р) СН2О (Р)
1,3-диФГК ФГА
Образовавшийся фосфоглицериновый альдегид претерпевает ряд превращений. Из шести молекул ФГА пять идут на регенерацию акцептора – рибулезодифосфата, а одна выходит из цикла, т.е. используется для синтеза глюкозы.
3. Ф а з а р е г е н е р а ц и и. Это фаза регенерации первичного акцептора и синтеза конечного продукта фотосинтеза. В этом процессе участвует пять молекул ФГА, в результате чего образуются три молекулы рибулезо-5-фосфата. Первая молекула 3- ФГА под действием триозофосфатизомеразы изомеризуется до фосфодиоксиацетона (ФДА).
ФДА при участии альдолазы взаимодействует со второй молекулой 3- ФГА с образованием фруктозо-1,6-дифосфата (ФДФ). От ФДФ с помощью фруктозо-1,6-дифосфатазы отщепляется фосфат – образуется фруктозо-6-фосфат (Ф-6-Ф). От Ф-6-Ф отщепляется 2-углеродный фрагмент (-СО-СН2ОН), который переносится на третью триозу. Эта транскетолазная реакция идет при участии фермента транскетолазы. В результате образуется первая пентоза – (С5) - рибулезофосфат. От Ф-6-Ф остается 4-углеродный сахар – эритрозофосфат (С4), который взаимодействует с четвертой триозой с образованием седогептулезодифосфата (С7). Седогептулезодифосфат дефосфорилируется, после чего он превращается в седогептулезофосфат. Затем снова происходит транскетолазная реакция – от седогептулезофосфата отщепляется 2-углеродный фрагмент, который переносится на пятую триозу. Образуются еще 2 молекулы рибулезофосфата.
Таким образом, в цикле Кальвина образуются три молекулы рибулезо-5-фосфата, с которых начинается новый цикл фиксации СО2.
Из оставшейся шестой неиспользованной молекулы триозы – 3-ФГА под действием альдолазы синтезируется (при повторении цикла) молекула фруктозо-1,6-дифосфата, из которой могут образоваться глюкоза, сахароза или крахмал. Общее суммарное уравнение двух циклов имеет следующий вид:
6РДФ + 6СО2 + 18АТФ + 12НАДФ·Н2 → 6РДФ + глюкоза + 18Фн + 18АДФ + 12НАДФ
Таким образом, для восстановления шести молекул СО2 до уровня углеводов (глюкозы) в цикле Кальвина требуется 12НАДФ·Н2 и 18АТФ, которые предоставляются в результате фотохимических реакций фотосинтеза.
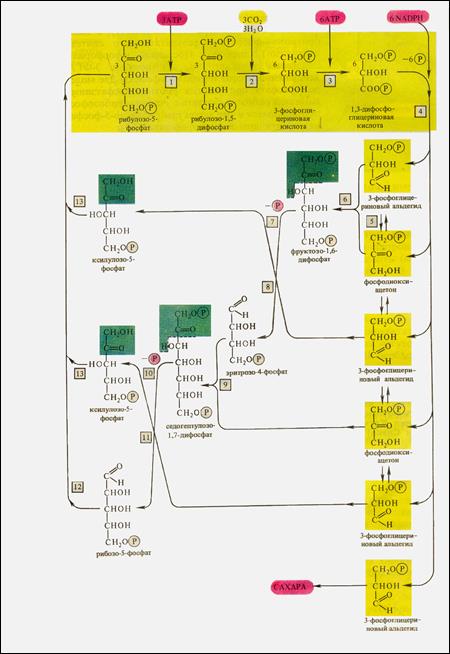
Все реакции входящие в цикл Кальвина представлены на рис.10.
| |
| | | Рис.10. Цикл Кальвина: 1-фосфорибулозокиназа, 2- рибулозодифосфаткарбоксилаза,3-фосфоглицераткиназа, 4-триозофосфатдигидрогеназа, 5-триозофосфатизомераза, 6-альдолаза, 7-фосфатаза, 8-транскетолаза, 9-альдолаза, 10-фофатаза, 11-транскетолаза, 12-рибозофосфатизомераза, 13-фосфокетопентоэпимераза
| |
Рис. 11. Примерный энергетический баланс листа растения
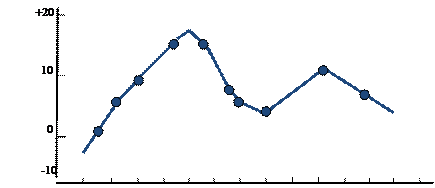
Суточные ритмы фотосинтеза можно представить в виде кривой (рис.12):

| 6 8 10 12 14 16 18
Время суток,ч
| |
Рис. 12. Суточный ход интенсивности фотосинтеза
С восходом солнца интенсивность фотосинтеза возрастает вместе с освященностью, достигая максимумов в 9-10 ч. Дальнейший характер процесса определяется степенью оводненности листьев, температурой воздуха, интенсивностью солнечного света, содержанием СО2 в воздухе и т.д.
В нормальных для фотосинтеза условиях процесс протекает неравномерно в течение дня. Утром, к 9-10 ч, наблюдается наиболее интенсивный фотосинтез, затем к 12 часам по мере накопления крахмала и уменьшения количества воды в листьях интенсивность снижается и опять возрастает ко второй половине дня – к 17-18 ч.
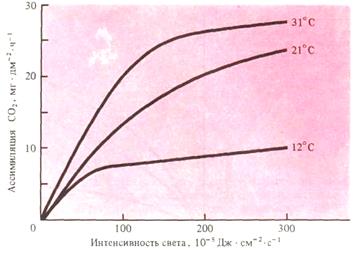
Свет. Если расположить факторы, от которых зависит фотосинтез, по их значению, на первое место следует поставить свет. В целом зависимость фотосинтеза от интенсивности освещения может быть выражена логарифмической кривой (рис.13).
Первоначально увеличение интенсивности освещения приводит к пропорциональному усилению фотосинтеза (зона максимального эффекта). При дальнейшем увеличении интенсивности света фотосинтез продолжает расти, но медленнее (зона ослабленного эффекта). И, наконец, интенсивность света растет, а фотосинтез не изменяется (зона отсутствия эффекта).
Наклон кривых, выражающих зависимость интенсивности фотосинтеза от освещенности, различен для разных растений. Есть растения, у которых фотосинтез возрастает вплоть до освещения их прямыми лучами.

Рис.13. Зависимость интенсивности фотосинтеза от освещения у кукурузы
Вместе с тем для многих растений увеличение интенсивности освещения свыше 50% от прямого солнечного света оказывается излишним. Это связано с тем, что конечный выход продуктов фотосинтеза зависит от скорости не столько световых, сколько темновых реакций.
Температура. Общая зависимость фотосинтеза от температуры выражается одновершинной кривой (рис.14). Кривая имеет три основные (кардинальные) температурные точки: минимальную, при которой начинается фотосинтез, оптимальную и максимальную. Нижняя температурная граница фотосинтеза у растений северных широт находится в пределах -15°С (сосна, ель), а у тропических растений – в зоне низких положительных температур – 4-8°С. У растений умеренного пояса в интервале 20-25°С достигается максимальная интенсивность фотосинтеза, а дальнейшее повышение температуры до 40°С приводит к быстрому ингибированию процесса.
Влияние на интенсивность фотосинтеза света, концентрации СО2 и температуры осуществляется в сложном взаимодействии. Особенно тесно взаимосвязаны свет, действующий на скорость фотохимических реакций, и температура, контролирующая скорость энзиматических реакций (рис.15).
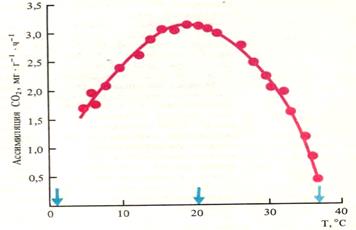
Рис. 14. Зависимость интенсивности фотосинтеза ели от температуры
Рис.15. Взаимовлияние интенсивности света и температуры на скорость фотосинтеза
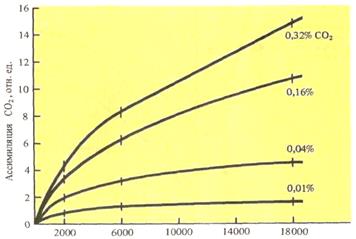
СО2. Основным субстратом фотосинтеза является СО2: его содержание определяет интенсивность процесса. Концентрация СО2 в атмосфере составляет 0,03%. Процесс фотосинтеза осуществляется при содержании СО2 не менее 0,008%. Повышение содержания СО2 до 1,5% вызывает прямо пропорциональное возрастание интенсивности процесса фотосинтеза. При повышении содержания СО2 свыше 1,5% фотосинтез продолжает расти, но уже значительно медленнее. При увеличении содержания СО2 до 15-20% процесс фотосинтеза выходит на плато (отсутствие эффекта). При содержании СО2 выше 70% наступает депрессия фотосинтеза (рис. 16).
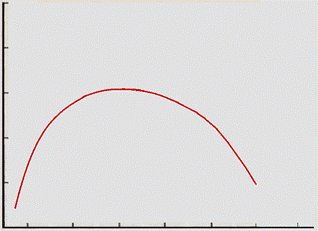
Рис. 16. Зависимость интенсивности фотосинтеза от концентрации СО2
Взаимовлияние концентрации СО2 и интенсивности света на скорость фотосинтеза показано на рисунке 17.
Рис.17. Взаимовлияние концентрации СО2 и интенсивности света на скорость фотосинтеза
Водный фактов имеет первоочередное значение для нормального осуществления фотосинтетических функций растений. Значение воды в фотосинтезе обусловливается ее участием в фотохимических и энзиматических реакциях. От степени оводненности тканей растения зависит поглощение энергии солнечной радиации, поступление и ассимиляция углекислого газа, направленность ферментативных реакций, интенсивность транспирации и т.д. Водный дефицит приводит к снижению интенсивности фотосинтеза, которое связано с закрыванием устьиц, что уменьшает диффузию СО2 в лист, к ингибированию циклического и нециклического транспорта электронов и фотофосфорилирования, к снижению активности ферментов, участвующих в темновой фазе фотосинтеза.
Минеральное питание. Для нормального функционирования фотосинтетического аппарата растение должно быть обеспечено всем комплексом макро- и микроэлементов. Два основных процесса питания растительного организма - воздушный и корневой – тесно взаимосвязаны. Многие соединения, функционирующие как переносчики, содержат такие элементы как железо (цитохромы, ферредоксин), медь (пластоцианин). Хлорофилл содержит магний. При недостатке этих элементов интенсивность фотосинтеза понижается.
На интенсивность процесса фотосинтеза влияют и внутренние факторы: содержание хлорофилла, возраст ассимилирующего органа, степень открытости устьиц.
Содержание хлорофилла. Интенсивность фотосинтеза возрастает с увеличением содержания хлорофилла. Содержание хлорофилла и интенсивность освещения можно рассматривать как единый фактор, определяющий поглощение света. При высокой интенсивности света даже сравнительно небольшое количество хлорофилла может поглощать его достаточно, для того чтобы было достигнуто световое насыщение.
Отток ассимилятов. Депрессия фотосинтеза часто связана с нарушением оттока ассимилятов.При нарушении оттока ассимилятов, продукты фотосинтеза (конечные или промежуточные) переполняют клетки и препятствуют их новообразованию, а также они блокируют некоторые ферменты фотосинтетического цикла.
Возраст листа. По мере роста листьев интенсивность фотосинтеза повышается. Наибольшая интенсивность характерна для вполне сформировавшихся листьев. По мере дальнейшего увеличения возраста листьев интенсивность фотосинтеза падает. На интенсивность фотосинтеза оказывает влияние возраст всего растения. У большинства однолетних растений интенсивность фотосинтеза возрастает в процессе онтогенеза и достигает максимума в фазу бутонизации и цветения. После цветения интенсивность фотосинтеза в листьях снижается.
Степень открытости устьиц. В том случае, если содержание воды поддерживается в листе на достаточно высоком уровне, увеличение ширины устьичных щелей, как правило, сопровождается увеличением интенсивности фотосинтеза. При полном закрытии устьиц фотосинтез протекает, но в очень слабой степени.
Влияние внешних и внутренних факторов на интенсивность фотосинтеза можно представить в виде схемы (рис. 18).

Рис.18. Влияние внешних и внутренних факторов на интенсивность фотосинтеза
Содержание
Предисловие. 3
Фотосинтез. 5
Световая фаза фотосинтеза. 9
Темновая фаза фотосинтеза. 17
Влияние внешних и внутренних факторов на
интенсивность процесса фотосинтеза 22
Значение процесса фотосинтеза. 30
Учебное издание
ХАШИЕВА ЛИДА СУЛТАНОВНА
ФОТОСИНТЕЗ
[1] Электрон, кроме того, что он находится на определенной орбитали и вращается вокруг ядра, обладает еще и спином – направлением вращения электрона вокруг своей оси. Спины двух электронов, находящихся на одной орбитали, различны по направлению.
[2] Флуоресценция – свеч







 молекулярная масса 893) и хлорофиллы б (C55H70O6N4Mg, молекулярная масса 907), в бактериях содержится бактериохлорофилл (C55H74O6N4Mg, молекулярная масса 911).
молекулярная масса 893) и хлорофиллы б (C55H70O6N4Mg, молекулярная масса 907), в бактериях содержится бактериохлорофилл (C55H74O6N4Mg, молекулярная масса 911). Фикобилины – это пигменты, которые содержатся в красных и синезеленых водорослях и относятся к группе желчных пигментов – билинов. Характерный пигмент красных водорослей – фикоэритробилин (C34H47N4O8), пигмент сине-зеленых водорослей – фикоцианобилин (C34H42N4O9).
Фикобилины – это пигменты, которые содержатся в красных и синезеленых водорослях и относятся к группе желчных пигментов – билинов. Характерный пигмент красных водорослей – фикоэритробилин (C34H47N4O8), пигмент сине-зеленых водорослей – фикоцианобилин (C34H42N4O9).

 Молекула хлорофилла-ловушки характеризуется поглощением в наиболее длинноволновой части солнечного спектра – 700 нм и обозначается как пигмент 700 (П700). Перенос энергии происходит только от пигментов, поглощающих свет с меньшей длиной волны, к пигментам, поглощающим свет с большей длиной волны. Затем эта энергия переносится через хлорофилл-ловушку в реакционный центр, где используется в фотохимических реакциях. Дальнейшее превращение энергии света в химическую энергию проходит в ряд этапов, начиная с окислительно-восстановительных превращений хлорофилла, включая как фотохимические (световые), так и энзиматические (темновые) реакции. Фотохимические реакции – это реакции, в которых энергия света преобразуется в энергию химических связей.
Молекула хлорофилла-ловушки характеризуется поглощением в наиболее длинноволновой части солнечного спектра – 700 нм и обозначается как пигмент 700 (П700). Перенос энергии происходит только от пигментов, поглощающих свет с меньшей длиной волны, к пигментам, поглощающим свет с большей длиной волны. Затем эта энергия переносится через хлорофилл-ловушку в реакционный центр, где используется в фотохимических реакциях. Дальнейшее превращение энергии света в химическую энергию проходит в ряд этапов, начиная с окислительно-восстановительных превращений хлорофилла, включая как фотохимические (световые), так и энзиматические (темновые) реакции. Фотохимические реакции – это реакции, в которых энергия света преобразуется в энергию химических связей.
 2Н2О свет 4Н+ + 4е- + О2
2Н2О свет 4Н+ + 4е- + О2