Учение о растворах. Основные понятия
Раствором называется гомогенная смесь, состоящая из двух или большего числа веществ, состав которой может непрерывно изменяться в пределах области растворимости.
От гетерогенных смесей растворы отличаются размером частиц. Принимается, что истинный раствор образуют частицы с диаметром меньше 1 нм, а при размере частиц больше 100 нм они образуют гетерогенную смесь. Между истинными растворами и механическими смесями находятся коллоидные растворы. От химических соединений растворы отличаются переменностью состава и характером сил связи. В растворах это преимущественно не валентные, а ван–дер–ваальсовы взаимодействия, хотя в ряде случаев большое количество выделяющейся при растворении теплоты свидетельствует о возможном образовании химических соединений между компонентами раствора (например, в системе вода – серная кислота).
Образование раствора из компонентов является самопроизвольным процессом, при протекании которого в изобарно – изотермических условиях энергия Гиббса уменьшается (∆G<0), что может быть обусловлено энтальпийным и энтропийным вкладами.
Компоненты, при смешении которых получается раствор, изначально могут быть в различных агрегатных состояниях (газ – газ, газ – жидкость, жидкость – жидкость, жидкость – твердое, твердое –твердое). Образующиеся растворы могут быть газообразными, жидкими или твердыми.
Газообразные гомогенные системы при нормальных условиях образуются, как правило, в результате смешивания газов. Эти газовые смеси подчиняются закону Дальтона: парциальное давление i -го компонента смеси pi пропорционально его мольной доле Xi, а общее давление p равно сумме парциальных давлений компонентов:
pi = pX i; ∑ pi = p.
Твердые растворы могут образовываться при кристаллизации жидких расплавов или при растворении газов в твердых веществах.
Наиболее распространенным типом твердых растворов являются растворы замещения, реже встречаются твердые растворы внедрения.
Твердые растворы замещения образуются, если атомы растворяющего А и растворяемого Б элементов по своим размерам отличаются незначительно; в этом случае в кристаллической решетке атомы элемента А частично замещаются атомами элемента Б (рис. 23.1, a). Если же атомы растворяемого элемента B заметно меньше атомов элемента А, то при кристаллизации расплава атомы вещества B размещаются в пустотах кристаллической решетки элемента А и образуется твердый раствор внедрения (рис. 23.1, b).
Вещества, образующие твердые гомогенные системы при любом соотношении компонентов (т. е. неограниченно растворимые друг в друге), встречаются редко (обычно это твердые растворы замещения). Достаточно редко встречаются и вещества, практически полностью не растворимые друг в друге в твердом состоянии. Чаще наблюдается ограниченная взаимная растворимость веществ, охватывающая более или менее широкий интервал составов.Наиболее распространенным типом растворов являются жидкие гомогенные системы, образующиеся при растворении в жидкостях газов, твердых веществ и других жидкостей.


a) b)





Б A B Рис. 23.1. Схемы образования растворов замещения (a) и внедрения (b) Газы и твердые вещества растворяются в жидкостях лишь до определенных концентраций. Когда химический потенциал растворяемого вещества в растворе становится равным его химическому потенциалу в чистом виде, растворение прекращается (∆G=0). При этом образуется
насыщенный раствор. Если же оба компонента являются жидкостями, то нередко гомогенные системы (растворы) образуются при смешении их в любых пропорциях.Жидкие растворы играют огромную роль в природе и технике, а учение о растворах представляет собой важный раздел физической химии.Вследствие сложности и многообразия межчастичных взаимодействий в растворах, связанных с химическими свойствами индивидуальных элементов, исчерпывающей теории растворов в настоящее время не существует. Исключением являются некоторые простые классы растворов: идеальные, атермальные и регулярные, свойства которых могут быть вычислены на основании теоретических представлений.
Идеальными называют растворы, в которых энергии взаимо

действия между однородными и разнородными частицами связаны соотношением
ε
AB = (ε
AA + ε
BB ) / 2 или ε
AB = ε
AA ⋅ ε
BB. Идеальный раствор образуется без поглощения и выделения теплоты и объем раствора равен сумме объемов компонентов: ∆H смешения = 0 и ∆Vсмешения = 0, а ∆S смешения = −(∂∆G ∂T) p. К таким растворам можно отнести смеси сходных по химическому составу веществ (например, бромбензол — хлорбензол, гексан — гептан, и т.д.), стереоизомеров, соседей по гомологическому ряду, а также предельно (бесконечно) разбавленные растворы, которые являются идеальными по растворителю (добавление растворителя в такой раствор не вызывает выделения или поглощения теплоты).К числу простых систем можно отнести также растворы, у которых равны нулю не обе, а лишь одна из этих величин. Это
регулярные растворы, у которых ∆V
смешения = 0 и ∆S
смешения = −(∂∆G ∂T)
p, но ∆H смешения ≠ 0, и
атермальные растворы, у которых ∆H смешения = 0, но ∆Vсмешения ≠ 0 и ∆S смешения ≠ −(∂∆G ∂T)
p. Свойства таких растворов тоже могут быть вычислены на основе теоретических представлений.
Способы выражения состава многокомпонентных систем и соотношения между ними Состав многокомпонентной системы количественно может быть выражен различными способами: либо (в долях единицы или в процентах) через безразмерные относительные величины (массовые, объемные или мольные доли), либо через размерные величины - концентрации (молярность, моляльность, массовое содержание).Вещество, которое имеется в растворе в большем количестве, называют
растворителем, а остальные компоненты раствора -
растворенными веществами. Таблица 1Способы количественного выражения состава многокомпонентной системы
| Массовая доля
i–го компонента
ωi
| отношение массы i–го компонента gi к общей массе системы
| ωi = g i/ ∑ g i ;
ω% = ω ⋅ 100
|
| Мольная доля
i–го компонента
Xi
| отношение числа молей i-го компонента Ni к общему числу молей всех компонентов системы
| X i = Ni /∑ Ni;
X % = X ⋅100
|
| Молярность
C
| Число молей растворенного
вещества в 1 л раствора
| Ci = N i /Vр - ра ,
моль/л
|
| Моляльность
m
| Число молей растворенного вещества в 1 кг растворителя
| mi = N i /g р- ля,
моль/кг
|
Необходимо четко различать понятия раствор и растворитель: объем раствора
V
р-ра - это объем растворителя со всеми растворенными в нем веществами, а масса
g
р-ля - это масса чистого растворителя.Для двухкомпонентных растворов соотношения между составами, выраженными различными способами, приведены в табл. 2.Таблица 2Формулы пересчета составов для двухкомпонентных систем
Здесь M
р-ля и M - молярные массы растворителя и растворенного вещества (г/моль); ρ - плотность раствора (г/см
3). Для водных растворов (концентрация воды в воде) 1000 / M
р - ля = 1000 /18 = 55,51 моль/л.
Учение о растворах. Основные понятия
Раствором называется гомогенная смесь, состоящая из двух или большего числа веществ, состав которой может непрерывно изменяться в пределах области растворимости.
От гетерогенных смесей растворы отличаются размером частиц. Принимается, что истинный раствор образуют частицы с диаметром меньше 1 нм, а при размере частиц больше 100 нм они образуют гетерогенную смесь. Между истинными растворами и механическими смесями находятся коллоидные растворы. От химических соединений растворы отличаются переменностью состава и характером сил связи. В растворах это преимущественно не валентные, а ван–дер–ваальсовы взаимодействия, хотя в ряде случаев большое количество выделяющейся при растворении теплоты свидетельствует о возможном образовании химических соединений между компонентами раствора (например, в системе вода – серная кислота).
Образование раствора из компонентов является самопроизвольным процессом, при протекании которого в изобарно – изотермических условиях энергия Гиббса уменьшается (∆G<0), что может быть обусловлено энтальпийным и энтропийным вкладами.
Компоненты, при смешении которых получается раствор, изначально могут быть в различных агрегатных состояниях (газ – газ, газ – жидкость, жидкость – жидкость, жидкость – твердое, твердое –твердое). Образующиеся растворы могут быть газообразными, жидкими или твердыми.
Газообразные гомогенные системы при нормальных условиях образуются, как правило, в результате смешивания газов. Эти газовые смеси подчиняются закону Дальтона: парциальное давление i -го компонента смеси pi пропорционально его мольной доле Xi, а общее давление p равно сумме парциальных давлений компонентов:
pi = pX i; ∑ pi = p.
Твердые растворы могут образовываться при кристаллизации жидких расплавов или при растворении газов в твердых веществах.
Наиболее распространенным типом твердых растворов являются растворы замещения, реже встречаются твердые растворы внедрения.
Твердые растворы замещения образуются, если атомы растворяющего А и растворяемого Б элементов по своим размерам отличаются незначительно; в этом случае в кристаллической решетке атомы элемента А частично замещаются атомами элемента Б (рис. 23.1, a). Если же атомы растворяемого элемента B заметно меньше атомов элемента А, то при кристаллизации расплава атомы вещества B размещаются в пустотах кристаллической решетки элемента А и образуется твердый раствор внедрения (рис. 23.1, b).
Вещества, образующие твердые гомогенные системы при любом соотношении компонентов (т. е. неограниченно растворимые друг в друге), встречаются редко (обычно это твердые растворы замещения). Достаточно редко встречаются и вещества, практически полностью не растворимые друг в друге в твердом состоянии. Чаще наблюдается ограниченная взаимная растворимость веществ, охватывающая более или менее широкий интервал составов.Наиболее распространенным типом растворов являются жидкие гомогенные системы, образующиеся при растворении в жидкостях газов, твердых веществ и других жидкостей.


a) b)





Б A B Рис. 23.1. Схемы образования растворов замещения (a) и внедрения (b) Газы и твердые вещества растворяются в жидкостях лишь до определенных концентраций. Когда химический потенциал растворяемого вещества в растворе становится равным его химическому потенциалу в чистом виде, растворение прекращается (∆G=0). При этом образуется
насыщенный раствор. Если же оба компонента являются жидкостями, то нередко гомогенные системы (растворы) образуются при смешении их в любых пропорциях.Жидкие растворы играют огромную роль в природе и технике, а учение о растворах представляет собой важный раздел физической химии.Вследствие сложности и многообразия межчастичных взаимодействий в растворах, связанных с химическими свойствами индивидуальных элементов, исчерпывающей теории растворов в настоящее время не существует. Исключением являются некоторые простые классы растворов: идеальные, атермальные и регулярные, свойства которых могут быть вычислены на основании теоретических представлений.
Идеальными называют растворы, в которых энергии взаимо

действия между однородными и разнородными частицами связаны соотношением
ε
AB = (ε
AA + ε
BB ) / 2 или ε
AB = ε
AA ⋅ ε
BB. Идеальный раствор образуется без поглощения и выделения теплоты и объем раствора равен сумме объемов компонентов: ∆H смешения = 0 и ∆Vсмешения = 0, а ∆S смешения = −(∂∆G ∂T) p. К таким растворам можно отнести смеси сходных по химическому составу веществ (например, бромбензол — хлорбензол, гексан — гептан, и т.д.), стереоизомеров, соседей по гомологическому ряду, а также предельно (бесконечно) разбавленные растворы, которые являются идеальными по растворителю (добавление растворителя в такой раствор не вызывает выделения или поглощения теплоты).К числу простых систем можно отнести также растворы, у которых равны нулю не обе, а лишь одна из этих величин. Это
регулярные растворы, у которых ∆V
смешения = 0 и ∆S
смешения = −(∂∆G ∂T)
p, но ∆H смешения ≠ 0, и
атермальные растворы, у которых ∆H смешения = 0, но ∆Vсмешения ≠ 0 и ∆S смешения ≠ −(∂∆G ∂T)
p. Свойства таких растворов тоже могут быть вычислены на основе теоретических представлений.
Способы выражения состава многокомпонентных систем и соотношения между ними Состав многокомпонентной системы количественно может быть выражен различными способами: либо (в долях единицы или в процентах) через безразмерные относительные величины (массовые, объемные или мольные доли), либо через размерные величины - концентрации (молярность, моляльность, массовое содержание).Вещество, которое имеется в растворе в большем количестве, называют
растворителем, а остальные компоненты раствора -
растворенными веществами. Таблица 1Способы количественного выражения состава многокомпонентной системы
| Массовая доля
i–го компонента
ωi
| отношение массы i–го компонента gi к общей массе системы
| ωi = g i/ ∑ g i ;
ω% = ω ⋅ 100
|
| Мольная доля
i–го компонента
Xi
| отношение числа молей i-го компонента Ni к общему числу молей всех компонентов системы
| X i = Ni /∑ Ni;
X % = X ⋅100
|
| Молярность
C
| Число молей растворенного
вещества в 1 л раствора
| Ci = N i /Vр - ра ,
моль/л
|
| Моляльность
m
| Число молей растворенного вещества в 1 кг растворителя
| mi = N i /g р- ля,
моль/кг
|
Необходимо четко различать понятия раствор и растворитель: объем раствора
V
р-ра - это объем растворителя со всеми растворенными в нем веществами, а масса
g
р-ля - это масса чистого растворителя.Для двухкомпонентных растворов соотношения между составами, выраженными различными способами, приведены в табл. 2.Таблица 2Формулы пересчета составов для двухкомпонентных систем
Здесь M
р-ля и M - молярные массы растворителя и растворенного вещества (г/моль); ρ - плотность раствора (г/см
3). Для водных растворов (концентрация воды в воде) 1000 / M
р - ля = 1000 /18 = 55,51 моль/л.
Равновесие жидкость-жидкость в двухкомпонентных системах
В процессе растворения частицы одного вещества в результате теплового движения распределяются среди частиц другого вещества и могут при этом вступать в различные взаимодействия химического и физического характера. Этот процесс является самопроизвольным: при протекании его в изобарно-изотермических условиях потенциал Гиббса уменьшается.
Поскольку Δ G = Δ Н – T Δ S, где Δ Н - тепловой эффект процесса растворения и Δ S - изменение энтропии при растворении, то знак Δ G определяется соотношением между энтропийным (T Δ S) и энтальпийным ( Δ Н) факторами. Знак и абсолютная величина Δ Н зависят, в свою очередь, от соотношения энергий взаимодействия s между однородными ( ε AА, ε BB) и разнородными ( ε AB) частицами.
Если  , то смешение жидких компонентов А и В происходит без поглощения и выделения теплоты, т. е. Δ Н = 0 (см. раздел 3.2.1). Но при этом Δ S > 0, так как энтропия смеси больше суммы энтропий исходных жидкостей. В результате Δ G <0 и, следовательно, при любых соотношениях компонентов АиВнаблюдается полная взаимная растворимость их друг в друге, что обусловлено величиной энтропийного фактора.
, то смешение жидких компонентов А и В происходит без поглощения и выделения теплоты, т. е. Δ Н = 0 (см. раздел 3.2.1). Но при этом Δ S > 0, так как энтропия смеси больше суммы энтропий исходных жидкостей. В результате Δ G <0 и, следовательно, при любых соотношениях компонентов АиВнаблюдается полная взаимная растворимость их друг в друге, что обусловлено величиной энтропийного фактора.
Если  и
и  , то энергия, затрачиваемая на разрыв связей между однородными молекулами, меньше энергии, выделяющейся при образовании связей между разнородными молекулами, т. е. при растворении происходит выделение теплоты (Δ H < 0). И хотя вследствие образования соединениями энтропия несколько уменьшается, однако часто (а именно в случаях, когда |Δ H | > | T Δ S | в результате получается, что Δ G < 0, т. е. тоже наблюдается полная взаимная растворимость жидкостей, но она обусловлена влиянием энтальпийного фактора.
, то энергия, затрачиваемая на разрыв связей между однородными молекулами, меньше энергии, выделяющейся при образовании связей между разнородными молекулами, т. е. при растворении происходит выделение теплоты (Δ H < 0). И хотя вследствие образования соединениями энтропия несколько уменьшается, однако часто (а именно в случаях, когда |Δ H | > | T Δ S | в результате получается, что Δ G < 0, т. е. тоже наблюдается полная взаимная растворимость жидкостей, но она обусловлена влиянием энтальпийного фактора.
Напротив, если  и
и 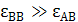 , то при растворении должно поглощаться очень большое количество теплоты ( Δ Н
, то при растворении должно поглощаться очень большое количество теплоты ( Δ Н  0), причем |Δ H |
0), причем |Δ H |  | T Δ S |. В результате
| T Δ S |. В результате
Δ G > 0, т. е. жидкости практически не растворимы друг в друге. При попытке смешать их происходит расслоение и образуются две жидкие фазы (например, керосин-вода, ртуть-вода).
Промежуточное положение между этими двумя предельными случаями занимают системы с ограниченной взаимной растворимостью. У них соотношение энтропийного и энтальпийного вкладов в величину A G меняется при изменении концентрации и температуры таким образом, что в определенной области температур и составов ∆ G > 0 и наблюдается расслоение, тогда как вне этой области ∆ G < 0 и смешиваемые жидкости образуют гомогенный раствор.

Рис. 23.2. Диаграмма состав–температура для двухкомпонентных систем с различной взаимной растворимостью.
Диаграммы состав–температура для таких систем представлены на рис. 23.2; они построены при давлении, превышающем давление насыщенного пара в данной системе, поэтому область пара на диаграммах отсутствует.
В самом общем случае граница между гомогенной и гетерогенной областями является замкнутой кривой (рис. 32.2 a). Вне этой кривой система представляет собой одну гомогенную жидкую фазу – раствор, компонентами которого являются жидкости A и B (k = 2, f = 1, s = 2). Внутри этой кривой система гетерогенна: в ней сосуществуют две жидкие фазы – насыщенный раствор B в A и насыщенный раствор A в B (k = 2, f = 2, s = 1). Составы равновесных фаз при любой заданной температуре можно определить, проведя ноду.
В этих системах (рис. 23.2 a) взаимная растворимость жидкостей увеличивается как с повышением, так и с понижением температуры: составы равновесных фаз постепенно сближаются и, наконец, становятся одинаковыми при достижении верхней или нижней критической температуры растворения (ВКТР и НКТР). Положение критических точек на диаграмме определяется по приближенному правилу прямолинейного диаметра В. Ф. Алексеева: если состав системы выражен в массовых долях или массовых процентах, то середины нод, расположенных между точками, изображающими составы равновесных жидких фаз при разных температурах, лежат на одной прямой, идущей от ВКТР или НКТР (рис. 9.2 a):
a ′ k ′ = k ′ b ′; a ′′ k ′′ = k ′′ b ′′ и т. д.
Системы, обладающие обеими критическими точками растворения, наблюдаются редко (вода – никотин, вода – метилэтилкетон). Обычно либо кристаллизация в одной из жидких фаз начнется прежде, чем температура системы опустится до НКТР (анилин – вода, фенол – вода; рис. 23.2 b), либо один из компонентов достигнет критического состояния раньше, чем температура системы поднимется до ВКТР (диэтиламин – вода, триэтиламин – вода; рис.23.2 c), либо, наконец, из-за влияния обоих этих факторов не удается наблюдать ни ВКТР, ни НКТР (хлороформ – вода, диметиловый эфир – вода; рис. 23.2 d).
Анализ диаграмм состав–температура для жидкостей с ограниченной взаимной растворимостью и расчеты по этим диаграммам выполняются так же, как показано в лекциях по фазовым равновесиям.
Например, для того, чтобы рассмотреть фазовые переходы в системе, вызванные изменением состава при постоянной температуре T x (рис. 23.2 b), надо перемещать фигуративную точку по горизонтали ab. Если фигуративная точка совпадает с точкой a, в системе имеется один компонент – жидкость A. Добавление к жидкости A второго компонента – жидкости B – приводит к смещению точки вправо. Система остается жидкой однофазной; увеличивается только концентрация вещества B в растворе. Пересечение горизонтали ab с левой ветвью кривой растворения (называемой бинодалью) в точке a 1 показывает, что при этой концентрации раствор стал насыщенным раствором B в A. При дальнейшем добавлении вещества B, когда фигуративная точка займет место на отрезке между точками a 1 и b 1, система станет двухфазной. Кроме жидкой фазы – насыщенного раствора B в A (a 1) – появится другая жидкая фаза, отделенная от первой четкой поверхностью раздела. Состав новой фазы показывает второй конец ноды a 1 b 1 – это насыщенный раствор A в B (b 1). Характерной особенностью расслаивающихся систем является то, что при постоянной температуре составы равновесных фаз не меняются при изменении состава всей системы. Изменяется только их количественное соотношение, которое можно рассчитать, используя правило рычага. Например, для системы, общий состав которой характеризуется точкой k 2, составы сопряженных насыщенных растворов B в A и A в B характеризуются точками a 1 и b 1 соответственно, но масса раствора B в A больше массы раствора A в B, поскольку b 1 k 2> k 2 a 1. А для системы, характеризуемой точкой k 3, сопряженные фазы имеют те же составы, но их массы равны, потому что a 1 k 3= k 3 b 1.
Когда фигуративная точка, смещаясь вправо при добавлении вещества B, совпадет с точкой b 1, лежащей на правой ветви бинодали, поверхность раздела фаз исчезнет и система снова станет гомогенной – насыщенным раствором вещества A в B. При добавлении к системе дополнительного количества вещества B она будет оставаться гомогенной, только концентрация вещества A в растворе будет уменьшаться.
Таким образом, в пределах гомогенной зоны можно одновременно и произвольно изменять два параметра – температуру и состав раствора, не вызывая этим изменения числа и характера равновесных фаз (s = 2). А в пределах гетерогенной зоны каждой температуре соответствует вполне определенный состав сопряженных фаз, и произвольно можно изменять только один из этих параметров (s = 1).




 a) b)
a) b) 



 Б A B Рис. 23.1. Схемы образования растворов замещения (a) и внедрения (b) Газы и твердые вещества растворяются в жидкостях лишь до определенных концентраций. Когда химический потенциал растворяемого вещества в растворе становится равным его химическому потенциалу в чистом виде, растворение прекращается (∆G=0). При этом образуется насыщенный раствор. Если же оба компонента являются жидкостями, то нередко гомогенные системы (растворы) образуются при смешении их в любых пропорциях.Жидкие растворы играют огромную роль в природе и технике, а учение о растворах представляет собой важный раздел физической химии.Вследствие сложности и многообразия межчастичных взаимодействий в растворах, связанных с химическими свойствами индивидуальных элементов, исчерпывающей теории растворов в настоящее время не существует. Исключением являются некоторые простые классы растворов: идеальные, атермальные и регулярные, свойства которых могут быть вычислены на основании теоретических представлений. Идеальными называют растворы, в которых энергии взаимо
Б A B Рис. 23.1. Схемы образования растворов замещения (a) и внедрения (b) Газы и твердые вещества растворяются в жидкостях лишь до определенных концентраций. Когда химический потенциал растворяемого вещества в растворе становится равным его химическому потенциалу в чистом виде, растворение прекращается (∆G=0). При этом образуется насыщенный раствор. Если же оба компонента являются жидкостями, то нередко гомогенные системы (растворы) образуются при смешении их в любых пропорциях.Жидкие растворы играют огромную роль в природе и технике, а учение о растворах представляет собой важный раздел физической химии.Вследствие сложности и многообразия межчастичных взаимодействий в растворах, связанных с химическими свойствами индивидуальных элементов, исчерпывающей теории растворов в настоящее время не существует. Исключением являются некоторые простые классы растворов: идеальные, атермальные и регулярные, свойства которых могут быть вычислены на основании теоретических представлений. Идеальными называют растворы, в которых энергии взаимо  действия между однородными и разнородными частицами связаны соотношением
действия между однородными и разнородными частицами связаны соотношением 





 , то смешение жидких компонентов А и В происходит без поглощения и выделения теплоты, т. е. Δ Н = 0 (см. раздел 3.2.1). Но при этом Δ S > 0, так как энтропия смеси больше суммы энтропий исходных жидкостей. В результате Δ G <0 и, следовательно, при любых соотношениях компонентов АиВнаблюдается полная взаимная растворимость их друг в друге, что обусловлено величиной энтропийного фактора.
, то смешение жидких компонентов А и В происходит без поглощения и выделения теплоты, т. е. Δ Н = 0 (см. раздел 3.2.1). Но при этом Δ S > 0, так как энтропия смеси больше суммы энтропий исходных жидкостей. В результате Δ G <0 и, следовательно, при любых соотношениях компонентов АиВнаблюдается полная взаимная растворимость их друг в друге, что обусловлено величиной энтропийного фактора. и
и  , то энергия, затрачиваемая на разрыв связей между однородными молекулами, меньше энергии, выделяющейся при образовании связей между разнородными молекулами, т. е. при растворении происходит выделение теплоты (Δ H < 0). И хотя вследствие образования соединениями энтропия несколько уменьшается, однако часто (а именно в случаях, когда |Δ H | > | T Δ S | в результате получается, что Δ G < 0, т. е. тоже наблюдается полная взаимная растворимость жидкостей, но она обусловлена влиянием энтальпийного фактора.
, то энергия, затрачиваемая на разрыв связей между однородными молекулами, меньше энергии, выделяющейся при образовании связей между разнородными молекулами, т. е. при растворении происходит выделение теплоты (Δ H < 0). И хотя вследствие образования соединениями энтропия несколько уменьшается, однако часто (а именно в случаях, когда |Δ H | > | T Δ S | в результате получается, что Δ G < 0, т. е. тоже наблюдается полная взаимная растворимость жидкостей, но она обусловлена влиянием энтальпийного фактора. и
и 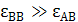 , то при растворении должно поглощаться очень большое количество теплоты ( Δ Н
, то при растворении должно поглощаться очень большое количество теплоты ( Δ Н  0), причем |Δ H |
0), причем |Δ H | 



