Химическая связь может возникнуть при электростатическом притяжении двух разноименных ионов - катиона и аниона, например, K+ и I−. Перекрывание атомных орбиталей в этом случае незначительно, и электронная плотность распределена неравномерно, недостаток её будет у атома калия, а избыток - у атома иода.
Ионную связь (K+)−(I−) рассматривают как предельный случай ковалентной связи.
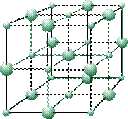 кристаллическая решетка иодида калия кристаллическая решетка иодида калия
| Общая пара электронов в случае ионной связи практически полностью смещена к аниону. Обычно это происходит в соединениях элементов с большой разностью электроотрицательности (например, в соединениях CsF, NaBr, K2O, Rb2S, Li3N и др.).
Все эти соединения при обычных условиях представляют собой ионные кристаллы (кристаллы, построенные из катионов и анионов), например кристаллы иодида калия или хлорида натрия.
|
Металлическая связь. Металлические кристаллы.
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
Атомные и молекулярные кристаллы
В твердом агрегатном состоянии у веществ могут образоваться не только ионные, но также молекулярные и атомные кристаллические решетки.
 кристаллическая решетка иода кристаллическая решетка иода
| Так, твердый иод имеют молекулярную кристаллическую решетку, в узлах которых находятся молекулы I2. Аналогичным образом построена кристаллическая решетка твердого диоксида углерода (сухой лед) - в узлах кристаллической решетки находятся молекулы CO2.
|
Алмаз и графит - кристаллы с атомной решеткой, имеющей в узлах атомы углерода с разным расположением этих узлов в пространстве.
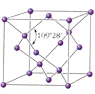 кристаллическая решетка алмаза кристаллическая решетка алмаза
| 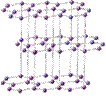 кристаллическая решетка графита кристаллическая решетка графита
|
Водородная связь.
При изучении многих веществ были обнаружены так называемые водородные связи. Например, молекулы HF в жидком фтороводороде связаны между собой водородной связью, аналогично связаны молекулы Н2О в жидкой воде или в кристалле льда, а также молекулы NH3 и Н2О между собой в межмолекулярном соединении - гидрате аммиака NH3 · Н2О.
 водородные связи между молекулами воды водородные связи между молекулами воды
| Водородная связь образуется за счёт сил электростатического притяжения водородсодержащих полярных молекул, содержащих атомы наиболее электроотрицательных элементов - F, O, N. Например, водородные связи имеются в HF, Н2О, NH3, но их нет в HCl, Н2S, PH3.
|
Водородные связи малоустойчивы и разрушаются довольно легко (например, при плавлении льда, кипении воды). Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления и кипения веществ с водородными связями между молекулами оказываются значительно выше, чем у подобных веществ, но без водородных связей:
| Вещество
| Температура
плавления
| Температура
кипения
|
| HF
| −83,36 °C
| +19,52 °C
|
| HCl
| −114,00 °C
| −85,08 °C
|
| H2O
| 0,00 °C
| +100,00 °C
|
| H2S
| −8,54 °C
| −60,35 °C
|
Валентность. Донорно-акцепторные связи. Согласно теории молекулярного строения, атомы могут образовывать столько ковалентных связей, сколько орбиталей у них занято одним электроном, однако так бывает не всегда. [В принятой схеме заполнения АО вначале указывают номер оболочки, затем тип орбитали и далее, если на орбитали находится более одного электрона, – их число (верхний индекс). Так, запись (2 s)2 означает, что на s -орбитали второй оболочки находятся два электрона.] Атом углерода в основном состоянии (3 Р) имеет электронную конфигурацию (1 s)2(2 s)2(2 p x)(2 p y), при этом две орбитали не заполнены, т.е. содержат по одному электрону. Однако соединения двухвалентного углерода встречаются очень редко и обладают высокой химической активностью. Обычно углерод четырехвалентен, и связано это с тем, что для его перехода в возбужденное 5 S -состояние (1 s)2(2 s) (2 p x)(2 p y)(2 p z) с четырьмя незаполненными орбиталями нужно совсем немного энергии. Энергетические затраты, связанные с переходом 2 s -электрона на свободную 2 р -орбиталь, с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных связей. Для образования незаполненных АО необходимо, чтобы этот процесс был энергетически выгодным. Атом азота с электронной конфигурацией (1 s)2(2 s)2(2 p x)(2 p y)(2 p z) не образует пятивалентных соединений, поскольку энергия, необходимая для перевода 2 s -электрона на 3 d -орбиталь с образованием пятивалентной конфигурации (1 s)2(2 s)(2 p x)(2 p y)(2 p z)(3 d), слишком велика. Аналогичным образом, атомы бора с обычной конфигурацией (1 s)2(2 s)2(2 p) могут образовывать трехвалентные соединения, находясь в возбужденном состоянии (1 s)2(2 s)(2 p x)(2 p y), которое возникает при переходе 2 s -электрона на 2 р -АО, но не образует пятивалентных соединений, поскольку переход в возбужденное состояние (1 s)(2 s)(2 p x)(2 p y)(2 p z), обусловленный переводом одного из 1 s -электронов на более высокий уровень, требует слишком много энергии. Взаимодействие атомов с образованием связи между ними происходит только при наличии орбиталей с близкими энергиями, т.е. орбиталей с одинаковым главным квантовым числом. Соответствующие данные для первых 10 элементов периодической системы суммированы ниже. Под валентным состоянием атома понимают состояние, в котором он образует химические связи, например состояние 5 S для четырехвалентного углерода.
| ВАЛЕНТНЫЕ СОСТОЯНИЯ И ВАЛЕНТНОСТИ ПЕРВЫХ ДЕСЯТИ ЭЛЕМЕНТОВ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
|
| Элемент
| Основное состояние
| Обычное валентное состояние
| Обычная валентность
|
| H
| (1 s)
| (1 s)
|
|
| He
| (1 s)2
| (1 s)2
|
|
| Li
| (1 s)2(2 s)
| (1 s)2(2 s)
|
|
| Be
| (1 s)2(2 s)2
| (1 s)2(2 s)(2 p)
|
|
| B
| (1 s)2(2 s)2(2 p)
| (1 s)2(2 s)(2 p x)(2 p y)
|
|
| C
| (1 s)2(2 s)2(2 p x)(2 p y)
| (1 s)2(2 s)(2 p x)(2 p y)(2 p z)
|
|
| N
| (1 s)2(2 s)2(2 p x)(2 p y)(2 p z)
| (1 s)2(2 s)2(2 p x)(2 p y)(2 p z)
|
|
| O
| (1 s)2(2 s)2(2 p x)2(2 p y)(2 p z)
| (1 s)2(2 s)2(2 p x)2(2 p y)(2 p z)
|
|
| F
| (1 s)2(2 s)2(2 p x)2(2 p y)2(2 p z)
| (1 s)2(2 s)2(2 p x)2(2 p y)2(2 p z)
|
|
| Ne
| (1 s)2(2 s)2(2 p x)2(2 p y)2(2 p z)2
| (1 s)2(2 s)2(2 p x)2(2 p y)2(2 p z)2
|
|
Указанные закономерности проявляются в следующих примерах:




 кристаллическая решетка иодида калия
кристаллическая решетка иодида калия
 кристаллическая решетка иода
кристаллическая решетка иода
 кристаллическая решетка алмаза
кристаллическая решетка алмаза
 кристаллическая решетка графита
кристаллическая решетка графита
 водородные связи между молекулами воды
водородные связи между молекулами воды




