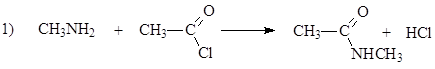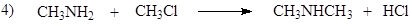82. Кислоты Бренстеда – это частицы, являющиеся:
1) донорами пары электронов;
2) донорами протона;
3) акцепторами Н+;
4) акцепторами вакантной орбитали;
5) анионами неметаллов.
83. Основания Бренстеда – это частицы, являющиеся:
1) донорами Н+;
2) донорами пары электронов;
3) акцепторами Н+;
4) акцепторами пары электронов;
5) катионами металлов.
84. Кислоты Льюиса – это частицы, являющиеся:
1) донорами пары электронов;
2) донорами вакантной орбитали;
3) акцепторами Н+;
4) акцепторами пары электронов;
5) галогенид-ионами.
85. Основания Льюиса – это частицы, являющиеся:
1) донорами пары электронов;
2) акцепторами пары электронов;
3) акцепторами вакантной орбитали;
4) донорами вакантной орбитали;
5) анионами неметаллов.
86. Какие утверждения верны? Кислота – это:
1) акцептор пары электронов
2) донор протонов
3) акцептор протонов
4) донор пары электронов
5) донор гидроксид-аниона.
87. СН-кислотность убывает в ряду:
1) СН2=СН2 > СН4 > СН≡СН
2) СН≡СН > СН2=СН2 > СН4
3) СН4 > СН≡СН > СН2=СН2
4) СН4 > СН2=СН2 > СН≡СН
88. В молекуле ацетоуксусной кислоты наиболее сильно выражены СН-кислотные свойства у атома углерода под номером:
1) 1
2) 2
3) 3
4) 4
5) 5
89. Ослабление кислотности имеет место в ряду:
1) пропанол-1, пропандиол-1,2, пропантриол-1,2,3
2) пропантриол-1,2,3, пропандиол-1,2, пропанол-2
3) пропанол-1, пропанол-2, пропантриол-1,2,3
4) пропанол-2, пропанол-1, пропандиол-1,2.
90. Усиление кислотности происходит в ряду:
1) CH3-CH3, CH3-OH, CH3-SH
2) CH3-NH2, CH3-CH3, CH3-SH
3) CH3-OH, CH3-SH, CH3-NH2
4) CH3-OH, CH3-NH2, CH3-CH3.
91. Какие утверждения верны? Основание – это:
1) донор электронной пары для протона
2) донор вакантной орбитали
3) акцептор протона
4) акцептор электронов.
92. Увеличение основности имеет место в ряду:
1) диэтилсульфид, диэтиловый эфир, диэтиламин
2) диэтиловый эфир, диэтилсульфид, анилин
3) диэтилсульфид, диэтиловый эфир, аммиак
4) диэтилсульфид, диэтиламин, диэтиловый эфир.
93. В каком ряду соединения расположены в порядке увеличения основности?
1) метиламин, диметиламин, анилин
2) метиламин, анилин, диметиламин
3) анилин, метиламин, диметиламин
4) диметиламин, анилин, метиламин.
94. Образование водородных связей между молекулами имидазола обусловлено:
1) основностью пиррольного азота
2) кислотностью пиррольного азота
3) кислотностью пиридинового азота
4) основностью пиридинового азота.
95. Самой сильной кислотой из перечисленных ниже соединений является:
1) СН3-СН2-СООН;
2) СН3-СООН;
3) НООС-СООН;
4) С17Н35СООН;
5) СН3ОН.
96. Самой сильной кислотой из перечисленных ниже соединений является:
1) фенол;
2) глицерин;
3) этанол;
4) уксусная кислота;
5) хлоруксусная кислота.
97. Самой сильной кислотой из перечисленных соединений является:
1) бутанол-1;
2) пропанол-1;
3) этиленгликоль;
4) глицерин;
5) пропандиол –1,3.
98. Самой сильной кислотой из перечисленных соединений является:
1) СН3-СН2-SH;
2) СН3-СН2-ОH;
3) СН3-СН2-СН2-ОН;
4) СН3-СН2-NH2;
5) СН3NH2.
99. Самой сильной кислотой из перечисленных соединений является:
1) СН3-СН2-SH;
2) СН3-СООH;
3) С6Н5ОН;
4) ClСН2СООН;
5) Сl3CCООН.
100. Самым сильным основанием из перечисленных соединений является:
1) СН3-СН2-SH;
2) С2Н5-О-С2Н5;
3) С2Н5-S-С2Н5;
4) С2Н5-NH-С2Н5;
5) С6Н5NH2.
101. Самым сильным основанием из перечисленных соединений является:
1) CH3-NH-CH3;
2) C6H5NH2;
3) CH3NH2;
4) NH3;
5) СН3ОСН3.
102. Самым сильным основанием из перечисленных соединений является:
1) анилин;
2) дифениламин;
3) аммиак;
4) этиламин;
5) диэтиловый эфир.
103. В какой группе соединений кислотные свойства ослабевают слева направо:
1) СН3-СООH; С17Н35СООН; НСООН; НООС-СООН;
2) НООС-СООН; С17Н35СООН; СН3-СООH; НСООН;
3) ClСН2СООН; СН3-СООH; СН3-СН2-СООН; С6Н5ОН;
4) НООС-СООН; НООС-СН2-СООН; СН3-СН2-СООН; С17Н35СООН;
5) СН3ОН; С6Н5ОН; С6Н5SH; СН3СООН.
104. В какой группе соединений кислотные свойства ослабевают слева направо:
1) НООС-СООН; СН3-СН2-СООН; С6Н5ОН;
2) СН3-СН2-SН; СН3СООН; СН3-СН2-ОН;
3) СН3-СООH; СН3-СН2-SН; СН3-СН2-ОН;
4) СН3-СН2-ОН; СН3-СН2-NН2; СН3-СН2-SН;
5) С6Н5ОН; С2Н5ОН; С2Н5SH.
105. В какой группе соединений основные свойства усиливаются слева направо:
1) СН3-S-CH3; СН3-О-CH3; СН3-NH-CH3;
2) СН3-NH-СН3; СН3-О-CH3; СН3-S-CH3;
3) С6Н5NH2; СН3-NH2; NH3;
4) С6Н5 –NH-С6Н5; NH3; СН3-СН2-NH2
5) СН3SH; СН3SСН3; С2Н5ОС2Н5.
106. Молекулы каких веществ могут выступать как p-основания:
1) СН3-СН3;
2) СН2=СН2;
3) НСºСН;
4) NH3;
5) С6Н5СН=СН2.
107. В молекуле валерьяновой кислоты свойства СН-кислотного центра наиболее выражены у:
1) первого атома углерода;
2) второго атома углерода;
3) третьего атома углерода;
4) четвертого атома углерода;
5) пятого атома углерода.
108. Из перечисленных соединений самой сильной СН - кислотой является:
1) СН3-СН3;
2) СН2=СН2;
3) НСºСН;
4) СН2=СН-СН3;
5) НСºС-СН3.
109. В перечисленных молекулах NН–кислотный центр содержит:
1) пиридин;
2) пиррол;
3) имидазол;
4) пиримидин;
5) триметиламин.
110. Какие заместители, связанные непосредственно с бензольным кольцом анилина, усиливают его основные свойства:
1) - СН3;
2) –NO2;
3) –ОН;
4) –СООН;
5) -SO3H.
111. Какие заместители, связанные непосредственно с бензольным кольцом фенола, усиливают его кислотные свойства:
1) –NO2;
2) – SO3H;
3) –СН3;
4) –С3Н7
5) –F.
112. Реально протекающему процессу соответствует уравнение:
1) NH4Cl + NaOH ® NaCl + H2O + NH3
2) NH3 + (CH3)2NH2Cl ® NH4Cl + (CH3)2NH
3) CH3NH2 + C6H5NH3Cl ® CH3NH3Cl + C6H5NH2
4) C6H5NH2 + HCl ® C6H5NH3Cl
5) (С6H5)2NH + NH4Cl ® NH3 + (С6H5)2NH2Cl
113. Реально протекающему процессу соответствует уравнение:
1) НСООН + СН3ОNa ® НСООNа + СН3ОН
2) НСООН + СН3СООNа ® НСООNа + СН3СООН
3) СН3СН2СООН + NаНСО3 ® СН3СН2СООNа + Н2СО3
4) СН3СН2СООН + НСООNа ® СН3СН2СООNа + НСООН
5) СН3СООNа + С6Н5ОН ® СН3СООН + С6Н5ОNа
114. Реально протекающему процессу соответствует уравнение:
1) СН3СН2ОNа + HCl ® C2H5OH + NаСl
2) C2H5OH + NаHCO3 ® СН3СН2ОNа + Н2СО3
3) С6Н5ОН + NаНСО3 ® С6Н5ОNа + Н2СО3
4) С6Н5ОNа + Н2О + CO2 ® С6Н5ОН + NаНСО3
5) CHºCNа + С6Н5ОН ® С2H2 + С6Н5ОNа
115. Реально протекающему процессу соответствует уравнение:
1) СН3СН2ОH + NаOH ® C2H5ONа +H2O
2) C2H5COOH + NаOH ® СН3СН2COОNа + Н2О
3) HOCH2СН2COОН + 2 NаOH ® NаОCH2СН2COОNа + 2Н2О
4) HOCH2СН2COОН + 2Nа ® NаОCH2СН2COОNа + Н2
5) HOCH2СН2COОН + 2С6Н5ОNа ® NаОCH2СН2COОNа + 2С6Н5ОН
116. Согласно теории кислот и оснований Бренстеда-Лоури, метиламин выступает в качестве основания в реакциях:
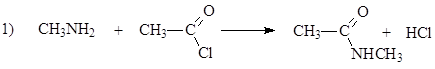


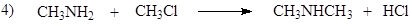

117. Согласно теории кислот и оснований Бренстеда-Лоури кислотно-основное взаимодействие происходит в реакциях:
1) C6H5OH + NaOH ® C6H5ONa + H2O
2) C6H5OH + C2H5ONa ® C2H5OH + C6H5ONa;
3) C2H5OH + NaNH2 ® C2H5ONa + NH3
4) 2C2H5OH + 2Na ® 2C2H5ONa + H2
5) 3C2H5OH + PCl3 ® 3C2H5Cl + H3PO3
118. В какой группе стабильность анионов увеличивается слева направо:
1) СН3-СН2-СОО-; СН3-СН2-О-; СН3-СОО-; НСОО-;
2) СН3-СН2-СН2-О-;СН3-СН2-О-; С6Н5О-; О2N-С6Н4-СОО-;
3) СН3-СН2-S-; СН3-СН2-О-; СН3-СН2-NH-;
4) СН3-СН2-О-; СН3-СН2-S-; СН3-СОО-; НСОО-;
5) CН3-СН2 -; СН3NH -; NH2-; НО-; НS-.
119. В какой группе стабильность катионов увеличивается слева направо:
1) СН3+; СН3-СН+-СН3; СН3-СН2-СН2+;
2) СН2=СН-СН2+; СН3-СН2-СН2+; СН3-СН+-СН3;
3) СН3+; СН3-СН2-СН2+; СН2=СН-СН2+;
4) СН3-СН+-СН3; СН2=СН-СН2+; СН3-СН2-СН2+;
5) СН3+; СН3-СН2-СН2+; С6Н5-СН2+