
норадреналин (нейротрансмиттер) 3,4,5-триметокси-фенилэтиламин
(мескалин), алкалоид Лофофоры
Вильямса и Трихоцереуса Паханои
 ДОМ (2,5-диметокси-4-метил- фенилизопропиламин или 2,5-диметокси-4-метил-амфетамин) известный также как СТП (безмятежность, спокойствие, мир или научно-обработанная нефть), синтетический.
ДОМ (2,5-диметокси-4-метил- фенилизопропиламин или 2,5-диметокси-4-метил-амфетамин) известный также как СТП (безмятежность, спокойствие, мир или научно-обработанная нефть), синтетический.
 МДМА (экстази)
МДМА (экстази)
(3,4-метилендисиметамфетамин)
А. Простые индолики, родственные 5НТ (нейромедиатору серотонину)
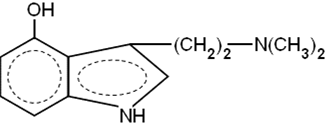
 Серотонин
Серотонин
(5-гидрокситриптамин)
 ДМТ (N,N-диметилтриптамин)
ДМТ (N,N-диметилтриптамин)
MeO-ДМТ
(5-метокси-N,N-диметилтриптамин)
Псилоцин
(4-гидрокси-N,N-диметилтриптамин)
2 б. Трициклические индолики, родственные 5НТ (β–карболины)
Гармин
Тетрагидрогармин

Гармалин
В. Сложные индолики
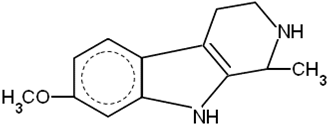
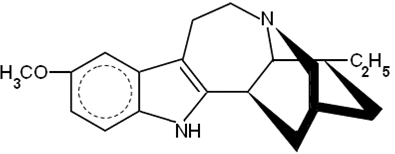 ибогаин
ибогаин
(из Табернантхе ибога)

ЛСД-25 ("лизергокислый диэтиламид")
(N,N-диэтиламид декстро -лизергиновой кислоты), полусинтетический
Ввиду структурных аналогий между нейрогормонами и галлюциногенами не вызывает удивления, что проведено много исследований о взаимодействии психотропов и нейротрансмиттеров. Окончательно обрисовать эти взаимодействия пока проблематично: галлюциногены участвуют в целом спектре взаимодействий. Например, следующий отрывок говорит о взаимодействии с серотонином и норадренергическими механизмами, и это всего лишь один из вариантов:
«Уже существующий внушительный перечень неясных интерпретаций действий этих соединений пополнен наблюдениями Копена. Если нет посредников влияния галлюциногенов – зная три возможных способа: потенцирование, ингибирование и оба без суммации – то возможно трижды энное количество способов взаимодействия, в которые вступает галлюциноген. К этому добавим количественные оценки, что психотропы в зависимости от дозы зачастую имеют прямо противоположный эффект. Нужно учесть их влияние на разные зоны мозга; что некоторые галлюциногены связываются с разными типами рецепторов.
Галлюциногенный эффект может зависеть от воздействия галлюциногена сразу на несколько разнотипных рецепторов. Например, для проявления специфического галлюциногенного эффекта «икс» вещество должно ингибировать 5НТ синапсы, потенцировать норадренергические синапсы и не влиять на гистаминовые. Для эффекта «игрек» необходимо антигистаминное воздействие, ингибирование норэпинефриновых и отсутствие влияние на серотониновые рецепторы, –и т.д. (Смитис, в работе Шмитта и др. 1971, стр. 32)
Технические проблемы, связанные с изучением химической передачи импульса в синапсе, оказались поистине непреодолимыми в случае ЦНС. Как следствие экспериментальные исследования сконцентрировались на роли нейромедиатора ацетилхолина (Манделл и Спунер 1968) в периферической нервной системе. Т.е., многие теоретические модели нейротрансмиттерной функции в ЦНС были выведены из работ по ацетилхолину в периферических нервах.
Любого рода подобные исследования работы синапсов ЦНС затруднены несколькими факторами:
технические проблемы, связанные с попыткой использовать аналогичный системный подход к потенциальному нейромедиатору ЦНС, велики. Периферические синапсы можно отделить друг от друга микропрепаровкой, их будет много, и каждый часами будет оставаться функционирующим. Их активация может быть продемонстрирована совершенно определёнными и поддающимися измерению феноменами: такими как потенциал миниатюрной концевой пластинки или сокращение гладкой мышцы. ЦНС весьма непохожа на периферийные синаптические участки. Дендриты и клеточные тела центральных нейронов усеяны синапсами, относящимися к разнотипным нейромедиаторам. Более того, снаружи нейроны окутаны глией, практически примыкающей к мембранам нервных клеток, и она, вероятно, существенна для их функций. Ввиду этого, химическое манипулирование отдельно изолированным синапсом ЦНС осуществить крайне сложно (Манделл и Спунер 1968, стр. 1443)
Эти трудности делают большинство наших данных по норадреналину и серотонину –главным химическим посредникам в ЦНС –в лучшем случае косвенными. Данные, свидетельствующие в пользу ведущего медиаторного статуса норадреналина и серотонина в ЦНС, получены изучением химических градиентов этих веществ в различных участках мозга. Регистрировалось распределение синтезирующих и разлагающих ферментов, тесно связанных с наличием аминов. Наблюдались пиковые концентрации указанных аминов и синтезирующих их энзимов в органоидах нейрона, выходящих на синаптические пузырьки, и пиковые концентрации инактивирующих ферментов в органеллах, ассоциированных с синаптическими структурами (см. Манделл и Спунер 1968).
Диаграммная модель возможных действий нейротрансмиттера и синапса показана на рис. 4. Галлюциногены могут изменить функцию нейротрансмиттера, включаясь на одном или нескольких этапах диаграммы. Современные теории возможных влияний галлюциногенов на функции серотонина и норадреналина склоняются, в основном, к идее псевдомедиатора: галлюциноген сцепляется с нейронным рецептором вместо эндогенного нейромедиатора:

Рис. 4
Действие нейротрансмиттера на синапс: (1) захват прекурсора, (2) синтез трансмиттера предположительно в несколько этапов, (3) переброска трансмиттера, (4) депо трансмиттера, (5) мобилизация трансмиттера, (6) проведение нервного импульса, (7) высвобождение трансмиттера, (8) действие на рецептор, (9) завершение действия трансмиттера: а) обратный захват б) ферментативный распад в) диффузия, (10) ферментативное разложение трансмиттера в нервном окончании. (Смитис, в работе Шмитта и др. 1971, стр. 17)
Ложный трансмиттер заменяет норадреналин в гранулах депо, поэтому высвобождается меньше норадреналина. Нервный импульс же всегда требует постоянного числа высвобождающихся молекул. Ложные трансмиттеры могут конкурировать в отношении нейронального захвата норадреналина.
Таким образом, высвободившийся норадреналин потенцируется: ингибирование обратного нейронального захвата потенцирует действие катехоламина. С другой стороны, ложный трансмиттер может взаимодействовать с рецептором, не давая норадреналину активировать его. Таким образом угнетается действие высвобожденного биогенного трансмиттера. Наконец, ложный трансмиттер может и сам активировать рецептор, но обычно не так эффективно, как норадреналин. Другими словами, одно и то же вещество может – хотя и шестью различными механизмами – менять эффективность нервного импульса.
Реакцию этих соединений можно понять, если посмотреть с точки зрения аминогруппы. Аминогруппа имеет потенциал взаимодействовать с большим разнообразием нейронных рецепторов. По мере добавления аминогрупп, молекуле становится сложнее взаимодействовать с этими разнообразными рецепторами. Если молекула на основе фенамина, она сгодится, быть может, только лишь для норадреналиновых и серотониновых рецепторов. Она не активирует гистаминовый рецептор. При добавлении метокси- группы молекуле становится тяжелее помещаться в адренергический рецептор; она теперь реагирует почти исключительно с серотонинергическими рецепторами. Химическое манипулирование, поэтому, изменяет баланс взаимодействия соединения с разнообразными рецепторами. (Смитис, в работе Шмитта и др. 1971, стр. 67)
О действии нейротрансмиттеров и галлюциногенов можно многое узнать, исследуя ферментные механизмы их метаболизма. Вот что выяснилось: в головном мозге содержатся энзимы, способные синтезировать эндогенные галлюциногены. Важнейший из этих ферментов – фенол-окси-метил трансфераза, могущая окси-метилировать тирамин. В результате формируется потенциально галлюциногенный гомологичный мескалину пара-метокси-фенилэтиламин. Помимо этого, имеется нитро-метил трансфераза, впервые выделенная из кроличьего лёгкого. Нитро-метил трансфераза синтезирует ДМТ и буфотенин в мозге из триптамина и серотонина. Кроме того, гидрокси-индол-окси-метил трансфераза, энзим эпифиза, может окси-метилировать N-ацетилсеротонин, превращая последний в мелатонин. Она же может окси-метилировать буфотенин, превращая последний в 5-метокси-N,N-ДМТ. Наконец, галлюциноген 6- метокси-тетрагидро-гарман определён как гормон шишковидной железы: адрено-гломеруло-тропин. Потенциальный прекурсор для него, 6-метокси- гармалан, получается из мелатонина. Большой интерес представляет обнаружение близких к гармальным алкалоидам субстанций у животных. Одно из таких веществ – адреногломерулотропин или 1-метилпинолин, гормон-индолик шишковидной железы: 1,2,3,4,-тетрагидро-6-метокси-1- метил-9Н-пиридо (3,4,6) индол. Эта субстанция идентична 6-метокси- тетрагидро-гарману, который синтезируется в физиологических условиях из 5-метокси триптамина и ацетальдегида. 6-метокси тетрагидрогарман является изомером тетрагидрогармина, одного из алкалоидов лозы Банистериопсис. Он также содержится в африканской лептактинии денсифлоре. Ещё одно вещество, 6-метоксигармалан, является производным – по крайней мере лабораторно – мелатонина: как продукт метилирования ацетилсеротонина. Энзим, делающий это возможным – гидрокси-индол-окси-метил трансфераза – обнаруживается только в шишковидной железе. (Наранхо, в Эфрон и др. 1967, стр. 385)
Ввиду естественного присутствия в мозге галлюциногенов, таких как 6- метоксигармалан, как и энзимов, способных порождать схожие соединения, неудивительно, что исследователи ищут основания для ряда психических заболеваний, как шизофрения – в энзиматической дисфункции. (Сравни Снайдер и др. 1974)
Вряд ли биохимические причины абнормального поведения могут быть поняты в отсутствие какого-либо внятного понимания роли нейротрансмиттеров (и, возможно, эндогенных галлюциногенов) и связанных с ними ферментных систем в регуляции нормального поведения. Снайдер (1974) делает интересное предположение, что метилированные триптамины, полученные в результате переработки субстратных производных серотонина энзимом, могут работать в настройке уровней внутреннего и внешнего восприятия у людей. Остаётся малоизученной функция самого серотонина в модуляции восприятия или в процессе мышления. Следующий отрывок предполагает, что серотонин может функционировать разнообразно:
Элкс заключает, что 5-гидрокситриптаминная система мозга может представлять собой древнюю эволюционную систему. Серотонин широко представлен в животной и даже растительной жизни. В позвоночных, моллюсках, актиниях, волосках крапивы. Может ли быть такое, что каким-то образом старейшая биологическая функция 5НТ имела отношение к свету? Что часть (изначально) светочувствительного ферментного механизма каким- то образом была перенята и встроена в какие-то первобытные нервные сети (плексус мышечной оболочки кишечника, эпифиз, мостовые ядра)? Полезно вспомнить, что некоторые мощные гормоны роста растений, ауксины, являются индолами. Могут ли индолы быть регуляторами роста в ЦНС? (Смитис, в Шмитт и др. 1971, стр. 26)
Предположение, что 5НТ связан со светочувствительным механизмом приобретает дополнительную значимость, если рассматривать его в контексте последних данных касательно функции шишковидной железы. Человеческая шишковидная железа содержит по весу больше серотонина, чем какая угодно часть мозга любого млекопитающего.
Эпифиз содержит высокую концентрацию энзима триптофан гидроксилаза, которая имеет первоочередное значение в синтезе серотонина из триптофана.
Шишковидная железа также является единственным органом, содержащим энзим гидроксииндол-окси-метил трансферазу (ГИОМТ), превращающую серотонин в мелатонин. И мы уже упоминали, что шишковидная железа содержит галлюциноген 6-метоксигармалан.
Эпифиз – наименее изученный отдел мозга. До недавнего времени полагалось, что это филогенетический рудимент, оставшийся от предков- рептилий в качестве нефункционирующего третьего глаза. Сейчас же «третий глаз» понимается как полнофункциональная эндокринная железа.
Эволюция шишковидной железы как доисторического третьего глаза отражена в факте, что до неё доходит целый спектр афферентной иннервации. Эфферентный ответ железы на этот спектр –циркадные флюктуации её ферментной активности, включая активность ГИОМТ и следовательно секреции мелатонина:
Шишковидная железа, как теперь известно, получает два вида афферентной иннервации: световой сигнал и обонятельный сигнал. Эпифиз эмитирует два ответа: гонадотропный мелатонин (подавляющий функцию половых желез) и мелатонин-индолик.
Прежде всего, что очень важно: шишковидная железа светочувствительна и связана с сетчаткой. Это не светоощущение в привычном для нас смысле. Это –параметры освещённости; типа и времени освещения. Возможно, иные характеристики света, каковые остаются за порогом сознания …
Далее, шишковидная железа связана афферентным нервом с участком мозга, ранее известным как ринэнцефалон или обонятельный мозг. В настоящее время в США он именуется лимбической системой или лимбико- ретикулярным комплексом …
(Винер 1968, стр. 915)
Имеются неоспоримые доказательства того, что шишковидная железа чувствительна и к прочим сигналам, кроме световых и обонятельных. А именно: к температурным перепадам, звуковым тонам, красному и инфракрасному свету, а также рентгеновскому излучению
(Винер 1968, стр. 923, 931)
Шишковидка секретирует на антагонизме с гипофизом. Обе железы воздействуют на те же самые органы и пигментные клетки: меланоциты. Под влиянием гипофиза и эпифиза находятся половые железы, мозг, щитовидка, тимус и кора надпочечников. Как гипофиз, так и эпифиз влияют на рост тела и опухолей, углеводный обмен и метаболизм жиров. Мозговой придаток и шишковидное тело воздействуют также на диурез и кровяное давление (Винер 1968). В целом, шишковидная железа имеет тенденцию ингибировать гипофизарные гормоны. Этот шишковидно-гипофизарный антагонизм в особенности заметен на взаимодействии мелатонина эпифиза с меланостимулирующим гормоном (МСГ) средней доли гипофиза. Единственная известная функция этих гормонов – пигментные клетки (меланоциты). Мелатонин высветляет пигментные клетки кожи, концентрируя гранулы меланина, тогда как МСГ делает пигментные клетки темнее, рассеивая гранулы по цитоплазме клетки. Хотя индолик мелатонин – сильнейший хроматофоротропный осветлитель кожи, его прекурсор серотонин не оказывает никакого высветляющего эффекта в дозах до четырёх миллиграммов (Винер 1968). Вышеупомянутые два пигментных гормона полагаются некоторыми фитогенетическими реликтами, потерявшими свою функцию в человеческом организме. Однако Винер (1968) выдвинул смелую гипотезу, что меланоциты могут являться источником феромонов или экзогормонов: внешних химических посланников (ВХП) или веществ, высвобождаемых организмом вовне для воздействия на поведение других организмов:
Все известные гипофизарные и эпифизарные гормоны кроме МСГ и мелатонина оказывают трофический или антитрофический эффект на другие секреторные клетки. Пара же МСГ-мелатонин действует почти исключительно на пигментные клетки кожной периферии. МСГ и мелатонин не регулируют синтез никаких известных химических посредников, они лишь двигают пигментные зёрна по клетке: это больше свойственно лягушкам, чем человеку …
Пигментная клетка не производит гормона, который бы действовал на тело человека. Но она на поверхности кожи. Способна она производить гормон, влияющий на тело другóго человека: экзогормон – не эндогормон? (Винер 1968, стр. 932)
Из этой гипотезы вытекает следующая: галлюциногены, структурно близкие нейротрансмиттерам и обнаруживаемые в царстве растений, являются феромонами (точнее: алломонами, противомонами), когда они взаимодействуют с ЦНС млекопитающего. В самом деле: представляется обоснованным, что молекулы структурного родства с передатчиками нервного импульса способны не только функционировать в нервной системе, но являются переносчиками информации: из внешней среды в организм, из организма в другой организм. К этому моменту мы вернёмся – как и к вопросу функции шишковидки – после изложения нашей собственной модели действия галлюциногена на рецепторы мозга.
Мы обсудили, в широком спектре формулировок, некоторые из современных идей о возможных способах действия галлюциногенов. Описана вероятная функция нейромедиаторов. Отмечено структурное родство многих галлюциногенов с передатчиками импульса в ЦНС. Указывалось, что область захвата галлюциногенов нейроном совпадает с очаговой локализацией нейротрансмиттеров в межнейронной плазме. Наконец, галлюциногены функционируют как конкуренты молекул-передатчиков нервного импульса. Мы также упомянули о существовании цепочек ферментативного синтеза в мозге, посредством которых возможно производство эндогенных психотомиметиков из медиаторного субстрата. И мы обратили внимание на то, что имеется важная, хотя малопонятная, взаимосвязь между шишковидкой и гипофизом в регулировании концентрации прекурсоров; шишковидная железа реагирует на целый ряд внешних стимулов – и это может сказаться на синтезе экзогормонов или ВХП. Пока общая сумма сделанных нами выводов незначи́тельно отклоняется от современных нейрофизиологических теорий, поскольку нашей задачей было предоставить базовый материал для последующего шага. Теперь рассмотрим специфический вопрос цепочки молекулярных событий в синапсе и возможное влияние галлюциногенов на них.
В начале этой главы мы рассмотрели вероятные функции нейротрансмиттеров в ЦНС и способы, каковыми эти функции могут меняться галлюциногенами. В ходе дискурса выяснялось: детальное экспериментальное исследование данной проблематики сопряжено с немыслимыми техническими сложностями. При всём при этом все сложности изучения нейротрансмиттеров ничтожны в сравнении с загвоздкой № 1: молекулярной природой нейронного рецептора. Известны структурные формулы нейротрансмиттеров и конкурирующих с ними галлюциногенов, но это совершенно не продвинуло в понимании молекулярного механизма рецептора. Изучение активности галлюциногенов в связи с их структурой в лучшем случае приводит к умозрительным выводам, поскольку галлюциноген не просто взаимодействует с рецептором, но находится под влиянием различных факторов. Считается, что рецепторный участок располагается в слое белка, липопротеина или гликопротеина нейронной мембраны. При этом нейротрансмиттер, попадая в рецептор, индуцирует конформационное изменение макромолекулы, что в свою очередь открывает ионный канал. К сожалению, эта идея не способствует пониманию химической природы рецептора ввиду обилия аминотропных белков, липидов и углеводов. Проблема перестанет казаться неразрешимой, если к химической природе рецептора подойдут с другой стороны (Смитис 1970).
Обнаружение РНК в синаптосомной мембране (Морган и Остин 1968) заставляет усомниться, что рецептор базируется в белковом, липидном или полисахаридном слоях. Смитис выдвинул гипотезу, что РНК или рибонуклеопротеин, присутствующий в мембране, является первичным рецепторным участком. Согласно модели Смитиса, возможное функциональное значение серотонина, или одного из его структурных производных, соединяющегося с нуклеиновой кислотой в мембране –это то, что РНК срабатывает как канал прохождения ионов (или даже самих аминов) через мембрану. Внедряющиеся амины вызывают крутильный сдвиг спирали РНК, превращая её в подобие регулирующего клапана при вероятной вовлечённости ионообменных комплексов:
Сегменты спиральной РНК могут изгибаться перпендикулярно поверхности, а также стелиться по ней: каждый сегмент состоит из двух спирально закрученных желобков, соединяющих внутреннее пространство клетки с её поверхностью. Макромолекула РНК спирально прошивает всю мембрану. Желобки могут смыкаться в трубки или каналы, выводя гибкие молекулы с правыми щелочными связующими группами (полиамины: спермин) между фосфатными группами смежных витков спирали. То есть, молекула РНК может принять вид одной большой трубки, вмещающей две трубки меньшего диаметра, разделёнными заслонкой: оснóвными парами, соединёнными водородной связью. Если пары оснований разрываются, они расходятся как шов, обнажая полость трубки или желоб. Максимальная длина РНК, необходимая для прошивания типичной мембраны, составляет два кольца. Канал может также состоять из заслонки РНК меньшей длины, выводящей на белковый канал. Хофман и Ладик (1961) обнаружили, что нуклеиновые кислоты ведут себя необычно в электрическом поле. Нормально они диэлектрики. Но если поместить такую молекулу в электрическое поле с продольными силовыми линиями с вставкой донора или акцептора электронов надлежащего потенциала на одном из её концов, вся она становится токопроводящей. Приходят в движение ароматические p – электроны. Происходящий в результате перенос заряда может поляризовать пары оснований и разорвать связующие их водородные связи – пары оснований расходятся, двойная спираль разматывается. В нашей модели электрическое поле создаётся остаточным потенциалом нейронной мембраны, а донором электрона является серотонин. Если 5НТ вклинивается между первой парой азотистых оснований на внешнем конце спиральной РНК, спираль распадается, открывая внутренний клапан канала. Достаточно большой, чтобы пропускать гидратированные ионы натрия или калия зависимо от длины удерживающего полиаминного корсета. Поток ионов деполяризует мембрану, и РНК вновь становится непроводящей. Воссоздаются водородные связи пары оснований, и канал закрывается. В это же время молекула 5НТ выбрасывается открывающейся спиралью и перезахватывается окончанием аксона. Здесь ключевой момент в суперпозиции индольного кольца 5НТ и пуринового кольца пар оснований. Механизм закрытия поры калиевого катиона в условиях гиперполяризованной мембраны представить сложнее. Эта простая схема может использоваться и для транспорта других молекул через мембрану: например самих биогенных аминов (Смитис 1969, стр. 267 – 269)
Модель Смитиса подкрепляется фактом, что 5НТ и многие его аналоги – ЛСД-25 или N,N-ДМТ, а также гармин – сцепляются с ДНК, РНК или обеими. Доказательство способности триптамина и его производных связываться с нуклеиновыми кислотами – ключевой момент для понимания как модели Смитиса, так и нашей собственной гипотезы действия галлюциногенов. Ниже подробная цитата:
по утверждению Сигала и Салинаса, флуоресцентный метод обнаруживает чёткое взаимодействие серотонина с нуклеиновыми кислотами. Йилдинг и Штергланц сообщают о взаимодействии ЛСД с ДНК, но именно с нативной ДНК, а не с денатурированной ДНК или РНК. Исследователи использовали снижение собственной флуоресценции и изменения в ультрафиолетовой абсорбции как критерий сцепления …
Индолэтиламин и его производные сцепляются с нуклеиновыми кислотами одним из четырёх способов: (1) ионными связями между положительно заряженным протонированным амином N и фосфатными группами; (2) внедрением между основаниями (РНК) или парами оснований (ДНК) и связью нахлёстом π-орбиталей; (3) водородной связью с свободной орбиталью NH группы или кислорода пар оснований перекрытия желобков спирали; и (4) одноцепочечные нуклеиновые кислоты дают четвёртый путь для водородных связей в незанятых участках азотистых полупар.
Триптамин и его производные распределяются на три группы. Если взять триптамин за эталон, то равновесие достигается при 9 мкг триптамина и 1,2 мг нуклеиновой кислоты. При замене в пятой позиции индольного ядра на гидроксил или метокси- радикал флуоресценция уменьшается, и увеличивается при N,N-диалкилировании с алкильной группой длиннее или больше метила: при этиле, изопропиле, бутиле, бензиле. При замене в аминогруппе на диизопропил и дибутил полученное производное триптамина энергичнее реагирует не с ДНК, а с РНК. Возможное объяснение этих различий происходит из факта, что 5НТ в растворе образует комплекс с собою (димеризуется): посредством π-электронов и ион-дипольной связи между азотом одной молекулы и дельта-кислородом соседней. Этот комплекс не может самостоятельно сцепляться с нуклеиновой кислотой. Помимо серотонина, такие комплексы образуют буфотенин и 5-О метил- буфотенин – им тоже сложно связываться с нуклеиновой кислотой. Триптамин в меньшей степени подвержен димеризации (азот напрямик связывается с ароматическим облаком). В случае высших диалкилированных производных ион-дипольная связь уменьшается стерическим препятствием, и они способны связываться с нуклеиновой кислотой …
Прочие замещения в индольном кольце приводят к различным последствиям. Рисунки 5 и 6 показывают результаты с прочими производными. Можно видеть, что производные с громоздкими заместителями кольца в пятой или шестой позиции (в особенности, 6-хлоротриптамин) имеют большее снижение флуоресценции с ДНК, а не с РНК. Таким образом, индолики с громоздкими заместителями амидного азота лучше связываются с РНК, а производные с громоздкими заместителями кольца – с ДНК.
Рис. 5 а
Снижение значений флуоресценции для сложных производных триптамина
при взаимодействии с ДНК

1) 5-BnO-N,N-ДМТ
2) N,N-дибензил триптамин
3) 3 (2-дегидро изоиндолилэтил) индол
4) 5,6,7 N,N пентаметил триптамин
5) 6-хлоротриптамин
6) 7-метилтриптамин
7) 6-хлоро-N,N-ДМТ
Рис. 5 б
Снижение значений флуоресценции для сложных производных триптамина
при взаимодействии с РНК

1) 5-BnO-N,N-ДМТ
2) N,N-дибензил триптамин
3) 3 (2-дегидро изоиндолилэтил) индол
4) 5,6,7 N,N пентаметил триптамин
5) 6-хлоротриптамин
6) 7-метилтриптамин
7) 6-хлоро-N,N-ДМТ
Рис. 6 а
Снижение значений флуоресценции для ряда триптаминов при
взаимодействии с ДНК

1) 5-гидроксииндолуксусная кислота
2) N,N-диметилсеротонин (буфотенин)
3) 5НТ
4) О-метилбуфотенин
5) ДМТ
6) триптамин
7) N,N-диэтилтриптамин
8) N,N-диизопропилтриптамин
9) N,N-дибутилтриптамин
Рис. 6 б
Снижение значений флуоресценции для ряда триптаминов при
взаимодействии с РНК

1) 5-гидроксииндолуксусная кислота
2) N,N-диметилсеротонин (буфотенин)
3) 5НТ
4) О-метилбуфотенин
5) ДМТ
6) триптамин
7) N,N-диэтилтриптамин
8) N,N-диизопропилтриптамин
9) N,N-дибутилтриптамин
Рис. 7 а
Снижение значений флуоресценции ДНК в случае β–карболинов

1) 1,2,3,4-тетрагидрогармин
2) гармалин
3) гармин
Рис. 7 б
Снижение значений флуоресценции РНК в случае β–карболинов
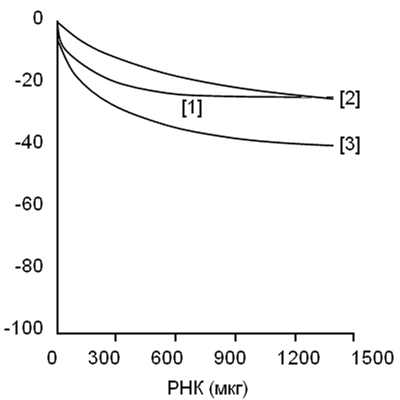
1) 1,2,3,4-тетрагидрогармин
2) гармалин
3) гармин
кривые рисунков 5, 6 и 7 взяты из работы Дж. Р. Смитиса и Ф. Энтуна в журнале Нейчер № 223, стр. 1062 (6 сентября 1969)
http://www.nature.com/nature/journal/v223/n5210/pdf/2231061a0.pdf
Рисунок 7 показывает отсутствие существенных отличий в замедлении флуоресценции гармалина и тетрагидрогармина в реакции с ДНК или РНК, но гармин с его более громоздкой ароматической системой связывается с ДНК лучше.
Эти объясняются следующим образом: 1) триптамины не могут связываться с фосфатными группами нуклеиновых кислот, поскольку липофильная природа их молекул препятствует связыванию с такой гидрофильной областью; 2) если бы триптамины вступили в липофильное взаимодействие с нуклеиновыми кислотами внедрением между основаниями РНК и парами оснований ДНК, то эффективная связь потребовала бы максимального нахлёста π-облаком. В случае РНК это достижимо, если триптамин входит между пуриновыми комплементами индольным кольцом для максимального перекрытия π-облака. Когда индольное кольцо доступно, боковые его ответвления уже не мешают. В случае спиральной нуклеиновой кислоты, π- облако распределяется по водородным связям, соединяющим два основания. Таким образом, относительно небольшая триптаминовая молекула (в сравнении с такой типичной вставочной молекулой в ДНК как профлавин) скорее потерпит такого заместителя кольца как хлор – что увеличивает габариты молекулы – чем присоединять громоздкую алкильную группу к амидному азоту, что также делает молекулу толстой. Аналогично, такие громоздкие трёхъядерные и четырёхъядерные молекулы как гармин и ЛСД производят нахлёст π–облаком между парами оснований ДНК значительно эффективнее, чем с однорядной РНК. Эти факты говорят в пользу гипотезы, что триптамин и его производные взаимодействуют с нуклеиновыми кислотами главным образом интеркалированием (Смитис и Энтун 1969, стр. 1061)
Нейротрансмиттеры и их аналоги – не единственные вещества, способные соединяться с нуклеиновыми кислотами. Наиболее хорошо изучен в этом отношении акридиновый профлавин (рис. 8), он похож на гармин (рис. 3: 2 б). Акридин профлавин интеркалирует между парами оснований двойной спирали, частично расплетая её в месте интеркаляции. Интеркалянты, как полагают, удерживаются на месте устойчивой связью с электронами пар оснований выше и ниже участка вторжения; подобная вставка в спираль стабилизирует её. Стабилизированная интеркалянтами ДНК, как пишет Остин Ньютон (1970), денатурируется большей температурой.
Рис. 8
молекула профлавина
Смитис также детально описывает участок сцепления 5НТ с нуклеиновой
кислотой и сравнивает серотонин с его галлюциногенными аналогами:
Таким образом 5НТ может связываться с упорядоченной одноцепочечной РНК посредством интеркаляции (т.е. нахлёстом π–облаком) между смежными пуриновыми основаниями и двумя водородными связями (гидроксил с кислородом рибозного кольца и рибозным гидроксилом). Серотонин может связываться со спиральной ДНК интеркаляцией между парами оснований и одной водородной связью (NH с кислородом дезоксирибозного кольца или водородом гидроксила с другим дезоксирибозным кольцом). 5НТ не такой большой, чтобы сцепиться с двумя водородными связями сразу. В отношении спиральной РНК, серотонин сцепляется с ней интеркаляцией и не менее чем четырьмя водородными связями …
[ см. рис. 9]
Галлюциногенные триптамины характеризуются частичной блокадой связующих групп; пока триптаминовый галлюциноген сцеплен с рецептором, он – конкурентный антагонист, не агонист, – серотонина. Блокада активных групп происходит посредством диалкилированной аминогруппы. Диалкильный хвост ослабляет ионную и водородную связь, производя стерический эффект. Азот не может приблизиться к кислороду – как результат, индольное кольцо не вставляется в рецептор точно так же, как в случае серотонина. Функция 5НТ в этом участке может иметь отношение к реакциям переноса заряда. Поскольку π–облако серотонина сконденсировано ближе к второму атому, лёгкое смещение индольного кольца алкилированных триптаминовых интеркалянтов как ДМТ может препятствовать переносу заряда. Возможная мишень в этом участке для переноса заряда – водород вышерасположенной пары оснований (соединяющий, к примеру, азот гуанина с кислородом цитозина), и в этом смысле возможное действие 5НТ в рецепторе – разрыв водородной связи с последующим эффектом домино расторжения двойной спирали РНК (Смитис 1969, стр. 265)
В модели Смитиса предполагаемая способность 5НТ или какого-то из аналогов открывать ионный канал интеркалированием в РНК-рецептор основывается на способности формировать зарядопереносный комплекс с нуклеиновой кислотой. Механизм переноса заряда имеет ключевое значение в представлении нашей собственной модели далее. Поэтому несколько общих комментариев по зарядопереносным комплексам в живых системах видятся уместными. Мы встретили такие комментарии в наблюдениях Альберта Сент-Дьёрдьи (1960):
… можно допустить возможность переноса электрона от одного вещества к другому без больших потерь энергии, так как данный процесс не сопровождается перестройкой структуры молекулы.
[из книги «Введение в субмолекулярную биологию» Альберта Сент-Дьёрдьи в переводе Л.А. Тумермана, М.: Наука, 1964; стр. 69 – прим. пер. ]
Вследствие переноса заряда относительно неактивные молекулы могут приобрести высокую химическую активность. Донор, имеющий дырку на своём низколежащем энергетическом уровне, становится хорошим акцептором. А акцептор, в свою очередь, захватывая электрон на высокорасположенную возбуждённую орбиталь, становится хорошим донором.
 А) B)
А) B)
С)

D)
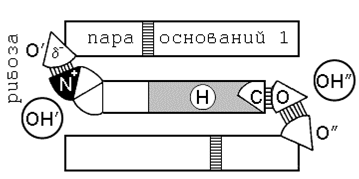
Рис 9. Интеркаляция лекарственных средств в ДНК
(А) диаграмма, иллюстрирующая вторичную структуру обычной ДНК
(В) искажённая структура ДНК в результате интеркаляции химического вещества.
(Оригинал изображения – иллюстрации Л.С. Лермнана, 1964)
(С) вариант вхождения 5НТ в участок интеркаляции спиральной РНК. (Смитис)
(D) схематическое представление комплекса актиномицин-ДНК, основанное на молекулярной модели Гамильтона–Райха (1963). Циклические пептидные цепочки цитостатика представлены как кольца, заполняющие малую бороздку спирали ДНК на расстоянии примерно трёх п.о.
В, С и D – структурные гомологи гармин-нуклеинового комплекса
Зарядопереносный комплекс имеет место между типичной молекулой с заполненными орбиталями с одной стороны и свободным радикалом с другой. Высокая химическая активность свободных радикалов очевидна. Если в исключительной ситуации комплекс распадается, то формируется два полностью свободных радикала.
Акцептор может захватить электрон с заполненной энергетической зоны, создавая тем самым дырку и делая слой проводящим. Обратно, донор может отдать электрон в незаполненную зону, сделав её проводящей. Т.е., перенос заряда открывает дорогу полупроводимости в биологию …
В




 ДОМ (2,5-диметокси-4-метил- фенилизопропиламин или 2,5-диметокси-4-метил-амфетамин) известный также как СТП (безмятежность, спокойствие, мир или научно-обработанная нефть), синтетический.
ДОМ (2,5-диметокси-4-метил- фенилизопропиламин или 2,5-диметокси-4-метил-амфетамин) известный также как СТП (безмятежность, спокойствие, мир или научно-обработанная нефть), синтетический. МДМА (экстази)
МДМА (экстази) Серотонин
Серотонин ДМТ (N,N-диметилтриптамин)
ДМТ (N,N-диметилтриптамин)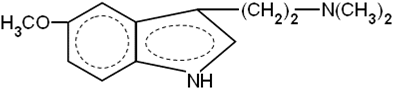


 ибогаин
ибогаин








 А) B)
А) B)



