Загидуллин С. Х.
ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Утверждено Редакционно-издательским советом университета
в качестве учебного пособия
Пермь 2011
УДК 66.0 (075)
З-14
Рецензенты:
доктор химических наук, профессор, заведующий лабораторией
Института технической химии УО РАН Ю. С. Чекрышкин
кандидат технических наук, доцент Пермского государственного
технического университета А. В. Софронова
Загидуллин С.Х.
З-14 Общая химическая технология: Учебное пособие / Перм. гос.
техн. ун-т. Пермь, 2001. – 56 с.
Кратко изложены общие вопросы химической технологии, касающиеся основ термодинамического и кинетического анализа гомогенных, гетерогенных и гетерогенно-каталитических реакций, принципов разработки химико-технологических процессов (сырьевой и энергетической баз, проблемы охраны окружающей среды и др.).
Предназначено для студентов специальности «Машина и аппараты химических производств» заочной формы обучения.
УДК 66.0 (075)
|
| Ó Пермский государственный
технический университет, 2011
|
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ..…………………………………………………………………....4
1. ХИМИЧЕСКИЕ ПРОЦЕССЫ……………………………………………...7
1. 1. Классификация химической реакции …………………………………...7
Технологические критерии эффективности химико-
технологических процессов…………………………………………………...8
1. 3. Термодинамический анализ химико - технологических процессов….10
1. 4. Равновесие химических реакций……………………………………….11
1. 5. Закон действующих масс………………………………………………..11
1. 6. Законы смещения равновесия…………………………………………..13
1. 7. Основы химической кинетики………………………………………….14
1. 8. Гетерогенные процессы ……………………………………………...…16
1. 8. 1. Гетерогенные процессы в системе газ – твердое…………………...17
1. 8. 2. Гетерогенные процессы в системе газ – жидкость……………...….21
1. 9. Гетерогенно-каталитические процессы………………….…………….23
1. 9. 1. Технологические характеристики твердых катализаторов…….….25
1. 9. 2. Явления промотирования и отравления катализаторов……………27
2. ОБЩИЕ ПРИНЦИПЫ РАЗРАБОТКИ ХИМИКО-
ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ……………………………………...27
2. 1. Сырьевая база химической промышленности...………………………27
2. 1. 1. Классификация сырья…………………….….....................................28
2. 1. 2. Принципы обогащения сырья…………………………………….…29
2. 1. 3. Вода и воздух в химической промышленности…………….………30
2. 1. 4. Промышленная водоподготовка………………………………….….32
2. 1. 5. Атмосферный воздух……………….………………….………….….37
2. 2. Энергетическая база химической промышленности……………….…38
2. 2. 1. Классификация топливно-энергетических ресурсов………....….…38
2. 2. 2. Технологические характеристики топлива……………………….…39
2. 3. Химическая технология и охрана окружающей среды………...……..40
2. 3. 1. Источники загрязнения атмосферы………………………………….41
2. 3. 2. Классификация сточных вод………………………………………....41
2. 3. 3. Очистка отходящих газов химических производств ….…………...42
2. 3. 4. Очистка сточных вод…………………………………………….…...44
2. 3. 5. Водооборотные циклы.……………………………………………….46
ВВЕДЕНИЕ
Инженер-механик должен уметь проектировать, конструировать и эксплуатировать технологическое оборудование химических, нефтеперерабатывающих и нефтехимических производств. Грамотное выполнение этих работ невозможно без знания технологических особенностей протекающих в этом оборудовании процессов, закономерностей выбора технологического режима, требований рационального использования сырьевых и топливно-энергетических ресурсов и без учета задач охраны окружающей среды. Все эти вопросы рассматриваются в данном курсе.
Химическая технология – это наука о наиболее экономичных и экологически оправданных методах массовой химической переработки сырья в продукты потребления и средства производства.
Современная химическая технология (ХТ) использует новейшие достижения естественных и технических наук, изучает и разрабатывает физические и химические процессы, оптимальные пути осуществления этих процессов при промышленном производстве различных продуктов.
ХТ основывается на таких химических науках, как физическая химия, термодинамика и кинетика, она развивает эти науки в приложении к крупнотоннажным производствам. Тесно связана ХТ также с экономикой, физикой, математикой, вычислительной техникой и другие науками.
Значительный прогресс ХТ в последние годы связан с применением современных вычислительных машин, это обогатило ее новыми подходами, связанными с математическим моделированием этих процессов.
Благодаря всему этому химическая промышленность превратилась в одну из ведущих отраслей материального производства.
Химизация народного хозяйства представляет собой внедрение методов ХТ, химического сырья и материалов из них в производственную и непроизводственную сферы. Она является одним из решающих факторов повышения эффективности производства.
Затраты общественного труда на производство химических материалов в несколько раз ниже, чем на получение естественного сырья. Энергозатраты также ниже в 2 – 3 раза. Химизация сельского хозяйства в развитых странах обеспечивает около 50 % прироста урожайности культур.
Научной основой химической промышленности является химическая технология, а материальной базой технологического прогресса этой отрасли – химическое машиностроение.
Номенклатура оборудования, используемого в химико-технологичес-ких процессах, превышает 12 тысяч наименований и типоразмеров. Это современные установки для разделения жидких неоднородных смесей (фильтры, центрифуги, отстойники и др.), тепло- и массообменные аппараты (теплообменники, испарители, конденсаторы, сушилки, экстракторы, кристаллизаторы и др.), машины для измельчения, классификации, дозирования, смешивания различных материалов, компрессоры, насосы, запорно-регулирующая арматура и др.
В последние годы широкое развитие получили поставки предприятиями химического машиностроения так называемых комплектных технологических линий, установок и блоков. Например, изготовлены и эксплуатируются уникальные комплектные линии для производства аммиака, аммафоса, фосфорной кислоты, аммиачной селитры, полиэтилена высокого давления, установки для переработки нефти и др.
Переход от поставок строящимся химическим предприятиям разрозненного оборудования к оснащению их полностью укомплектованными агрегатами и комплектными технологическими линиями сокращает сроки ввода в эксплуатацию новых мощностей в несколько раз, снижает стоимость объектов, повышает конкурентоспособность и ускоряет техническое перевооружение химической промышленности.
Одной из ведущих тенденций химической технологии является создание крупномасштабных производств новых видов продуктов многоцелевого назначения, таких как водород, аммиак и метанол. Они могут использоваться как химического сырья для дальнейшей переработки на других предприятиях, так и в качестве вторичных энергоносителей.
В условиях ограниченных ресурсов нефти и природного газа огромное значение как сырье для химических и нефтехимических производств будет приобретать каменный уголь: разведанные запасы угля достаточны на 500 – 600 лет, а нефти только на 60 – 80 лет.
ХТ принадлежит решающая роль в совершенствовании и разработке новых эффективных способов очистки промышленных выбросов от вредных примесей.
Начало производства основных химических продуктов в Европе относится к XV веку, когда стали возникать мелкие производства кислот, щелочей, солей, различных фармацевтических препаратов и некоторых органических продуктов, в России этот период относится к концу XVI – началу XVII века. В это время начали развиваться производства различных красок, селитры, пороха, кальцинированной соды и Н2SO4.
Во второй половине 18 века началось выделение ХТ в специальную отрасль знаний, в эти же годы началось преподавание этой дисциплины в российских ВУЗах.
С конца XVIII века стали производить кальцинированную соду
(Na2CO3) по способу Леблана. В 1861году был разработан более прогрес-
сивный аммиачный способ получения кальцинированной соды (способ Сольве), основы которого сохранились до настоящего времени.
В 1875 году Винклер разработал новый контактный метод получения серной кислоты с использованием катализаторов, что позволило резко повысить качество и снизить себестоимость продукции.
В 1912 году Габер и Бош открыли новый синтетический способ получения аммиака из азота и водорода с использованием железного катализатора, что также явилось поворотным моментом в развитии азотной промышленности.
В развитие ХТ большую роль сыграли и отечественные ученые: Менделеев, Зинин, Бутлеров, Марковников, Крупский и многие другие.
Пермский край по уровню химизации промышленности находится на пятом месте в России. У нас производится более 700 наименований химической продукции, в том числе вырабатывается более 20 % всех минеральных удобрений в России (ПАО «Уралкалий», ОАО «Азот», ОАО «Завод минеральных удобрений»), в том числе около 100 % всех калийных удобрений, около 30 % кальцинированной соды и более 20 % красителей.
В последние тридцать лет введены в строй более 30 крупных производственных объектов (три больших агрегата по производству аммиака и два по производству карбамида в городах Перми и Березники, третье Соликамское калийное рудоуправление, самый мощный в мире четвертый Березниковский калийный завод, самое мощное в Европе производство метанола (ОАО «МЕТАФРАКС» г. Губаха) и др.
Только за последние десять лет вступили в строй современные производства формалина и карбамидформальдегидных смол (ОАО «МЕТАФРАКС», новое производство по глубокой переработке нефти (ООО «ЛУКОЙЛ-Пермнефтеоргсинтез») и др. В ближайшее время планируются освоение новых производств стирола (ЗАО «СИБУР-Химпром», крупные мощности по переработке нефти по наиболее прогрессивной «безмазутной» технологии (ООО «ЛУКОЙЛ-Пермнефтеоргсинтез») и др.
В г. Перми и Пермском крае расположены также крупные институты химического и нефтехимического профилей, способные изучать, разрабатывать новые и совершенствовать действующие производства, проводить проектно-изыскательские и проектно-конструкторские работы.
ХИМИЧЕСКИЕ ПРОЦЕССЫ
Селективность
Выход продукта характеризует полученный результат реакции как долю от предельно-возможного.
Но на практике для сложных реакций очень важно оценить эффективность протекания целевой реакции по сравнению с побочными. Для этого служит понятие селективность. В свою очередь, различают полную или интегральную селективность (φ) и дифференциальную или мгновенную селективность (φ¢).
Полная или интегральная селективность – это отношение количества исходного реагента, расходуемого на целевую реакцию к общему количеству исходного реагента, израсходованного на все реакции (целевую и побочные):
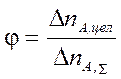 .
.
Мгновенная или дифференциальная селективность – это отношение скорости превращения исходных реагентов в целевой продукт к суммарной скорости расходования исходных реагентов.
φ¢ = Wr ( A→R ) / ∑ WrA,
где Wr ( A → R ) – скорость расходования реагента А по целевой реакции, ∑ WrA – суммарная скорость расходования реагента А.
Связь между выходом, степенью превращения и селективностью имеет следующий вид:
В = Х × φ.
П р и м е р. Пусть степень превращения сырья Х = 0,9; однако, из-за протекания побочных реакций селективность φ = 0,8.
Тогда: В = φ × Х = 0,8 × 0,9 = 0,72.
Закон действующих масс
Рассмотрим простейшую обратимую реакцию
а×А + в×В Û r×R + s×S.
Для нее запишем кинетические уравнения прямой и обратной реакций:
 ,
,
 ,
,
| где k 1 и k 2
| – константы скорости прямой и обратной реакций; они не зависят от концентрации реагентов, а зависят от физических свойств реагентов, температуры и наличия катализаторов;
|
| Сi
| – концентрации реагентов
|
При равновесии 

 ,
,
где Кс – константа равновесия реакции, выраженная через концентрации.
Константа равновесия не зависит от концентрации и наличия катализаторов, но зависит от температуры и от природы реакции.
В отдельных случаях константу равновесия удобно выражать не через концентрации, а через другие величины. Например, для газофазных реакций вместо концентрации удобно использовать парциальное давление реагентов или их активности. В этом случае константу равновесия записывают как Кр:
 ,
,
где PrR,e, PsS,e, PaA,e, PbB,e – парциальные давления реагентов в условиях равновесия.
Зависимость Кр от температуры описывается известным уравнением изотермы Вант-Гоффа:
 ,
,
где ∆ G o – изменение энергии Гиббса в стандартных условиях (0о С, 1атм).
Значения стандартных энергий Гиббса для образования большинства веществ имеются в справочниках. Если этих данных нет, то можно воспользоваться известным уравнением:
 ,
,
где D Н o и D S o – стандартные изменения энтальпии и энтропии (имеются в справочниках).
Величина и знак (±)∆ G o в первом приближении позволяют судить о состоянии равновесия.
Если ∆ G o << 0, то равновесие сильно смещено вправо, выход продукта велик и константа равновесия >>1.
Наоборот, если ∆ G o >> 0, то равновесие сильно смещено влево и константа равновесия <<1.
Законы смещения равновесия
Положение равновесия зависит от внешних условий, и эта зависимость подчиняется принципу Ле Шателье.
Принцип Ле Шателье: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, то в системе усилится то направление процесса, которое ослабляет это воздействие, и положение равновесия сместится в том же направлении.
Рассмотрим влияние наиболее важных внешних факторов.
Влияние давления. Оно определяется знаком разности числа молей газообразных участников реакции:
∆ n = (r + s) – (a + b).
Если ∆ n > 0, то повышение давления нецелесообразно. Например, для реакции паровой конверсии метана:
СН4 + Н2О(пар) Û СО + 3Н2 – Q
∆ n = (1+3) - (1+1) = + 2.
Если ∆ n < 0, то повышение давления целесообразно для смещения реакции вправо.
Например, синтез аммиака протекает по реакции
3Н2 + N2 Û 2NH3 + Q.
Для нее ∆ n = 2 – (3+1) = – 2.
Реакция тем чувствительнее к изменению давления, чем больше ∆ n.
Если ∆ n = 0, то равновесие не зависит от изменения давления.
Например, реакция паровой конверсии оксида углерода протекает без изменения числа молей:
СО + Н2О(пар) Û СО2 + Н2 + Q.
Влияние инертного газа. Введение инертного газа в реакционную систему согласно закону Дальтона равносильно снижению общего давления в системе. Поэтому введение инертного газа в систему равносильно действию общего давления, рассмотренного выше.
Влияние концентрации. Введение избытка исходного вещества вызывает смещение равновесия вправо, а введение избытка продукта реакции – влево. Этим обстоятельством очень часто пользуются на практике.
Например, при паровой конверсии метана для увеличения степени превращения СН4 на практике увеличивают концентрацию более дешевого водяного пара в 3,5 – 4 раза.
Наоборот, при необходимости остановить прямую реакции на определенной стадии в реакционную смесь возвращают часть получаемого продукта.
Влияние температуры. Оно зависит от знака теплового эффекта реакции.
Для экзотермических реакций повышение температуры нежелательно. Для эндотермических, наоборот, благоприятно.
Таким образом, используя принцип Ле Шателье, можно, не проводя каких-либо термодинамических расчетов, предсказать принципиальное направление протекания химической реакции.
Основы химической кинетики
Термодинамический анализ очень важен, но он не отвечает на вопрос: «Как быстро произойдет химическая реакция?». Этим занимается химическая кинетика. В общем случае скорость химической реакции можно выразить формулой
 ,
,
| где wrJ
| – скорость химической реакции, выраженная через изменение концентрации компонента J;
|
| j
| – стехиометрический коэффициент при данном компоненте,
|
| V
| – реакционный объем,
|
| dnJ
| – число молей израсходованного J -го компонента за время τ,
|
| dCJ
| – изменение концентрации компонента j.
|
Так как скорость реакции не может быть отрицательной, то знак (±) берется в зависимости от того, является ли компонент J исходным реагентом или продуктом реакции. Если он исходный реагент, то перед уравнением ставится «–», если это продукт реакции, то «+».
Факторы, влияющие на скорость, обычно, подразделяют на 2 группы:
1) микрокинетические – определяющие скорость взаимодействия на молекулярном уровне;
2) макрокинетические – определяющие влияние макрофакторов (V, условия перемешивания, геометрические размеры реакторов и т.д.)
Микрокинетика основана на двух постулатах, установленных экспериментально:
1. Скорость химической реакции пропорциональна концентрации реагентов.
2. Суммарная скорость нескольких последовательных реакций (стадий), значительно отличающихся друг от друга по скоростям, определяется скоростью наиболее медленной (лимитирующей) стадии.
Скорость простой (одностадийной) необратимой реакции:
а×А + в×В ® s×S + r×R
описывается следующим кинетическим уравнением:
 ,
,
где а – частный порядок реакции по реагенту А;
в – частный порядок реакции по реагенту В;
а + b = n – общий порядок реакции.
Для простых реакций порядок и молекулярность совпадают. Простые реакции в основном имеют второй порядок. Однако большинство химических реакций являются сложными и для них порядок и молекулярность не совпадают:
 ,
,
α ≠ а; β ≠ b.
Величины α и β определяют экспериментально, они могут быть дробными числами.
Наибольшее влияние на скорость оказывает концентрации того реагента, по которому больше частный порядок реакции. Допустим, что кинетическое уравнение какой-либо реакции записывается как
 .
.
В этом случае частный порядок по реагенту А больше порядка по реагенту В в восемь раз. Поэтому целесообразно увеличивать концентрацию именно реагента А.
Другим фактором ускорения химических реакций является темпера-
тура. Экспериментально установлено, что с увеличением температуры на
10°С скорость большинства реакций возрастает в 2 – 4 раза (правило Вант-Гоффа).
Более точно температурная зависимость выражается уравнением Аррениуса:
 или
или  ,
,
где k – константа скорости реакции; R – универсальная газовая постоянная; T – температура, К; ko – предэкспоненциальной множитель (находят экспериментально, зависит от свойств реагирующих веществ), Е – энергия активации реакции.
Энергия активации элементарной реакции – это минимальный избыток энергии по сравнению со средней внутренней энергией молекул, необходимый для того, чтобы произошла химическая реакция. Т. е. это энергетический барьер, который должен быть преодолен молекулами для протекания реакции.
Чем выше Е, тем более чувствительна реакция к изменению температуры.
Второй, более рациональный способ ускорения реакции, заключается в уменьшении величины Е, что достигается за счет использования катализаторов.
Гетерогенные процессы
В большинстве химических реакций, используемых в промышленности, протекают с участием нескольких фаз. Различают двух - и трехфазные гетерогенные процессы (Г – Т; Г– Ж; Ж – Ж; Т – Ж; Г – Т – Ж).
Несмотря на разнообразие и различия, все гетерогенные процессы объединяет один общий признак: прежде чем произойдет химическая реакция, должен произойти перенос реагентов из ядра одной фазы к границе раздела или в объем другой фазы.
Перенос реагентов осуществляется за счет диффузии. Диффузия бывает молекулярной и конвективной. Скорость диффузионного переноса реагентов имеет очень большое значение, так как данный процесс предшествует химической реакции.
Таким образом, все гетерогенные процессы состоят из нескольких последовательных стадий, в том числе, переноса реагентов к границе раздела фаз или в их объем, химического взаимодействия, а также обратного переноса продуктов реакций за счет обратной диффузии.
Как видно, гетерогенные процессы намного сложнее гомогенных и их скорость чаще всего сравнительно мала. Под скоростью гетерогенного химического процесса понимают следующее соотношение: 
 ,
,
где wrJ – скорость гетерогенного процесса, выраженная через изменение
концентрации компонента J,
F – величина площади межфазной поверхности.
Чтобы различать отдельные стадии гетерогенных процессов обозначим: wrJ – скорость химической реакции,
wdJ – скорость диффузионной стадии.
Так как эти стадии являются последовательными, то могут быть следующие ситуации:
1. wrJ >> wdJ. В этом случае суммарная скорость гетерогенного процесса лимитируется скоростью диффузии. Говорят, что процесс протекает в диффузионной области.
2. wrJ << wdJ. В этом случае суммарная скорость гетерогенного процесса лимитируется скоростью химической реакции. Говорят, что процесс протекает в кинетической области.
3. wrJ ≈ wdJ. В этом случае скорости обеих стадий соизмеримы, и говорят, что процесс протекает в переходной области.
Для ускорения гетерогенного процесса требуется, в первую очередь, увеличить скорость лимитирующей стадии. В первом случае, это диффузионная стадия, во втором – химическая реакция, и в третьем, требуется одновременная интенсификация обеих стадий.
1.8.1. Гетерогенные процессы в системе газ – твердое
Они имеют большое значение на практике. Эти процессы используются при обжиге различного сырья или руд, получении цемента, поглощении газообразных веществ адсорбентами и т.д.
Существует несколько кинетических моделей, описывающих эти процессы.
Для высокопористых твердых веществ может быть применена квазигомогенная модель. Она предполагает, что гетерогенный процесс протекает одновременно в любой точке объема твердой частицы.
Более распространенной является модель с фронтальным перемещением зоны реакции. Согласно этой модели химическая реакция сначала протекает только на внешней поверхности частицы и пока этот внешний слой не превратится полностью в продукты реакции, более глубокие слои частицы в реакцию не вступают. Постепенно зона химической реакции продвигается фронтально внутрь, оставляя за собой твердые продукты и инертную часть исходной твердой частицы.
Рассмотрим простейшую гетерогенную реакцию типа:
а×А (г) + b×B (т) → r×R (г) + s×S (т).
Об отдельных этапах процесса будем судить по изменению концентрации газообразного реагента А в различных точках пространства (СА) (рис. 1).
В соответствии с этой моделью процесс протекает по следующей схеме:

| Рис. 1. Схема гетерогенного процесса
в системе газ – твердое:
1 – пограничная газовая пленка (ламинарный слой) толщиной δ;
2 – слой твердого продукта реакции S;
3 – ядро не прореагировавшего реагента В
|
1. Внешняя диффузия реагента А к поверхности частицы из газового потока через ламинарный газовый слой.
2. Внутренняя диффузия газообразного реагента А через поры и трещины слоя твердого продукта реакции S к не прореагировавшему ядру реагента В.
3. Химическая реакция на поверхности не прореагировавшего ядра.
4. Внутренняя диффузия газообразного продукта R через слой твердых продуктов S.
5. Внешняя диффузия продукта R в газовый поток.
Рассмотрим подробнее эти стадии.
Внешняя диффузия. В результате протекания химической реакции концентрация реагента А у поверхности частицы (CA,F) ниже, чем в газовом потоке(СА,g).
Как известно, перенос вещества осуществляется суммарно за счет конвективной и молекулярной диффузий и описывается уравнением Щукарева:
wk,A = β(СА,g – CA,F),
где wk,A – скорость переноса вещества за счет конвективной и молекулярной диффузии, β – коэффициент скорости этого процесса (коэффициент массоотдачи);
(СА,g – CA,F) – движущая сила внешней диффузии.
Величина β характеризует скорость переноса вещества за счет конвективной и молекулярной диффузии и является кинетической константой. Она зависит не только от физических свойств системы, но также и от условий проведения процесса, например, от гидродинамических условий (интенсивности перемешивания). Поэтому для увеличения β лучше всего использовать аппараты с псевдоожиженным слоем зернистого материала (П.С.), схематично изображенный на рис. 2.
| Рис. 2. Схема аппарата с псевдоожиженным слоем зернистого материала:
1 – газораспределительная решетка,
2 – зернистый слой
| 
|
Внутренняя диффузия. Скорость внутренней диффузии описывается уравнением Фика:
 , (2)
, (2)
где wd,A – скорость внутренней диффузии;
D эф – коэффициент молекулярной диффузии внутри трещин и пор твердого продукта реакции S;
СА,С – концентрация вещества А на границе непрореагировавшего ядра;
(СА,F - CA,C) – движущая сила внутренней диффузии.
Если обозначить  , то это уравнение можно переписать:
, то это уравнение можно переписать:
wd,A = β¢ (СА,F – CA,C), (2’)
где β¢ – коэффициент скорости внутренней массоотдачи.
Величина D эф – зависит как от природы диффундирующего вещества А и температуры, так и структуры вещества S (пористости, размеров и формы пор и т. д.).
Как видно, величина β¢ зависит от толщины слоя твердых продуктов реакции и ее можно увеличить за счет измельчения частиц. Для этого целесообразно использовать аппараты с пылевидным слоем материала, например, циклонного типа.
Поверхностная химическая реакция. Скорость реакции описывается кинетическим уравнением:
 , (3)
, (3)
где wr,A – скорость поверхностной химической реакции;
kF – константа скорости реакции,
n – порядок реакции.
Скорость реакции можно увеличить путем увеличения концентрации реагента А и, главным образом, за счет увеличения kF. В свою очередь, константу скорости, согласно уравнению Аррениуса, можно увеличить повысив температуру.
Уравнения (1)-(3) позволяют рассчитать скорости отдельных стадий гетерогенного процесса. Однако эти стадии тесно связаны друг с другом. Для установления взаимосвязей этих уравнений примем, что порядок химических реакции равен единице (n = 1).
Перепишем эти уравнения и преобразуем их.
wk,A = β(СА,g – CA,F) ,
wd,A = β¢(СА,F – CA,C) ,
 .
.
При установившихся условиях скорости отдельных стадий процесса должны быть одинаковыми, т. е.: wA= wk,A = wd,A = wr,A.
Тогда:
 ,
,
 ,
,
где К – константа скорости всего гетерогенного процесса.
При анализе основного уравнения могут иметь место следующие случаи:
1)  ;
; 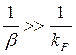 .
.
В этом случае K ≈ β. Наиболее медленной стадией является внешняя диффузия, и именно она лимитирует весь процесс. Говорят, что процесс протекает во внешнедиффузионной области.
Для ускорения всего процесса надо увеличить β, что достигается, в основном, увеличением критерия Рейнольдса, например, при использовании аппаратов ПС.
2)  ;
;  => K ≈ β¢.
=> K ≈ β¢.
В этом случае наиболее медленной стадией является внутренняя диффузия. Говорят, что процесс протекает во внутридиффузионной области. Значение β¢ можно увеличить за счет измельчения твердого реагента.
3)  ;
;  => K ≈ kF.
=> K ≈ kF.
В этом случае наиболее медленной стадией является поверхностная химическая реакция. Говорят, что процесс протекает в кинетической области. Для ускорения всего гетерогенного процесса требуется увеличить скорость химической реакции. Это достигается, в основном, увеличением температуры.
4)  .
.
В данном случае говорят, что гетерогенный процесс протекает в смешанной или переходной области. Для ускорения процесса необходимо повысить скорости всех стадий одновременно, т. е. увеличить интенсивность перемешивания, измельчать материал и повышать температуру.
1. 8. 2. Гетерогенные процессы в системе газ – жидкость
Газожидкостные реакции также широко используются в промышленности, например, абсорбция аммиака азотной, серной или фосфорной кислотами в производстве удобрений, поглощении углекислого газа и аммиака растворами хлорида натрия в производстве кальцинированной соды, поглощение углекислотного газа и сероводорода раствором моноэтаноламина при санитарной очистке газов от ядовитых и вредных газов и др.
Такие реакции рассматриваются как процессы абсорбции, сопровождающиеся химической реакцией, при этом за счет химической реакции процесс абсорбции улучшается (хемосорбция). Например, раньше для извлечения углекислого газа из состава синтез-газа в производстве аммиака использовали абсорбцию водой под высоким давлением. В настоящее время для этих целей взамен воды используют более эффективные жидкие химические поглотители, например, водные растворы моноэтаноламина (МЭА) или поташа (К2СО3).
Скорость процессов физической абсорбции описывается основным уравнением массопередачи:
dM = Km (CA,g – CA,L ) dFdτ,
где dM – количество абсорбированного вещества;
Km – коэффициент скорости массопередачи;
CA,g – концентрация абсорбируемого вещества в газовой фазе;
CA,L – концентрация этого вещества в жидкой фазе;
dF – величина межфазной поверхности (между газом и жидкостью);
dτ – время.
В свою очередь коэффициент скорости массопередачи равняется:
 ,
,
где β g – коэффициент скорости массоотдачи по газовой фазе;
β L – коэффициент скорости массоотдачи по жидкой фазе;
НА – коэффициент распределения (константа Генри).
Величины β g и β L являются кинетическими константами, то есть находятся в зависимости от интенсивности перемешивания, соответственно газовой или жидкой фаз.
Коэффициент распределения зависит от растворимости газа и температуры. Чем меньше НА, тем растворимость газа больше. Для большинства веществ значения НА имеются в справочниках.
Как показывает анализ уравнения, могут иметь следующие случаи:
1. При малых значениях НА, то есть при абсорбции хорошо растворимых газов:
Кm ≈ β g
.
Для ускорения абсорбции хорошо растворимых газов необходимо увеличить β g. Это достигается путем повышения интенсивности перемешивания газа.
2. При больших значениях НА (для малорастворимых газов):
 .
.
Для ускорения абсорбции необходимо интенсивно перемешивать жидкость.
3. При средних значениях НА (для средне растворимых газов):
 ,
,
Таким образом, для ускорения абсорбции среднерастворимых газов необходимо интенсивно перемешивать как газовую, так и жидкую



 .
. ,
, ,
,

 ,
, ,
, ,
, ,
, ,
, ,
, ,
, .
. или
или  ,
, ,
,

 , (2)
, (2) , то это уравнение можно переписать:
, то это уравнение можно переписать: , (3)
, (3) .
. ,
, ,
, ;
; 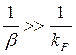 .
. ;
;  => K ≈ β¢.
=> K ≈ β¢. ;
;  => K ≈ kF.
=> K ≈ kF. .
. ,
, .
. ,
,


