Раздел 1. Периодический закон в свете строения атома
Введение.
Тема 1. Строение электронной оболочки атома.
Квантовые числа. Возбужденное состояние атомов и ионов. Химическая связь.
Тема 2. Периодический закон.
Изменение свойств элементов и их соединений в периодах и группах периодической системы Д.И.Менделеева.16
Раздел 2. Элементы химической термодинамики и кинетики
Тема 3. Основы химической термодинамики.
Тепловые эффекты химических реакций. Внутренняя энергия и энтальпия. Термохимия. Термохимические законы и уравнения. Энтальпия образования химических соединений. Энтропия, энергия Гиббса и их изменение в химических процессах. Направление протекания химических реакций. Метод Улиха.
Тема 4. Кинетика и химическое равновесие.
Скорость химических реакций. Закон действия масс. Константа скорости реакции. Химическое равновесие. Константа равновесия и ее связь с термодинамическими функциями. Принцип Ле-Шателье. Химическое равновесие в гетерогенных системах. Зависимость скорости химических реакций от температуры. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Катализаторы.
Раздел 3. Растворы
Тема 5. Растворы электролитов.
Классификация растворов. Дисперсные системы. Диссоциация сильных и слабых электролитов. Степень диссоциации, константа диссоциации. Закон разбавления Оствальда. Факторы, влияющие на процесс диссоциации. Электролитическая диссоциация воды. Водородный показатель среды.
Тема 6. Концентрация растворов.
Растворимость. Способы выражения концентрации растворов. Определение концентрации.
Раздел 4. Окислительно-восстановительные процессы
Тема 7. Гальванический элемент.
Электродные потенциалы металлов. Электродвижущая сила гальванического элемента и ее измерение. Стандартный водородный электрод и водородная шкала потенциалов. Уравнение Нернста.
Тема 8. Электролиз.
Химическая и концентрационная поляризация. Перенапряжение водорода. Катодные и анодные процессы при электролизе. Окислительно-восстановительные реакции.
Модуль 2. Химические процессы и материалы
Раздел 5. Металлические материалы
Тема 9. Металлы.
Кристаллическое строение металлов. Получение и химические свойства металлов. Взаимодействие металлов с кислотами. Электронный баланс. 17
Тема 10. Коррозия металлов.
Химическая и электрохимическая коррозия. Кислородная и водородная деполяризация. Термодинамика коррозионных процессов.
Раздел 6. Неметаллические материалы
Тема 11. Неорганические материалы.
Материалы и покрытия на основе оксидов. Керамика. Керметы. Силикатные материалы. Химические свойства силикатов. Стекло. Ситаллы.
Тема 12. Полимеры.
Полимеры и олигомеры. Структура макромолекул: линейные, разветвленные, сетчатые. Получение полимеров: полимеризация и поликонденсация. Пластмассы.
Варианты контрольных заданий
Таблица 1
| Номер
варианта
| Номер задач контрольной работы
|
|
| 1; 40; 91; 188; 241; 330; 361; 401; 421; 451
|
|
| 2; 39; 92; 213; 271; 329; 350; 402; 422; 452
|
|
| 3; 38; 93; 186; 242; 328; 362; 403; 423; 453
|
|
| 4; 37; 94; 215; 272; 327; 349; 404; 424; 454
|
|
| 5; 36; 95; 185; 243; 326; 363; 405; 425; 455
|
|
| 6; 35; 96; 218; 273; 325; 348; 406; 426; 456
|
|
| 7; 34; 97; 183; 244; 324; 364; 407; 427; 457
|
|
| 8; 33; 98; 220; 274; 323; 347; 408; 428; 490
|
|
| 9; 32; 99; 181; 245; 322; 365; 409; 429; 458
|
|
| 10; 41; 100; 222; 275; 321; 346; 410; 430; 459
|
|
| 11; 42; 101; 209; 246; 320; 366;411; 431; 460
|
|
| 12; 43; 102; 224; 276; 319; 345; 412; 432; 461
|
|
| 13; 44; 103; 208; 247; 318; 367; 413; 433; 462
|
|
| 14; 45; 104; 207; 277; 317; 344; 420; 434; 463
|
|
| 15; 46; 105; 206; 248; 316; 368; 415; 435; 464
|
|
| 16; 47; 106; 205; 278; 315; 343; 417; 436; 465
|
|
| 17; 48; 107; 204; 249; 314; 369; 419; 437; 466
|
|
| 18; 49; 108; 203; 279; 313; 342; 418; 438; 467
|
|
| 19; 50; 109; 202; 250; 312; 370; 416; 439; 468
|
|
| 20; 51; 110; 201; 280; 311; 341; 414; 440; 469
|
|
| 21; 52; 111; 200; 251; 310; 371; 400; 441; 470
|
|
| 22; 53; 112; 199; 281; 309; 340; 399; 442; 471
|
|
| 23; 54; 113; 198; 252; 308; 372; 398; 443; 472
|
|
| 24; 55; 114; 197; 282; 307; 339; 397; 444; 473
|
|
| 25; 56; 115; 196; 253; 306; 373; 396; 445; 474
|
|
| 26; 57; 116; 195; 283; 305; 338; 395; 446; 475
|
|
| 27; 58; 117; 194; 254; 304; 374; 394; 447; 476
|
|
| 28; 59; 118; 193; 284; 303; 337; 393; 448; 477
|
|
| 29; 60; 119; 192; 255; 302; 375; 392; 449; 478
|
|
| 30; 31; 120; 191; 285; 301; 336; 391; 450; 479
|
|
| 1; 32; 121; 190; 256; 302; 376; 420; 421; 480
|
|
| 2; 33; 122; 189; 286; 303; 335; 419; 422; 481
|
|
| 3; 34; 123; 188; 257; 304; 377; 418; 423; 482
|
|
| 4; 35; 124; 187; 287; 305; 334; 417; 424; 483
|
|
| 5; 36; 125; 186; 258; 306; 378; 416; 425; 484
|
|
| 20; 37; 126; 185; 288; 307; 333; 415; 426; 485
|
|
| 21; 38; 127; 184; 259; 308; 379; 414; 427; 486
|
|
| 22; 39; 128; 183; 289; 309; 332; 413; 428; 487
|
|
| 23; 40; 129; 182; 260; 310; 380; 412; 429; 488
|
|
| 24; 41; 130; 181; 290; 311; 331; 411; 430; 489
|
|
| 25; 42; 131; 240; 261; 312; 381; 410; 432; 490
|
|
| 10; 43; 132; 239; 291; 313; 360; 409; 432; 451
|
|
| 11; 44; 133; 238; 262; 314; 382; 408; 433; 452
|
|
| 12; 45; 134; 237; 292; 315; 359; 407; 434; 453
|
|
| 13; 46; 135; 235; 263; 316; 383; 406; 435; 454
|
|
| 14; 47; 136; 235; 293; 317; 358; 405; 436; 455
|
|
| 15; 48; 137; 234; 264; 318;384; 404; 437; 456
|
|
| 25; 49; 138; 233; 294; 319; 357; 403; 438; 457
|
|
| 26; 50; 139; 232; 265; 320; 385; 402; 439; 458
|
|
| 27; 51; 140; 231; 295; 321; 356; 401; 440; 459
|
|
| 28; 52; 141; 230; 266; 322; 386; 400; 441; 460
|
|
| 29; 53; 142; 229; 296; 323; 355; 391; 442; 461
|
|
| 30; 54; 143; 228; 267; 324; 387; 392; 443; 462
|
|
| 1; 55; 144; 227; 297; 325; 354; 393; 444; 463
|
|
| 2; 56; 145; 226; 268; 326; 388; 394; 445; 464
|
|
| 3; 57; 146; 225; 298; 327; 353; 395; 446; 465
|
|
| 4; 58; 147; 224; 269; 328; 389; 396; 447; 466
|
|
| 5; 59; 148; 223; 299; 329; 352; 397; 448; 467
|
|
| 6; 60; 149; 222; 270; 330; 390; 398; 449; 468
|
|
| 7; 41; 150; 221; 300; 315; 351; 399; 450; 469
|
|
| 8; 42; 151; 220; 241; 314; 361; 400; 421; 470
|
|
| 9; 43; 152; 219; 290; 312; 350; 401; 422; 480
|
|
| 10; 44; 153; 218; 242; 313; 362; 402; 423; 481
|
|
| 11; 45; 154; 217; 289; 310; 349; 403; 424; 482
|
|
| 12; 46; 155; 216; 243; 306; 363; 404; 425; 483
|
|
| 13; 47; 156; 215; 288; 308; 348; 405; 426; 484
|
|
| 14; 48; 157; 214; 244; 305; 364; 406; 427; 485
|
|
| 15; 49; 158; 213; 287; 303; 347; 407; 428; 486
|
|
| 16; 50; 159; 212; 245; 302; 365; 408; 429; 487
|
|
| 17; 51; 160; 211; 286; 301; 346; 409; 430; 488
|
|
| 18;52; 161; 210; 246; 330; 366; 410; 431; 489
|
|
| 19; 53; 162; 209; 285; 329; 345; 411; 432; 490
|
|
| 20; 54; 163; 208; 247; 328; 367; 412; 433; 471
|
|
| 21; 55; 164; 207; 284; 327; 344; 413; 434; 472
|
|
| 22; 56; 165; 206; 248; 326; 368; 414; 435; 473
|
|
| 23; 57; 166; 205; 283; 324; 343; 415; 436; 474
|
|
| 24; 58; 167; 204; 249; 324; 369; 416; 437; 475
|
|
| 25; 59; 168; 203; 282; 323; 342; 417; 438; 476
|
|
| 26; 60; 169; 202; 250; 322; 370; 418; 439; 477
|
|
| 27; 31; 170; 201; 281; 321; 341; 419; 440; 478
|
|
| 28; 32; 171; 200; 251; 320; 371; 420; 441; 479
|
|
| 29; 33; 172; 199; 280; 319; 340; 391; 442; 460
|
|
| 30; 34; 173; 198; 252; 318; 372; 393; 443; 461
|
|
| 1; 35; 174; 197; 279; 317; 339; 395; 444; 462
|
|
| 2; 36; 175; 196; 253; 316; 373; 392; 445; 463
|
|
| 3; 37; 176; 195; 278; 315; 338; 396; 446; 464
|
|
| 4; 38; 177; 194; 254; 314; 374; 394; 447; 465
|
|
| 5; 39; 180; 193; 277; 313; 337; 397; 448; 466
|
|
| 6; 40; 151; 192; 255; 312; 375; 400; 449; 467
|
|
| 7; 41; 152; 191; 276; 311; 336; 398; 450; 468
|
|
| 8; 42; 153; 190; 256; 310; 376; 402; 421; 469
|
|
| 9; 43; 154; 189; 275; 309; 335; 399; 422; 470
|
|
| 10; 44; 155; 188; 257; 308; 377; 401; 423; 480
|
|
| 11; 45; 156; 187; 274; 307; 334; 404; 424; 481
|
|
| 12; 46; 157; 186; 258; 306; 378; 403; 425; 482
|
|
| 13; 47; 158; 185; 273; 305; 333; 407; 426; 483
|
|
| 14; 48; 159; 184; 259; 304; 379; 405; 427; 484
|
|
| 15; 49; 160; 183; 272; 303; 332; 408; 428; 485
|
|
| 16; 50; 161; 182; 260; 302; 380; 406; 429; 486
|
|
| 20; 51; 163; 181; 271; 301; 331; 409; 430; 488
|
№ 1 СТРОЕНИЕ АТОМА
Задание:
1. Составить электронную формулу атома А с учетом минимума энергии и графическую формулу для валентных электронов. Показать распределение электронов по энергетическим уровням. Определить число протонов, электронов, нейтронов.
Определить устойчивое/неустойчивое/состояние атома и возможный провал электронов. Составить электронную формулу с учетом провала электронов (если есть).
2. Определить возможные ковалентные состояния атома Б и ковалентность ионов, образуемых данным атомом. Напишите электронные формулы для ионов. Для валентных электронов атома Б укажите набор всех четырех квантовых чисел.
Таблица 2.
| Номер задания
| А
| Б
| Номер задания
| А
| Б
|
|
| 71 Lu
| N0, N-3 , N+3
|
| 95Am
| Se0, Se+2, Se-2
|
|
| 69 Tm
| C0, C-4, C+2
|
| 102 No
| P0, P+3, P-3
|
|
| 68 Er
| S0, S-2, S+4
|
| 100 Fm
| S0, S-2, S+6
|
|
| 83 Bi
| Cl0, Cl+, Cl-
|
| 85 At
| N0, N-3 , N+4
|
|
| 89Ac
| O0, O-2, O+1
|
| 99 Es
| Cl0, Cl+3, Cl-
|
|
| 84 Po
| N0, N-3 , N+2
|
| 88 Ra
| C0, C-4, C+4
|
|
| 58 Ce
| Br0, Br-, Br+7
|
| 37 Rb
| O0, O-1, O+2
|
|
| 77 Ir
| P0, P+5,P-3
|
| 97 Bk
| As0, As-3, As+3
|
|
| 65Tb
| Se0, Se+4, Se-2
|
| 96 Cm
| Se0, Se+2, Se-2
|
|
| 59Pr
| As0,As-3, As+5
|
| 67Ho
| P0, P+5,P+3
|
|
| 92U
| N0, N+1 , N+5
|
| 69Tm
| Br0, Br+5, Br+3
|
|
| 70Yb
| P0, P+3, P-3
|
| 63Eu
| Mn0,Mn+7,Mn+2
|
|
| 101Md
| Cl0, Cl+3, Cl+5
|
| 94Pu
| S0, S-2, S+4
|
|
| 60Nb
| Br0, Br-, Br+3
|
| 98Cf
| Ge0, Ge+4,Ge+2
|
|
| 91Pa
| N0, N-3 , N+2
|
| 64Cd
| As0, As-3, As+3
|
№ 2. ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ МОЛЕКУЛ
Задание:
1. Определите тип гибридизации центрального атома, валентный угол и изобразите электронную и пространственную конфигурацию молекулы.
2. Определите вид химической связи и полярность/неполярность/ молекулы в целом. Используйте справочные данные по электроотрицательности элементов (приложение 1).
Таблица 3.
| № задания
| Молекула
| № задания
| Молекула
|
|
| PCl5
|
| SOCl2
|
|
| SbH3
|
| PF5
|
|
| SO3
|
| CCl4
|
|
| SF6
|
| BCl3
|
|
| BF3
|
| CO2
|
|
| H2S
|
| BrF5
|
|
| CF4
|
| OF2
|
|
| SOF4
|
| SF6
|
|
| SCl2
|
| SeO2
|
|
| AsCl3
|
| SeF6
|
|
| CS2
|
| PCI3
|
|
| BrF3
|
| IF7
|
|
| SO2
|
| BCI3
|
|
| SF4
|
| ClF5
|
|
| SbBr3
|
| SeF4
|
№ 3. ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Критерием возможности самопроизвольного протекания реакции в данных условиях является изменение энергии Гиббса (ΔG):
ΔG = ΔH – TΔS,
где T – абсолютная температура, К;
ΔH – энтальпийный фактор, кДж/моль;
TΔS – энтропийный фактор, Дж/моль·К.
Если ΔG < 0, то прямая реакция может протекать самопроизвольно.
Если ΔG > 0, то самопроизвольно может протекать обратная реакция.
Для расчета ΔН0, ΔG0, DS0 химических реакций применяют закон Гесса или его следствия. Если нужно рассчитать энергию Гиббса для температуры, отличной от стандартной, то используют уравнение Улиха:
ΔG0т = ΔН0т – TDS0т ,
где ΔН0 и DS0 – величины, зависящие от температуры.
Температура химического равновесия: 
Энергия Гиббса: ΔG0т = – RT ln Kт
где R – универсальная газовая постоянная, 8,31·10-3 кДж/моль·К
 .
.
При выполнении задания используйте справочные данные стандартных величин (приложение 2).
Задание:
1. Рассчитайте тепловой эффект реакции в стандартных условиях  . Укажите, выделяется или поглощается теплота при протекании этой реакции. Возможно ли самопроизвольное протекание реакции в сторону продуктов?
. Укажите, выделяется или поглощается теплота при протекании этой реакции. Возможно ли самопроизвольное протекание реакции в сторону продуктов?
2. По уравнению реакции и агрегатным состояниям вещества качественно оцените изменение энтропии реакции  . Объясните полученный результат.
. Объясните полученный результат.
3. Рассчитайте  реакции по значениям стандартных энтропий участников реакции
реакции по значениям стандартных энтропий участников реакции  . Возможно ли самопроизвольное протекание реакции в сторону продуктов?
. Возможно ли самопроизвольное протекание реакции в сторону продуктов?
4. Качественно оцените направление протекания реакции:
а) при высоких температурах, т.е. при  ;
;
б) при низких температурах, т.е. при  .
.
5. Рассчитайте изменение энергии Гиббса  при Т1=298К и Т2(К). Укажите, какой фактор – энтальпийный или энтропийный определяет знак
при Т1=298К и Т2(К). Укажите, какой фактор – энтальпийный или энтропийный определяет знак  и
и  .
.
6. Рассчитайте температуру химического равновесия.
7. Постройте график зависимости  от температуры. Укажите, как влияет изменение температуры на направление реакции.
от температуры. Укажите, как влияет изменение температуры на направление реакции.
8. Рассчитайте термодинамическую константу равновесия  для реакции при
для реакции при  и
и  . Укажите, при какой из этих температур равновесная смесь богаче продуктами реакции.
. Укажите, при какой из этих температур равновесная смесь богаче продуктами реакции.
9. Сделайте вывод: при каких температурах реакция протекает в сторону продуктов?
Таблица 4.
| № задания
| Реакция
| Т2, К
|
|
| Fe2O3(к)+3Н2 (г)=2Fe(к)+ 3H2O(г)
|
|
|
| СO2 (г) + 4H2(г) = СН4 (г)+2Н2О (г)
|
|
|
| Fe3O4(k)+4H2(г)=3Fe(k)+4H2O(г)
|
|
|
| SО2(г) +Cl2(г) = SО2Cl2(г)
|
|
|
| 4NH3(г)+5O2(г)=4NO(г)+6H2O(г)
|
|
|
| 4HCl(г)+O2(г)= 2Cl2(г)+2H2O(г)
|
|
|
| 2H2S(г)+3O2(г)=2SO2(г)+2H2O(г)
|
|
|
| 4Fe(OH)2(k)+O2(г)+2H2O(г)=4Fe(OH)3(k)
|
|
|
| 2HF(г)+O3(г)=H2O(г)+F2(г)+O2(г)
|
|
|
| 2H2S(г)+SO2(г)=3S(к)+2Н2О(г)
|
|
|
| CS2(г0+3O2(г)=CO2(г)+2SO2(г)
|
|
|
| 4NH3(г)+3O2(г)=2N2(г)+6H2O(г)
|
|
|
| СН4(г)+2Н2О(г)=СО2(г)+4Н2(г)
|
|
|
| Fe2O3(k)+3H2(г)=2Fe(k)+3H2O(г)
|
|
|
| O3(г)+H2O2(ж)=2O2(г)+H2O(ж)
|
|
|
| 2CuS(k)+3O2(г)=2СuO(k)+2SO2(г)
|
|
|
| СН4(г)+2Н2О(г) = СO2 (г)+4H2(г)
|
|
|
| Al2O3(k)+3SO3(г)=Al2(SO4)3(k)
|
|
|
| 2AgNO3(k)=2Ag(k)+2NO2(г)+O2(г)
|
|
|
| 2NaHCO3(k)=Na2CO3(k)+H2O(г)+CO2(г)
|
|
|
| СН4 (г)+2О2 (г) = СO2 (г) + 2H2О(г)
|
|
|
| 2Al2O3(к)+6SO2(г)+3O2(г)=2Al2(SO4)3(к)
|
|
|
| 4FeS2(k)+11O2(г)=2Fe2O3(k)+8SO2(г)
|
|
|
| 2H2S(г)+O2(г)=2H2O(г)+2S(k)
|
|
|
| 2SO2(г)+2Н2О(ж)+O2(г) = 2H2SО4(ж)
|
|
|
| 2СаO(к)+4NO2(г) + 3O2(г) = 2Cа(NO3)2(к)
|
|
|
| 4NO2(г)+3O2(г)+2H2O(ж)=4HNO3(ж)
|
|
|
| 4HBr(г)+O2(г)=2Br2(г)+2H2O(г)
|
|
|
| 4CO(г)+2SO2(г)=4CO2(г)+2S(к)
|
|
|
| 2Pb(NO3)2(k)=2PbO(k)+4NO2(г)+O2(г)
|
|
№ 4. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Закон действующих масс: V=k·  ·
· 
где 
 – концентрации веществ А и В;
– концентрации веществ А и В;
а и в – стехиометрические коэффициенты.
Принцип Ле-Шателье: для смещения равновесия в сторону продуктов реакции, системе необходимо оказать противодействие по температуре, давлению, концентрации. При понижении температуры и повышении давления, мы окажем системе содействие, следовательно, равновесие сместится в сторону аммиака.
Правило Вант-Гоффа: 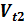 =
=  ;
;
где  ;
;  – скорости реакции при температурах t1 и t2
– скорости реакции при температурах t1 и t2
Ɣ – температурный коэффициент скорости реакции.
Задание:
1. Написать выражение скорости химической реакции по закону действующих масс.
2. Определить, как изменится скорость реакции, если концентрацию реагентов увеличить в (А) раз, объем реакционной смеси увеличить в (Б) раз.
3. Определить направление протекания реакции, при изменении температуры и давления (В). Пояснить на основании принципа Ле-Шателье.
Таблица 5.
| №
задания
| Уравнение реакции
| А
| Б
| В
|
|
| 
|
|
| Температуру повысить
Давление понизить
|
|
| 
|
|
| Температуру повысить
Давление повысить
|
|
| 
|
|
| Температуру понизить
Давление понизить
|
|
| 
|
|
| Температуру понизить
Давление повысить
|
|
| 
|
|
| Температуру повысить
Давление понизить
|
|
| 
|
|
| Температуру повысить
Давление повысить
|
|
| 
|
|
| Температуру понизить
Давление понизить
|
|
| 
|
|
| Температуру понизить
Давление повысить
|
|
| 
|
|
| Температуру повысить
Давление понизить
|
|
| 
|
|
| Температуру повысить
Давление повысить
|
|
| 
|
|
| Температуру понизить
Давление понизить
|
|
| 
|
|
| Температуру понизить
Давление повысить
|
|
| 
|
|
| Температуру повысить
Давление понизить
|
|
| 
|
|
| Температуру повысить
Давление повысить
|
|
| 
|
|
| Температуру понизить
Давление понизить
|
|
| 
|
|
| Температуру понизить
Давление повысить
|
|
| 
|
|
| Температуру повысить
Давление понизить
|
|
| 
|
|
| Температуру повысить
Давление повысить
|
|
| 
|
|
| Температуру понизить
Давление понизить
|
|
| 
|
|
| Температуру понизить
Давление повысить
|
|
| 
|
|
| Температуру повысить
Давление понизить
|
|
| 
|
|
| Температуру повысить
Давление повысить
|
|
| 
|
|
| Температуру понизить
Давление понизить
|
|
| 
|
|
| Температуру понизить
Давление повысить
|
|
| 
|
|
| Температуру повысить
Давление понизить
|
|
| 
|
|
| Температуру повысить
Давление повысить
|
|
|  - Q - Q
|
|
| Температуру понизить
Давление понизить
|
|
|  - Q - Q
|
|
| Температуру понизить
Давление повысить
|
|
|  + Q + Q
| 3
|
| Температуру повысить
Давление понизить
|
|
|  + Q + Q
| 4
|
| Температуру повысить
Давление повысить
|
Задачи:
121. На сколько градусов надо повысить температуру в реакционной смеси, чтобы скорость реакции увеличилась в 81 раз. Температурный коэффициент равен 3.
122. Скорость реакции при 0С0 равна 0,1 моль/л·с. Вычислить скорость этой реакции при 30 С0, если температурный коэффициент равен 2.
123. При температуре 20 С0 реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 50 С0, если температурный коэффициент равен 2.
124. При увеличении температуры на 30 С0 скорость реакции увеличивается в 9 раз. Как изменится скорость этой реакции при повышении температуры на 40 С0.
125. При  реакция заканчивается за 16 мин. За какое время закончится эта реакция при 200 С0, если температурный коэффициент равен 2.
реакция заканчивается за 16 мин. За какое время закончится эта реакция при 200 С0, если температурный коэффициент равен 2.
126. При 30 С0 реакция протекает за 25 мин, при 50 С0 реакция протекает за 4мин. Рассчитайте температурный коэффициент скорости реакции.
127. При температуре 20 С0 реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 0 С0, если температурный коэффициент равен 2
128. На сколько градусов надо снизить температуру в реакционной смеси, чтобы скорость реакции уменьшилась в 27 раз. Температурный коэффициент равен 3.
129. При увеличении температуры реакционной смеси на  скорость реакции увеличивается в 4 раза. Во сколько раз увеличится скорость при повышении температуры от 40 С0 до 70 С0?
скорость реакции увеличивается в 4 раза. Во сколько раз увеличится скорость при повышении температуры от 40 С0 до 70 С0?
130. При увеличении температуры на 20 С0 скорость реакции увеличилась в 6 раз. Как изменится скорость реакции при увеличении температуры от 20 С0 до 80 С0?
131. Реакция при 50 С0 протекает за 2 мин 15с. За какое время закончится эта реакция при 70 С0, если температурный коэффициент равен 3.
132. При 400 С0реакция протекает за 40 мин. Через сколько минут закончится эта реакция при 350 С0, если температурный коэффициент равен 2.
133. При увеличении температуры на 60 С0 скорость реакции увеличилась в 64 раза. Чему равен температурный коэффициент.
134. Во сколько раз уменьшиться скорость реакции, если температуру газовой смеси понизить от 140 С0 до 100 С0, если температурный коэффициент равен 3.
135. Во сколько раз и как изменится скорость реакции при снижении температуры от 40 С0 до 10 С0, если температурный коэффициент равен 3.
136. Чему равен температурный коэффициент реакции, если при увеличении температуры на 50 С0 скорость реакции увеличилась в 32 раза.
137. Скорость химической реакции при 20 С0 равна 2 моль/л. Вычислить скорость реакции при 60 С0, если температурный коэффициент равен 3.
138. На сколько градусов необходимо увеличить температуру реакции, чтобы её скорость увеличилась в 729 раз? Температурный коэффициент равен 3.
139. При увеличении температуры на 50 С0 скорость реакции увеличилась в 1024 раз. Вычислить температурный коэффициент.
140. На сколько градусов надо понизить температуру реакционной смеси для уменьшения скорости реакции в 27 раз, если температурный коэффициент равен 3.
141. Скорость некоторой реакции увеличивается в 3 раза при повышении температуры на 10С0. Во сколько раз увеличивается скорость при повышении температуры от 30 С0 до 80 С0.
142. Как изменится скорость реакции при повышении температуры от 25 С0 до 85 С0, если температурный коэффициент реакции равен 2.
143. Скорость реакции возросла в 124 раза. На сколько градусов была повышена температура, если температурный коэффициент скорости реакции равен 2,8?
144. При повышении температуры на 50 С0 скорость реакции возросла в 1200 раз. Вычислить температурный коэффициент.
145. Во сколько раз вырастет скорость реакции с повышением температуры от 40 С0 до 70 С0, если известно, что повышение температуры на каждые  увеличивает скорость реакции в3 раза?
увеличивает скорость реакции в3 раза?
146. На сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 8 раз, если температурный коэффициент равен 2.
147. Во сколько раз увеличится скорость реакции, если температура повысилась на 300С, температурный коэффициент равен 3.
148. При повышении температуры на 60 С0 скорость реакции увеличилась в 4 000 раз. Вычислить температурный коэффициент.
149. При 80 0С реакция заканчивается за 20 сек. Вычислите время протекания реакции при 30 0С, если температурный коэффициент этой реакции равен 2,5.
150. Вычислите, при какой температуре реакция закончится за 45 минут, если при 293К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3,2.
151. Для реакции 2NO2↔2NO+O2 вычислить константу равновесия и начальную концентрацию NO2, если равновесные концентрации равны [NO2]=0,006 моль/л; [NO]=0,024моль/л.
152. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=0,37моль/л; [O2]=1,74моль/л; [H2O]=3,78моль/л.
153. Для реакции COCl2↔CO + Cl2. Вычислить константу равновесия и начальную концентрацию COCl2, если [COCl2]=4,65·10-5моль/л; [CO]=[Cl2]= 0,001моль/л.
154. Для реакции 4NO+6H2O↔4NH3+5O2 вычислить начальные концентрации и равновесную концентрацию [NH3], если [NO]=2,44моль/л; [H2O]=1,58моль/л; [O2]=0,65 моль/л.
155. Для реакции 2NO2↔2NO+O2 вычислить константу равновесия и С0(NO2) если [NO2]=0,02моль/л; [NO]=0,08моль/л; [O2]=0,16 моль/л.
156. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=2,44 моль/л; [O2]=0,59 моль/л; [H2O]=8,22 моль/л.
157. Для реакции 4NO+6H2O↔4NH3+5O2 Вычислить начальные концентрации реагентов и равновесную концентрацию [NH3], если [NO]=3,86 моль/л; [H2O]=2,47моль/л; [O2]=1,35 моль/л.
158. Для реакции CO2+Н2↔CO+H2O вычислить константу равновесия и начальные концентрации исходных веществ, если [CO2]=0,02моль/л; [H2]=0,005моль/л; [CO]=0,015моль/л; [H2O]=0,015моль/л.
159. Для реакции SO3+CO↔SO2+CO2 рассчитать равновесные концентрации веществ, если Кр =1,89; С0(CO)=0,95моль/л.
160. Для реакции N2 + 3H2↔2NH3. Вычислить Кр и исходные концентрации реагентов, если [NH3]=0,4моль/л; [N2] =0,03моль/л; [Н2] =0,1моль/л.
161. Для реакции 2NF3+3H2↔6HF+N2 вычислить [HF] и первоначальные концентрации реагентов, если [NF3]=0,86моль/л; [Н2] =0,43моль/л;
[N2] =1,24моль/л.
162. Для реакции H2+ SO3↔H2O+SO2. Рассчитать равновесные концентрации веществ, если Кр=1,36; С0(H2)=С0(SO3)=0,65моль/л.
163. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=1,63моль/л; [O2]=2,15моль/л; [H2O]=7,44моль/л.
164. Для реакции 2NO+Cl2↔2NOCl вычислить константу равновесия, если С0(NO)=0,5моль/л; С0(Cl2)=0,2моль/л; а к моменту равновесия прореагировало 20% NO.
165. Для реакции 2NF3+3H2↔6HF+N2 вычислить [HF] и первоначальные концентрации реагентов, если [NF3]=1,15моль/л; [Н2] =0,72моль/л;
[N2] =0,97моль/л.
166. Для реакции CO+Н2О↔ CO2+H2 вычислить равновесные концентрации веществ, если Кр=2,25; С0(CO)=С0(Н2О)=0,75моль/л.
167. Для реакции  вычислить
вычислить  и
и  , если
, если  ;
; 

168. Для реакции  . Определить
. Определить  и начальные концентрации реагентов, если
и начальные концентрации реагентов, если 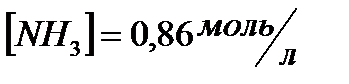 ;
;  ;
; 
169. Для реакции  вычислить
вычислить  и начальные концентрации реагентов, если
и начальные концентрации реагентов, если 



170. Для реакции  рассчитать равновесные концентрации веществ, если
рассчитать равновесные концентрации веществ, если  ,
,  .
.
171. Для реакции  вычислить
вычислить  , если
, если  ;
;  ;
; 
172. Для реакции  вычислить
вычислить  и начальные концентрации реагентов, если
и начальные концентрации реагентов, если 



173. Для реакции 
 ,
,  . Определить
. Определить 
174. Для реакции  . вычислить
. вычислить  и начальные концентрации реагентов, если
и начальные концентрации реагентов, если  ;
; 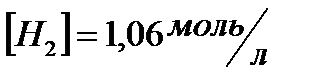 ;
; 
175. Для реакции  вычислить равновесные концентрации веществ, если
вычислить равновесные концентрации веществ, если  ;
; 
176. Для реакции 
 ,
,  . Определить
. Определить 
177. Рассчитать равновесные концентрации веществ для реакции  , если
, если  ;
;  ;
; 
178. Для реакции  вычислить
вычислить  и исходные концентрации веществ, если:
и исходные концентрации веществ, если:  ;
;  ;
; 
179. Рассчитайте равновесную концентрацию водорода в реакции 2НJ(г) = H2(г)+J2(г), если исходная концентрация НJ составляет 0,55 моль/л, а константа равновесия равна 0,12.
180. Равновесие гомогенной системы  установилось при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л; [ O2] = 0,32 моль/л; [ Cl2] = 0,14 моль/л; [ Н2О] = 0,14 моль/л. Вычислите исходные концентрации кислорода и хлороводорода.
установилось при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л; [ O2] = 0,32 моль/л; [ Cl2] = 0,14 моль/л; [ Н2О] = 0,14 моль/л. Вычислите исходные концентрации кислорода и хлороводорода.
№ 5. РАСТВОРЫ




 .
. . Укажите, выделяется или поглощается теплота при протекании этой реакции. Возможно ли самопроизвольное протекание реакции в сторону продуктов?
. Укажите, выделяется или поглощается теплота при протекании этой реакции. Возможно ли самопроизвольное протекание реакции в сторону продуктов? . Объясните полученный результат.
. Объясните полученный результат. реакции по значениям стандартных энтропий участников реакции
реакции по значениям стандартных энтропий участников реакции  . Возможно ли самопроизвольное протекание реакции в сторону продуктов?
. Возможно ли самопроизвольное протекание реакции в сторону продуктов? ;
; .
. при Т1=298К и Т2(К). Укажите, какой фактор – энтальпийный или энтропийный определяет знак
при Т1=298К и Т2(К). Укажите, какой фактор – энтальпийный или энтропийный определяет знак  и
и  .
. от температуры. Укажите, как влияет изменение температуры на направление реакции.
от температуры. Укажите, как влияет изменение температуры на направление реакции. для реакции при
для реакции при  и
и  . Укажите, при какой из этих температур равновесная смесь богаче продуктами реакции.
. Укажите, при какой из этих температур равновесная смесь богаче продуктами реакции. ·
· 

 – концентрации веществ А и В;
– концентрации веществ А и В;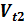 =
=  ;
; ;
;  – скорости реакции при температурах t1 и t2
– скорости реакции при температурах t1 и t2
























 - Q
- Q
 - Q
- Q
 + Q
+ Q
 + Q
+ Q
 реакция заканчивается за 16 мин. За какое время закончится эта реакция при 200 С0, если температурный коэффициент равен 2.
реакция заканчивается за 16 мин. За какое время закончится эта реакция при 200 С0, если температурный коэффициент равен 2. скорость реакции увеличивается в 4 раза. Во сколько раз увеличится скорость при повышении температуры от 40 С0 до 70 С0?
скорость реакции увеличивается в 4 раза. Во сколько раз увеличится скорость при повышении температуры от 40 С0 до 70 С0? увеличивает скорость реакции в3 раза?
увеличивает скорость реакции в3 раза? вычислить
вычислить  и
и  , если
, если  ;
; 

 . Определить
. Определить  и начальные концентрации реагентов, если
и начальные концентрации реагентов, если 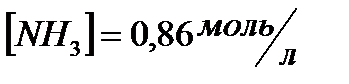 ;
;  ;
; 
 вычислить
вычислить  и начальные концентрации реагентов, если
и начальные концентрации реагентов, если 



 рассчитать равновесные концентрации веществ, если
рассчитать равновесные концентрации веществ, если  ,
,  .
. вычислить
вычислить  , если
, если  ;
;  ;
; 




 ,
,  . Определить
. Определить 
 . вычислить
. вычислить  и начальные концентрации реагентов, если
и начальные концентрации реагентов, если  ;
; 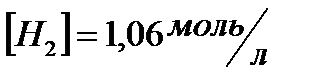 ;
; 
 вычислить равновесные концентрации веществ, если
вычислить равновесные концентрации веществ, если  ;
; 

 , если
, если  ;
;  ;
; 
 вычислить
вычислить  и исходные концентрации веществ, если:
и исходные концентрации веществ, если:  ;
;  ;
; 
 установилось при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л; [ O2] = 0,32 моль/л; [ Cl2] = 0,14 моль/л; [ Н2О] = 0,14 моль/л. Вычислите исходные концентрации кислорода и хлороводорода.
установилось при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л; [ O2] = 0,32 моль/л; [ Cl2] = 0,14 моль/л; [ Н2О] = 0,14 моль/л. Вычислите исходные концентрации кислорода и хлороводорода.

