Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0° С (273К) и
101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm.
Таким образом, при нормальных условиях (н.у.) молярный объем любого газа Vm = 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным используется объединенный газовый закон Бойля-Мариотта и Гей-Люссака:
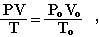
где Рo, Vo, Тo - давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество (n) газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева - Клапейрона:
PV = n RT,
где n = m/M - отношение массы вещества к его молярной массе,
R - универсальная газовая постоянная, равная 8,31 Дж/(мольЧК).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
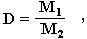
где М1 и М2 - молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:
M1 = D Ч M2.
Калоритические параметры состояния
Замкнутое математическое описание процессов в рабочем теле можно построить, если установлена зависимость внутренней энергии газа от термических параметров. Аналитическое выражение, устанавливающее эту связь называют калорическим уравнением состояния.
Вид калорического уравнения однозначно определяется термическим уравнением состояния.
Вспомним понятие теплоемкости
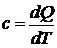
Q – количество тепла, поглощенное рабочим телом
T – температура рабочего тела
Чаще используют понятие удельной теплоемкости c.
Величины теплоемкости зависят от характера термодинамического процесса; важными термодинамическими величинами являются теплоемкость при постоянном объеме ( ) и теплоемкость при постоянном давлении (
) и теплоемкость при постоянном давлении (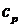 ). Величины этих теплоемкостейзависят от температуры и удельного объема газа. По мере уменьшения плотности зависимость теплоемкости от удельного объема уменьшается. В состоянии сильного разряжения (в идеальном газе) теплоемкости (
). Величины этих теплоемкостейзависят от температуры и удельного объема газа. По мере уменьшения плотности зависимость теплоемкости от удельного объема уменьшается. В состоянии сильного разряжения (в идеальном газе) теплоемкости ( и
и 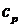 ) зависят только от температуры.
) зависят только от температуры.
Установим зависимость для внутренней энергии функцией от термических параметров для идеального газа.



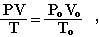
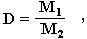
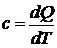
 ) и теплоемкость при постоянном давлении (
) и теплоемкость при постоянном давлении (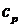 ). Величины этих теплоемкостейзависят от температуры и удельного объема газа. По мере уменьшения плотности зависимость теплоемкости от удельного объема уменьшается. В состоянии сильного разряжения (в идеальном газе) теплоемкости (
). Величины этих теплоемкостейзависят от температуры и удельного объема газа. По мере уменьшения плотности зависимость теплоемкости от удельного объема уменьшается. В состоянии сильного разряжения (в идеальном газе) теплоемкости (


