

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Оснащения врачебно-сестринской бригады.
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Уравнение состояние идеального газа.
Уравнение состояния идеального газа (иногда уравнение Менделеева — Клапейрона или уравнение Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
{\displaystyle p\cdot V_{M}=R\cdot T,}
где
Так как {\displaystyle V_{M}={\frac {V}{\nu }},} где {\displaystyle \nu } — количество вещества, а {\displaystyle \nu ={\frac {m}{M}},} где {\displaystyle m} — масса, {\displaystyle M} — молярная масса, уравнение состояния можно записать:
{\displaystyle p\cdot V={\frac {m}{M}}R\cdot T.}
Или в виде
{\displaystyle p=nkT,}
где {\displaystyle n=N/V} — концентрация атомов, {\displaystyle k={\frac {R}{N_{A}}}} — постоянная Больцмана.
Эта форма записи носит имя уравнения (закона) Клапейрона — Менделеева.
Уравнение, выведенное Клапейроном, содержало некую не универсальную газовую постоянную {\displaystyle r,} значение которой необходимо было измерять для каждого газа:
{\displaystyle p\cdot V=r\cdot T.}
Менделеев же обнаружил, что {\displaystyle r} прямо пропорциональна {\displaystyle \nu,} коэффициент пропорциональности {\displaystyle R} он назвал универсальной газовой постоянной.
Связь с другими законами состояния идеального газа[править | править вики-текст]
В случае постоянной массы газа уравнение можно записать в виде:
{\displaystyle {\frac {p\cdot V}{T}}=\nu \cdot R,}
{\displaystyle {\frac {p\cdot V}{T}}=\mathrm {const}.}
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
{\displaystyle T=\mathrm {const} \Rightarrow p\cdot V=\mathrm {const} } — закон Бойля — Мариотта.
{\displaystyle p=\mathrm {const} \Rightarrow {\frac {V}{T}}=\mathrm {const} } — Закон Гей-Люссака.
|
|
{\displaystyle V=\mathrm {const} \Rightarrow {\frac {p}{T}}=\mathrm {const} } — закон Шарля (второй закон Гей-Люссака, 1808 г.)
А в форме пропорции {\displaystyle {\frac {p_{1}\cdot V_{1}}{T_{1}}}={\frac {p_{2}\cdot V_{2}}{T_{2}}}} этот закон удобен для расчёта перевода газа из одного состояния в другое.
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
{\displaystyle {\ce {{H_{2}}+Cl_{2}->2HCl.}}}
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
{\displaystyle {\ce {{N_{2}}+3H_{2}->2{NH_{3}}.}}}
Закон Бойля — Мариотта
Закон Бойля — Мариотта
{\displaystyle T=\mathrm {const} \Rightarrow p\cdot V=\mathrm {const} }
назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
{\displaystyle p=(\gamma -1)\rho \varepsilon,}
где {\displaystyle \gamma } — показатель адиабаты, {\displaystyle \varepsilon } — внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение {\displaystyle P\cdot V} немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение {\displaystyle P\cdot V} увеличивается.
|
|
Закон авагардо.
Замкнутое математическое описание процессов в рабочем теле можно построить, если установлена зависимость внутренней энергии газа от термических параметров. Аналитическое выражение, устанавливающее эту связь называют калорическим уравнением состояния.
Отношение теплоемкостей
 (1.14)
(1.14)
Для идеального газа  .
.
Величина  для любого газа можно определить априорно.
для любого газа можно определить априорно.
 для однородного газа определяется числом атомов в молекуле.
для однородного газа определяется числом атомов в молекуле.
- для одноатомного газа 
- для двухатомного газа 
- для трех и более атомных газов 
Из (1.14) и (1.13) получим формулы, определения  и
и 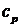
 (1.15)
(1.15)
 (1.15.а)
(1.15.а)
Из формул (1.15), (1.15.а) и (1.12) получаем
 (1.16)
(1.16)
 (1.17)
(1.17)
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая удельная теплоёмкость (С), также называемая просто удельной теплоёмкостью — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (С μ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Теплоёмкость для различных процессов и состояний вещества[править | править вики-текст]
|
|
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме (для одного моля идеального газа) равна:
{\displaystyle c_{v}={\frac {i}{2}}R,}
где {\displaystyle R} ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная.
А при постоянном давлении
{\displaystyle c_{p}=c_{v}+R={\frac {i+2}{2}}R.}
Переход вещества из одного агрегатного состояния в другое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления (переход твёрдого тела в жидкость), температура кипения (переход жидкости в газ) и, соответственно, температуры обратных превращений: замерзания и конденсации.
Удельные теплоёмкости многих веществ приведены в справочниках обычно для процесса при постоянном давлении. К примеру, удельная теплоёмкость жидкой воды при нормальных условиях — 4200 Дж/(кг·К); льда — 2100 Дж/(кг·К).
Теория теплоёмкости[править | править вики-текст]

Энтальпия
Энтальпия системы (от греч. enthalpo нагреваю) – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением
|
где V – объем системы.
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
|
| (4.1) |
Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, Δ H < 0), а поглощение системой теплоты соответствует эндотермическому процессу, Δ H > 0.
|
|
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии Δ H указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное. Например, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так:

|
При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии:

|

|
Приведенные энтальпии образования веществ и энтальпии реакций отнесены к стандартным условиям (P = 101,325 кПа) и взяты для температуры T = 298 K. Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами:  нижний индекс обычно опускают: Δ
нижний индекс обычно опускают: Δ 
Понятие эндропия
Энтропи́я (от др.-греч. ἐντροπία «поворот», «превращение») — широко используемый в естественных и точных науках термин. Впервые введён в рамках термодинамики как функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии. В статистической физике энтропия характеризует вероятность осуществления какого-либо макроскопического состояния. Кроме физики, термин широко употребляется в математике: теории информации и математической статистике.
Энтропия может интерпретироваться как мера неопределённости (неупорядоченности) некоторой системы, например, какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации[1][2]. Таким образом, другой интерпретацией энтропии является информационная ёмкость системы. С данной интерпретацией связан тот факт, что создатель понятия энтропии в теории информации (Клод Шеннон) сначала хотел назвать эту величину информацией.
Понятие информационной энтропии применяется как в теории информации и математической статистике, так и в статистической физике (энтропия Гиббса и её упрощённый вариант — энтропия Больцмана)[3][4]. Математический смысл информационной энтропии — это логарифм числа доступных состояний системы (основание логарифма может быть различным, оно определяет единицу измерения энтропии)[5]. Такая функция от числа состояний обеспечивает свойство аддитивности энтропии для независимых систем. Причём, если состояния различаются по степени доступности (то есть не равновероятны), под числом состояний системы нужно понимать их эффективное количество, которое определяется следующим образом. Пусть состояния системы равновероятны и имеют вероятность {\displaystyle p}, тогда число состояний {\displaystyle N=1/p}, а {\displaystyle \log N=\log(1/p).}
|
|
В случае разных вероятностей состояний {\displaystyle p_{i}} рассмотрим средневзвешенную величину {\displaystyle \log {\overline {N}}=\sum _{i=1}^{N}p_{i}\log(1/p_{i}),} где {\displaystyle {\overline {N}}} — эффективное количество состояний. Из данной интерпретации непосредственно вытекает выражение для информационной энтропии Шеннона
{\displaystyle H=\log {\overline {N}}=-\sum _{i=1}^{N}p_{i}\log p_{i}.}
Подобная интерпретация справедлива и для энтропии Реньи, которая является одним из обобщений понятия информационная энтропия, но в этом случае иначе определяется эффективное количество состояний системы (можно показать, что энтропии Реньи соответствует эффективное количество состояний, определяемое как среднее степенное взвешенное с параметром {\displaystyle q\leq 1} от величин {\displaystyle 1/p_{i}})[6].
В широком смысле, в каком слово часто употребляется в быту, энтропия означает меру неупорядоченности или хаотичности системы: чем меньше элементы системы подчинены какому-либо порядку, тем выше энтропия.
6. первый закон термодинамики
Первый закон термодинамики
На рис. 3.9.1 условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.

|
| Рисунок 3.9.1. Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы |
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т. е. изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением Δ U внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
|
Определение энтропии
Энтропия определяется как:
S = H / T
где
S = энтропия (кДж/кг*К)
H = энтальпия (кДж/кг)
T = абсолютная температура (K)
Изменение энтропии системы вызвано изменением содержания темпла в ней. Изменение энтропии равно изменению темпла системы деленной на среднюю абсолютную температуру (Ta):
dS = dH / Ta
Сумма значений (H / T) для каждого полного цикла Карно равна 0. Это происходит из-за того, что каждому положительному H противостоит отрицательное значение H.
Цикл Карно— идеальный термодинамический цикл.


В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 --(изотермическое расширение) --> Положение 2 --(адиабатическое расширение) --> Положение 3 --(изотермическое сжатие) --> Положение 4 --(адиабатическое сжатие) --> Положение 1
Положение 1 - Положение 2: Изотермическое расширение
Изотермическое расширение. В начале процесса рабочее тело имеет температуру Th, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты QH. При этом объём рабочего тела увеличивается. QH=∫Tds=Th (S2-S1) =Th ΔS
Положение 2 - Положение 3: Адиабатическое расширение
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Положение 3 - Положение 4: Изотермическое сжатие
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру Tc, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Qc. Qc=Tc(S2-S1)=Tc ΔS
Положение 4 - Положение 1: Адиабатическое сжатие
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Законы термодинамики были определены эмперическим путем (эксперементально). Второй закон термодинамики - это обощение экспериментов, связанных с энтропией. Известно, что dS системы плюс dS окружающей среды равно или больше 0.
Пример - Энтропия при нагревании воды
Процесс нагревания 1 кг воды от 0 до 100oC (273 до 373 K) при нормальных условиях.
Удельная энтальпия для воды при 0oC = 0 кДж/кг (удельная - на единицу массы)
Удельная энтальпия для воды при 100oC = 419 кДж/кг
Изменение удельной энтропии:
dS = dH / Ta
= ((419 кДж/кг) - (0 кДж/кг)) / ((273 К + 373 К)/2)
= 1.297 кДж/кг*К
Пример - Энтропия при испарении воды
Процесс превращения 1 кг воды при 100oC (373 K) в насыщенный пар при 100oC (373 K) при нормальных условиях.
Удельная энтальпия пара при 100oC (373 K) до испарения = 0 кДж/кг
Удельная теплота парообразования 100oC (373 K) при испарении = 2 258 кДж/кг
Изменение удельной энтропии:
dS = dH / Ta
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды - это сумма удельной энтропии воды (при 0oC) плюс удельная энтропия пара (при температуре 100oC).
8 Термический КПД
Степень совершенства преобразования теплоты в механическую работу в термодинамическом цикле двигателя оценивается термическим (или тепловым, или термодинамическим) коэффициентом полезного действия ηt.
Термический КПД
Отношение работы, совершенной в прямом обратимом термодинамическом цикле, к теплоте, сообщенной рабочему телу от внешних источников.
В общем случае
ηt = At/Q1 = (Q1 – Q2)/Q1,
где At – тепло, преобразованное в цикле в работу; Q1 – тепло, подведённое в цикле к рабочему телу; Q2 – тепло, отданное в цикле рабочим телом.

|
| Термический КПД |
| На индикаторной диаграмме это отношение площадей работы за цикл At (область заштрихованая «в клетку») и подведённой в цикле к рабочему телу теплоты Q1 (вся заштрихованная область). |
Термический КПД термодинамического цикла показывает, какое количество получаемой теплоты машина превращает в работу в конкретных условиях протекания идеального цикла. Чем больше величина ηt, тем совершеннее цикл и тепловая машина.
В качестве критерия оценки термодинамических циклов часто используют цикл Карно, потому что КПД тепловой машины Карно максимален в том смысле, что никакая тепловая машина с теми же температурами нагревателя и холодильника не может обладать бόльшим КПД [1]. Формула для расчёта термического КПД данного цикла общеизвестна
ηt = (T1 – T2)/T1,
где T1 – абсолютная температура нагревателя; T2 – абсолютная температура холодильника.
Из анализа цикла Карно можно сделать следующие выводы:
1. КПД любого термодинамического цикла тем больше, чем больше разница температур нагревателя T1 и холодильника T2;
2. термический КПД никогда не достигает 100 %, потому что температура T2 в лучшем случае равна температуре окружающей среды;
Сегодня наибольшая разница температур достигнута в двигателях внутреннего сгорания, благодаря высокой температуре рабочего тела T1. Температура газов в цилиндре поршневого ДВС достигает 2000 °C и более, а в газовой турбине порядка 900 – 1300 °C, что связано с необходимость обеспечить жаропрочность лопаток турбины. Для двигателей с внешним подводом теплоты такие значения температур рабочего тела остаются пока недостижимыми из-за высокого термического сопротивления на границе нагреватель-рабочее тело. Температура пара в современных паровой турбине или поршневом паровом двигателе находится в диапазоне от 300 до 600 °C.
Стоит заметить, что высокий термический КПД не служит гарантией высокого эффективного КПД двигателя.
9.Тепрмодинамические процессы. Изохорный процесс.
Изохорический или изохорный процесс (от др.-греч. ἴσος — «равный» и χώρος — «место») — термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля не выполняется.
На графиках изображается линиями, которые называются изохоры. Для идеального газа они являются прямыми во всех диаграммах, которые связывают параметры: {\displaystyle T} (температура), {\displaystyle V} (объем) и {\displaystyle P} (давление).
Содержание
[скрыть]
История[править | править вики-текст]

Иллюстрация зависимости давления от температуры при постоянном объёме
Наиболее часто первые исследования изохорного процесса связывают с Гильомом Амптоном. В своей работе «Парижские мемуары» в 1702 году он описал поведение газа в фиксированном объёме[Комм 1] внутри так называемого «воздушного термометра». Жидкость в нём находится в равновесии под воздействием давления газа в резервуаре и атмосферным давлением. При нагревании давление в резервуаре увеличивается, и жидкость вытесняется в выступающий столб. Зависимость между температурой и давлением была установлена в виде[1][Комм 2]:
{\displaystyle {\frac {p_{1}}{p_{2}}}={\frac {1+\alpha t_{1}}{1+\alpha t_{2}}}}
В 1801 году Джон Дальтон в двух своих эссе опубликовал эксперимент, в котором установил, что все газы и пары, исследованные им при постоянном давлении, одинакового расширяются при изменении температуры, если начальная и конечная температура одинакова[2][3]. Данный закон получил название закона Гей-Люссака, так как Гей-Люссак, вскоре провёл самостоятельные эксперименты и подтвердил одинаковое расширение различных газов, причём получив практически тот же самый коэффициент, что и Дальтон[3]. Впоследствии он же объединил свой закон с законом Бойля — Мариотта[4], что позволило описывать в том числе и изохорный процесс.
Термодинамика процесса[править | править вики-текст]

График изохорного процесса на диаграмме (P, V)

Графики изопроцессов в идеальном газе
Из определения работы следует, что изменение работы при термодинамическом процессе равно[5]:
{\displaystyle \delta A=PdV}
Чтобы определить полную работу процесса проинтегрируем данное выражение[5]:
{\displaystyle A=\int \limits _{V_{1}}^{V_{1}}PdV},
Но, поскольку объём неизменен, то такой интеграл равен нулю. Итак, при изохорном процессе газ работы не совершает [6]:
{\displaystyle A=0}.
Это же можно показать на графике изохорного процесса. С математической точки зрения, работа процесса равна площади такого графика[5]. Но график изохорного процесса является перпендикуляром к оси абсцисс. Таким образом, площадь под ним равна нулю.
Изменение внутренней энергии идеального газа можно найти по формуле[7]:
{\displaystyle \Delta U={\frac {i}{2}}\nu R\Delta T},
где {\displaystyle i} — число степеней свободы, которое зависит от количества атомов в молекуле (3 — для одноатомной (например, неон), 5 — для двухатомной (например, кислород) и 6 — для трёхатомной и более (например, молекула водяного пара)).
Из определения и формулы теплоёмкости и, формулу для внутренней энергии можно переписать в виде[7]:
{\displaystyle \Delta U=\nu c_{v}^{\mu }\Delta T},
где {\displaystyle c_{v}^{\mu }} — молярная теплоёмкость при постоянном объёме.
Используя первое начало термодинамики можно найти количество теплоты при термодинамическом процессе[8]:
{\displaystyle Q=\Delta U+A}
Но при изохорном процессе газ не выполняет работу[6]. То есть, имеет место равенство:
{\displaystyle Q=\Delta U=\nu c_{v}^{\mu }\Delta T},
таким образом, вся теплота, которую получает газ, идёт на изменение его внутренней энергии.
Энтропия при изохорном процессе[править | править вики-текст]
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует[9]:
{\displaystyle dS={dQ \over T}}
Выше была выведена формула для определения количества теплоты. Перепишем её в дифференциальном виде[10][Комм 3]:
{\displaystyle dQ=\nu c_{v}^{\mu }dT,}
где {\displaystyle \nu } — количество вещества, {\displaystyle c_{v}^{\mu }} — молярная теплоемкость при постоянном объёме. Итак, микроскопическое изменение энтропии при изохорном процессе можно определить по формуле[10]:
{\displaystyle dS={\nu c_{v}^{\mu }dT \over T}}
Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе[10]:
{\displaystyle \int \limits _{S_{1}}^{S_{2}}dS=\nu \int \limits _{T_{1}}^{T_{2}}{c_{v}^{\mu }dT \over T}\Rightarrow \Delta S=\nu \int \limits _{T_{1}}^{T_{2}}{c_{v}^{\mu }dT \over T}}
В данном случае выносить выражение молярной теплоемкости при постоянном объёме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
Практическое применение теории изохорного процесса[править | править вики-текст]

p — V диаграмма цикла Отто
Основные статьи: Цикл Отто, Адиабатический процесс
При идеальном цикле Отто, который приближённо воспроизведён в бензиновом двигателе внутреннего сгорания, такты 2—3 и 4—1 являются изохорными процессами. Работа, совершаемая на выходе двигателя, равна разности работ, которую произведёт газ над поршнем во время третьего такта (то есть рабочего хода), и работы, которую затрачивает поршень на сжатие газа во время второго такта. Так как в цикле Отто используется система принудительного зажигания смеси, то происходит сжатие газа в 7—12 раз[11]
10. Изобарный процесс
Изоба́рный проце́сс (др.-греч. ἴσος «одинаковый» и βάρος «тяжесть») — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе газа.
Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе {\displaystyle {\frac {V}{T}}=\mathrm {const}.}
Если использовать уравнение Клапейрона — Менделеева, то работа, совершаемая газом при расширении или сжатии газа, равна {\displaystyle A={\frac {m}{M}}R(T_{2}-T_{1})}
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: {\displaystyle \delta Q=\Delta I=\Delta U+P\Delta V.}
Содержание
[скрыть]
Теплоёмкость[править | править вики-текст]
Молярная теплоёмкость при постоянном давлении обозначается как {\displaystyle C_{p}.} В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера {\displaystyle C_{p}=C_{v}+R.}
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной R:
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Изменение энтропии[править | править вики-текст]
Изменение энтропии при квазистатическом изобарном процессе равно {\displaystyle \Delta S=\int \limits _{1}^{2}{\frac {dQ}{T}}.} В случае, если изобарный процесс происходит в идеальном газе, то {\displaystyle dQ=d(\nu C_{v}T+\nu RT)=\nu (C_{v}+R)dT=\nu C_{p}dT,} следовательно, изменение энтропии можно выразить как {\displaystyle \Delta S=\int \limits _{T_{1}}^{T_{2}}\nu C_{p}{\frac {dT}{T}}.} Если пренебречь зависимостью {\displaystyle C_{p}} от температуры (это предположение справедливо, например, для идеального одноатомного газа, но в общем случае не выполняется), то {\displaystyle \Delta S=\nu C_{p}\ln {\frac {T_{2}}{T_{1}}}.}

11. Изотермический процесс
Изотермический процесс (от др.-греч. ἴσος «равный» и θέρμη «жар») — термодинамический процесс, происходящий в физической системе при постоянной температуре.

Несколько изотерм для идеального газа нa p-V диаграмме

Несколько изотерм для идеального газа нa p-V-T диаграмме
Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
В идеальном газе при изотермическом процессе для неизменной массы газа произведение давления на объём постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатах {\displaystyle p,V} — гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (см. рисунок).
В общем случае при изотермическом процессе системе сообщается некоторое количество теплоты {\displaystyle Q} (или она отдаёт теплоту) и системой совершается работа {\displaystyle A} над внешними телами. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
Работа {\displaystyle A}, совершённая идеальным газом в изотермическом процессе, равна {\displaystyle N\,k\,T\,\ln(V_{2}/V_{1})}, где {\displaystyle N} — число частиц газа, {\displaystyle T} — температура, {\displaystyle V_{1}} и {\displaystyle V_{2}} — объём газа в начале и конце процесса, {\displaystyle k} — постоянная Больцмана.
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса записывается в виде:
{\displaystyle Q=A,}
где учитывается, что внутренняя энергия системы в изотермическом процессе не изменяется. Таким образом, в изотермическом процессе вся теплота, полученная системой, расходуется на совершение системой работы над внешними телами.

| Это заготовка статьи по физике. Вы можете помочь проекту, дополнив её. |
12. Адиабатный процесс
Адиабати́ческий, или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.  Серьёзное исследование адиабатических процессов началось в XVIII веке[1].
Серьёзное исследование адиабатических процессов началось в XVIII веке[1]. 
Адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянна[2]. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только обратимые адиабатические процессы[3].
Обратимый адиабатический процесс для идеального газа описывается уравнением Пуассона.  Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой Пуассона. Примером необратимого адиабатического процесса может быть распространение ударной волны в газе. Такой процесс описывается ударной адиабатой. Адиабатическими можно считать процессы в целом ряде явлений природы. Также такие процессы получили ряд применений в технике.
Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой Пуассона. Примером необратимого адиабатического процесса может быть распространение ударной волны в газе. Такой процесс описывается ударной адиабатой. Адиабатическими можно считать процессы в целом ряде явлений природы. Также такие процессы получили ряд применений в технике. 
Содержание
[скрыть]
История[править | править вики-текст]

Уравнение Пуассона позволило описать адиабатический
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!