

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
NaCl + AgNO3 = AgCl↓ + NaNO3 (качественная реакция на галогенид-ионы)
AgCl + 2(NH3 ∙ H2O) = [Ag(NH3)2]Cl + 2H2O 2AgCl  2Ag + Cl2
2Ag + Cl2
Соли кислородсодержащих кислот.
NaClO + 2HCl = NaCl + Cl2 + H2O Ca(ClO)2 + H2SO4 = CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HClO Ca(ClO)2 + Na2CO3 = CaCO3 + 2NaClO
Ca(ClO)2  CaCl2 + O2 4KClO3
CaCl2 + O2 4KClO3  3KClO4 + KCl
3KClO4 + KCl
2KClO3 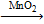 2KCl + 3O2↑ 2KClO3 + 3S
2KCl + 3O2↑ 2KClO3 + 3S  2KCl + 3SO2
2KCl + 3SO2
5KClO3 + 6P  5KCl + 3P2O5 KClO4
5KCl + 3P2O5 KClO4  2O2 + KCl
2O2 + KCl
3KClO4 + 8Al = 3KCl + 4Al2O3
Бром. Соединения брома. Br2 + H2 = 2HBr Br2 + 2Na = 2NaBr
Br2 + Mg = MgBr2 Br2 + Cu = CuBr2 3Br2 + 2Fe = 2FeBr3
Br2 + 2NaOH (разб) = NaBr + NaBrO + H2O 3Br2 + 6NaOH (конц.) = 5NaBr + NaBrO3 + 3H2O
Br2 + 2NaI = 2NaBr + I2 3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2
3Br2 + S + 4H2O = 6HBr + H2SO4 Br2 + H2S = S + 2HBr
Br2 + SO2 + 2H2O = 2HBr + H2SO4 4Br2 + Na2S2O3 + 10NaOH = 2Na2SO4 + 8NaBr+ 5H2O
14HBr + K2Cr2O7 = 2KBr + 2CrBr3 + 3Br2 + 7H2O 4HBr + MnO2 = MnBr2 + Br2 + 2H2O
2HBr + H2O2 = Br2 + 2H2O 2KBr + 2H2SO4 (конц.) = 4K2SO4 + 4Br2 + SO2+ 2H2O
2KBrO3  3O2 + 2KBr 2KBrO4
3O2 + 2KBr 2KBrO4  O2 + 2KBrO3 (до 275°С)
O2 + 2KBrO3 (до 275°С)
KBrO4  2O2 + KBr (выше 390°С)
2O2 + KBr (выше 390°С)
Йод. Соединения йода.
3I2 + 3P = 2PI3 I2 + H2 = 2HI I2 + 2Na = 2NaI
I2 + Mg = MgI2 I2 + Cu = CuI2 3I2 + 2Al = 2AlI3
3I2 + 6NaOH (гор.) = 5NaI + NaIO3 + 3H2O I2 + 2NaOH (разб) = NaI + NaIO + H2O
3I2 + 10HNO3 (разб) = 6HIO3 + 10NO + 2H2O I2 + 10HNO3 (конц.) = 2HIO3 + 10NO2+ 4H2O
I2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO3 + H2O I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O 2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 = 2FeSO4 + I2 + H2SO4 2HI + NO2 = I2 + NO + H2O
2HI + S = I2 + H2S 8KI + 5H2SO4 (конц.) = 4K2SO4 + 4I2 + H2S + 4H2O или 8KI + 9H2SO4 (конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 = HIO3 + KCl + 5HCl 10KI + 8H2SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O 2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 = I2 + 2FeSO4 + K2SO4 2KI + 2CuSO4 + K2SO3 + H2O = 2CuI +2K2SO4+ H2SO4
2HIO3  I2O5 + H2O 2HIO3 + 10HCl = I2 + 5Cl2 + 6H2O
I2O5 + H2O 2HIO3 + 10HCl = I2 + 5Cl2 + 6H2O
2HIO3 + 5Na2SO3 = 5Na2SO4 + I2 + H2O 2HIO3 + 5H2SO4 + 10FeSO4 = Fe2(SO4)3 + I2 + 6H2O
I2O5 + 5CO  I2 + 5CO2 2KIO3
I2 + 5CO2 2KIO3  3O2 + 2KI
3O2 + 2KI
2KIO3 + 12HCl(конц.) = I2 + 5Cl2 + 2KCl + 6H2O KIO3 + 3H2SO4 + 5KI = 3I2 + 3K2SO4 + 3H2O
KIO3 + 3H2O2 = KI + 3O2 + 3H2O 2KIO4  O2 + 2KIO3
O2 + 2KIO3
5KIO4 + 3H2O + 2MnSO4 = 2HMnO4 + 5KIO3 + 2H2SO4
1. В-во, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному р-ру добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим р-ром гидроксида натрия.
|
|
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ, входящий в состав атмосферного воздуха.
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт р-ции полностью нейтрализовали раствором едкого натра и добавили в полученный р-р нитрат серебра.
|
|
8) Газ, выделившийся при нагревании твердой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает тёмную окраску.
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы.
13) Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. Продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия.
|
|
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.
1) 2NaI  2Na + I2 I2 + H2S = 2HI↑ + S↓
2Na + I2 I2 + H2S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl I2 + 6NaOH (гор.) = NaIO3 + 5NaI+ 3H2O
2) 2NaI + 2H2O 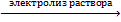 2H2 + 2NaOH + I2 I2 + 2K = 2KI
2H2 + 2NaOH + I2 I2 + 2K = 2KI
8KI + 8H2SO4(конц.) = 4I2↓ + H2S↑ + 4K2SO4 + 4H2O или
8KI + 9H2SO4 (конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3 + 3S + 4KOH
2) Cl2 + H2O ↔ HCl + HClO HCl + NaOH = NaCl + H2O
HClO + NaOH = NaClO + H2O NaClO + 2HCl = NaCl + Cl2 + H2O
4) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑ 9H2SO4(конц.)+ 8NaI(тверд.)= 8NaHSO4 + 4I2↓ +H2S+ 4H2O
NH4OH + HCl = NH4Cl + H2O NH4OH + H2S = NH4HS + H2O
5) 2KClO3 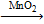 2KCl + 3O2↑ 4KClO3
2KCl + 3O2↑ 4KClO3  KCl + 3KClO4
KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O KCl + AgNO3 = AgCl↓ + KNO3
6) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O 3Cl2 + 6KOH(гор.) = 5KCl + KClO3+ 3H2O
2KClO3 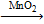 2KCl + 3O2↑ H2SO4(конц.) + NaCl(тверд.) = NaHSO4+ HCl↑
2KCl + 3O2↑ H2SO4(конц.) + NaCl(тверд.) = NaHSO4+ HCl↑
7) 3I2 + 3P = 2PI3 PI3 + 3H2O = H3PO3 + 3HI
HI + NaOH = NaI + H2O NaI + AgNO3 = AgI↓ + NaNO3
8) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑ 16HCl + 2KMnO4 = 5Cl2 +2KCl+2MnCl2+ 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O NaClO + 2HI = NaCl + I2 + H2O
9) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O 2NaBr + Cl2 = 2NaCl + Br2
2NaCl + 2H2O 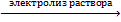 2H2 + 2NaOH + Cl2 H2 + Cl2 = 2HCl
2H2 + 2NaOH + Cl2 H2 + Cl2 = 2HCl
|
|
10) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O Cl2 + 2KOH(хол.) = KCl + KClO + H2O
2KClO3 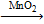 2KCl + 3O2↑ C + O2 = CO2
2KCl + 3O2↑ C + O2 = CO2
11)2NaI + 2H2O 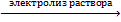 2H2 + 2NaOH + I2 I2 + H2 = 2HI
2H2 + 2NaOH + I2 I2 + H2 = 2HI
8HI + H2SO4 (конц.) = 4I2↓ + H2S↑ + 4H2O или 2HI + H2SO4 (конц.) = I2↓ + SO2↑ + 2H2O
а) H2S + 2KOH = K2S + 2H2O H2S + K2S = 2KHS или
б) SO2 + 2KOH = K2SO3 + 2H2O K2SO3 + SO2 + H2O = 2KHSO3
12) PbO2 = 4HCl + PbCl2 + Cl2↑ + 2H2O 3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O 2KClO3 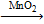 2KCl + 3O2↑
2KCl + 3O2↑
13) I2 + 10HNO3  2HIO3 + 10NO2 + 4H2O 2HIO3
2HIO3 + 10NO2 + 4H2O 2HIO3  I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO  I2 + 5CO2 3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
I2 + 5CO2 3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
14) 2KI + Cl2 = 2KCl + I2 I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
2HIO3  I2O5 + H2O I2O5 + 5CO = I2 + 5CO2
I2O5 + H2O I2O5 + 5CO = I2 + 5CO2
15) I2 + 2HClO3 = 2HIO3 + Cl2 2HIO3  I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO  I2 + 5CO2 I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
I2 + 5CO2 I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
16) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3 Cl2 + 2KOH(хол.) = KCl + KClO + H2O
17) 2NaCl  2Na + CL2 Cl2 + H2 = 2HCl
2Na + CL2 Cl2 + H2 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O Cl2 + 2NaOH(хол.) = NaCl +NaClO + H2O
18) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O 2KClO3 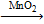 2KCl + 3O2↑
2KCl + 3O2↑
|
|
|

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!